Адсорбцией называют процесс поглощения вещества из смеси газов, паров или растворов поверхностью или объемом пор твердого тела — адсорбента.
Явление адсорбции известно очень давно. Такие природные материалы, как песок и почва, использовали для очистки воды еще на заре человеческого общества. В конце XVIII века К. Шееле и одновременно Фонтана обнаружили способность свежепрокаленного древесного угля поглощать различные газы в объемах, в несколько раз превышающих его собственный объем. Вскоре выяснилось, что величина поглощенного объема зависит от типа угля и природы газа. Т.Е. Ловиц в 1785 году открыл явление адсорбции углем в жидкой среде, подробно исследовал его и предложил использовать уголь для очистки фармацевтических препаратов, спирта, вина, органических соединений. Ловиц показал, что древесный уголь способен быстро очищать испорченную воду и делать ее пригодной для питья. И сейчас основным действующим началом фильтров для воды служат углеродные материалы, конечно более современные, чем природные угли. Адсорбция отравляющих веществ из воздуха была использована Н.Д. Зелинским при создании противогаза во время первой мировой войны.
Адсорбция газов на твердых поверхностях используется в некоторых отраслях пищевой промышленности, а именно масложировой (например, в производстве маргарина) и в бродильной (например, в производстве дрожжей) для очистки технологических газовых потоков с целью предотвращения выбросов вредных веществ в атмосферу. Поглощение паров воды происходит на пористых веществах, которые выполняют роль твердого адсорбента. Подобные процессы наблюдаются в отношении сахара, соли и сухарей. Адсорбционный способ регулирования газового состава хранилищ скоропортящихся продуктов позволяет в несколько раз сократить потери и увеличить сроки хранения. Адсорбция различных пищевых кислот, лимонной в частности, снижает по сравнению с водой поверхностное натяжение большинства прохладительных напитков. Адсорбция веществ на поверхности раздела жидкость — газ способствует устойчивости пен. Подобный процесс имеет место в бродильной промышленности при производстве дрожжей и некоторых других полупродуктов. Усиление смачивания водой различных поверхностей широко используется в промышленности в качестве сопутствующего процесса при мойке оборудования, подготовке сырья, обработке полуфабрикатов и т.д. Адсорбция на границе твердое тело — жидкость широко применяется при очистке жидкостей (например, диффузионного сока при производстве сахара, растительных масел и соков) от примесей.
Абсорбционные, адсорбционные и хемосорбционные методы очистки отходящих газов
Различают физическую и химическую адсорбцию (хемосорбцию). 1. АБСОРБЦИОННЫЕ МЕТОДЫ ОЧИСТКИ ОТХОДЯЩИХ ГАЗОВ 1.1 Основы процесса Абсорбция жидкостями применяется в промышленности для извлечения из газов диоксида серы, сероводорода ... ряду требований. При физической абсорбции в качестве абсорбента чаще всего используют воду, а также органические растворители и минеральные масла, не реагирующие с ...
Развитие теории адсорбционных сил еще не достигло такой стадии, когда по известным физико-химическим свойствам газа и твердого тела можно было бы рассчитать изотерму адсорбции, не проводя экспериментальных исследований. Поэтому попыткам описать экспериментальные изотермы с помощью различных теоретических уравнений, которым соответствуют определенные модели адсорбции, посвящено огромное количество работ. Если теоретическое уравнение изотермы адсорбции хорошо воспроизводит экспериментальные данные, то можно рассчитать неизвестные величины адсорбции при разных условиях (р и Т) и определить различные геометрические параметры твердых тел. Рассмотрим лишь немногие, наиболее распространенные теоретические уравнения изотерм адсорбции.
1. Классификация процесса, основные определения
1.1 Основные понятия процесса адсорбции, Адсорбцией
Поглощение газов, паров и растворенных веществ твердыми телами обычно сопровождается процессами проникновения поглощаемого вещества в твердое тело (абсорбцией), капиллярной конденсацией и химическими реакциями (хемосорбцией), что весьма затрудняет изучение собственно адсорбции. Поэтому поглощение газов, паров и растворенных веществ твердыми телами обычно рассматривается как общий процесс сорбции.
Адсорбция всегда сопровождается выделением тепла. В большинстве случаев тепловой эффект адсорбции по своей величине приближается к теплоте конденсации поглощаемого газа или пара.
Адсорбцию подразделяют на два вида: физическую и химическую. Физическая адсорбция в основном обусловлена поверхностными вандервальсовыми силами, которые проявляются на расстояниях, значительно превышающих размеры адсорбируемых молекул, поэтому на поверхности адсорбента обычно удерживаются несколько слоев молекул адсорбата.
При химической адсорбции поглощаемое вещество вступает в химическое взаимодействие с адсорбентом с образованием на его поверхности обычных химических соединений.
Силы притяжения возникают на поверхности адсорбента благодаря тому, что силовое поле поверхностных атомов и молекул не уравновешено силами взаимодействия соседних частиц. По физической природе силы взаимодействия молекул поглощаемого вещества и адсорбента относятся в основном к дисперсионным, возникающим благодаря перемещению электронов в сближающихся молекулах. В ряде случаев адсорбции большое значение имеют электростатические и индукционные силы, а также водородные связи. Поэтому адсорбция является самопроизвольным процессом, течение которого сопровождается уменьшением свободной энергии и энтропии системы.
Процессы адсорбции избирательны и обратимы. Процесс, обратный адсорбции, называют десорбцией, которую используют для выделения поглощенных веществ и регенерации адсорбента.
Наиболее рационально применять адсорбцию для обработки смесей с низкой концентрацией извлекаемых веществ.
Статическая и динамическая активность адсорбентов
Основной характеристикой адсорбента является его активность, определяемая весовым количеством вещества, поглощенного единицей объема или веса поглотителя.
Различают активность статическую и динамическую.
Статическая активность, Динамическая активность
Если газовая смесь проходит через слой адсорбента, то в начальный период процесса адсорбтив полностью извлекается из газовой смеси. По истечении определенного промежутка времени в газовой смеси, уходящей из поглотителя, начинают появляться заметные, все возрастающие количества адсорбтива (проскок), и к концу процесса концентрация уходящего газа становится равной начальной концентрации паровоздушной смеси.
Профилактика воздействия вредных газов, паров и пыли на человека
... устройство специальной вытяжной вентиляции от мест образования пыли, газов, паров; 7. изоляция процессов, при которых в воздухе выделяется пыль и газы, от участков других работ; 8. тщательная систематическая ... вентиляция устраивается, если требуется удалять загрязненный воздух от мест образования или выхода вредных выделений, не допуская его поступления в рабочую зону помещения. Местная приточная ...
В адсорберах промышленного типа с активированным углем динамическая активность составляет 85-95% от статической, а в случае применения силикагеля динамическая активность оказывается меньше статической на 60-70%.
Селективные свойства адсорбентов
В процессах адсорбции, так же как и в процессах абсорбции, поглощающие вещества (адсорбенты обладают селективными свойствами по отношению к поглощаемым газам и парам. Иными словами, применение адсорбционных процессов в качестве метода разделения газовых смесей основано на том, что газовая смесь, приведенная в соприкосновение с адсорбентом, освобождается лишь от одного компонента, в то время как другие оказываются непоглощенными.
Если в процессах абсорбции селективные качества процесса определялись растворимостью или нерастворимостью газа в поглощающей жидкости, то в процессах адсорбции критерием селективных качеств является статическая активность адсорбента.
Из смеси газов, приведенных в соприкосновение с адсорбентом, в первую очередь и в значительно большем количестве поглощается газ или пар того вещества, которое имеет более высокую температуру кипения. В большинстве случаев температура кипения поглощаемого газа (например, паров бензола) сильно отличается от температуры кипения инертного газа (например, воздуха) и присутствие инертного газа почти не оказывает влияния на ход процесса. В данном случае поглощение бензола из паровоздушной смеси с парциальной упругостью паров бензола р протекает точно так же, как и поглощение чистых паров бензола, имеющих то же давление.
Разделение адсорбционным методом смеси газов, компоненты которой имеют близко лежащие температуры кипения, предоставляет большие трудности или практически невозможно.
1.2 Основные промышленные адсорбенты и их свойства
Основными промышленными адсорбентами являются пористые тела, обладающие большим объемом микропор. Свойства адсорбентов определяются природой материала, из которого они изготовлены, и пористой внутренней структурой.
В промышленных адсорбентах основное количество поглощенного вещества сорбируется на стенках микропор (r < 10 9 м).
Роль переходных пор (10-9 < r < 10-7 м) и макропор (r < 10-7 м) в основном сводится к транспортированию адсорбируемого вещества к микропорам.
равновесной активностью
По химическому составу все адсорбенты можно разделить на углеродные и неуглеродные. К углеродным адсорбентам относятся активные (активированные угли), углеродные волокнистые материалы, а также некоторые виды твердого топлива. Неуглеродные адсорбенты включают в себя силикагели, активный оксид алюминия, алюмагели, цеолиты и глинистые породы.
Активные угли, состоящие из множества беспорядочно расположенных микрокристаллов графита, обычно используют для поглощения органических веществ в процессах очистки и разделения жидкостей и газов (паров).
Адсорбционная очистка газов
... которой происходит поглощение компонента, называется газом-носителем, твердое вещество, поглощающее компонент - адсорбента. поглощаемое вещество - адсорбттом, поглощенное вещество - адсорбатом. Особенностью процессов адсорбции является избирательность и обратимость. Благодаря этой особенности процесса возможно поглощение из парогазовых смесей ...
Эти адсорбенты получают сухой перегонкой ряда углеродсодержащих веществ (древесины, каменного угля, костей животных, косточек плодов и др.).
После этого уголь активируют, например прокаливают его при температуре 850-900 о С, что приводит к освобождению пор от смолистых веществ и образованию новых микропор. Активацию проводят также экстрагированием смол из пор органическими растворителями, окислением кислородом воздуха и др. Более однородная структура углей получается при их активации химическими методами: путем их обработки горячими растворами солей (сульфатами, нитратами и др.) или минеральными кислотами (серной, азотной и др.)
Качество активированных углей зависит от свойств исходных углеродсодержащих материалов и от условий активации. Характеристикой степени активации активированного угля является обгар, т. е. сгоревшая часть угля, выраженная в процентах от количества исходного материала.
Активированный уголь применяется при адсорбции либо в виде зерен величиной от 1 до 7 мм, либо в виде порошка. Зерна и порошок получают путем измельчения и классификации. Удельная активная поверхность активных углей выражается величиной от 600 до 1700 м 2 на один грамм. Применяются активированные угли главным образом для поглощения паров органических жидкостей, находящихся в газовых смесях, и для очистки различных растворов от примесей.
Серьезным недостатком этих углей является горючесть, и применять их можно при температурах не выше 200°. Для уменьшения горючести к ним подмешивают силикагель, однако такая добавка приводит к понижению активности адсорбента, поэтому активированные угли с добавкой к ним силикагеля практически применяют сравнительно редко.
Силикагелем
Силикагель отличается однородностью пор как по величине, так и распределению. Применяется силикагель в виде зерен диаметром от 0,2 до 7 мм главным образом для поглощения паров воды, т. е. для сушки газов. Удельная активная поверхность силикагеля выражается величиной порядка 600 м 2 на один грамм.
К достоинствам силикагелей относятся их негорючесть и большая механическая прочность. Недостатком относится резкое снижение поглотительной способности по отношению к парам органических веществ в присутствии влаги.
По сорбционным свойствам к силикагелю близко примыкают алюмагели, получаемые термической обработкой гидроксида алюминия при температурах 600-1000 о С. Поры полученного сорбента имеют диаметр 1-3 нм, удельную поверхность 2·10 5 — 4·10 5 м2 /кг; насыпная плотность такого сорбента 1600 кг/м3 . Алюмагели используют для осушки газов, очистки водных растворов и минеральных масел.
Цеолиты представляют собой природные или синтетические минералы, которые являются водными алюмосиликатами, содержащими оксиды щелочных щелочноземельных металлов. Эти адсорбенты отличаются регулярной структурой пор, размеры которых соизмеримы с размерами поглощаемых молекул. Особенность цеолитов состоит в том, что адсорбционные поверхности соединены между собой окнами определенного диаметра, через которые могут проникать только молекулы меньшего размера. На этом основано разделение смесей с разными по размеру молекулами, что послужило причиной называть цеолиты молекулярными ситами.
Для разделения газовых смесей применяют цеолиты в виде шариков или гранул размером от 1 до 5 мм, а для разделения жидких смесей — в виде мелкозернистого порошка.
Особенно широко цеолиты используют для глубокой осушки газов и жидкостей, в процессах очистки и разделения смесей веществ с близкой молекулярной массой, а также в качестве в качестве катализаторов и их носителей.
Для очистки жидкостей от различных примесей в качестве адсорбентов применяют природные глинистые породы. Эти глины для их активации обрабатывают серной или хлороводородной кислотами и получают адсорбент с удельной поверхностью пор порядка (1,0 ÷1,5)·10 5 м2 /кг.
1.3 Изотерма адсорбции
Количество поглощенного вещества, соответствующее равновесному состоянию, зависит от концентрации поглощаемого компонента в газовой смеси или в растворе или, что то же самое, от парциального давления поглощаемого компонента в смеси и может быть выражено уравнением (1.3.1)
a=f(p)
где a — количество вещества, поглощаемого весовой или объемной единицей адсорбента при достижении фазового равновесия, в кгс/кгс или в кгс/м3 ; р — парциальное давление поглощаемого компонента в газовой фазе в мм pm. cm.
Кривая, выражающая эту функциональную зависимость при достижении состояния равновесия, называется изотермой адсорбции. Типичные кривые зависимости между количеством поглощаемого компонента и его давлением приведены на рис. 1.3.1
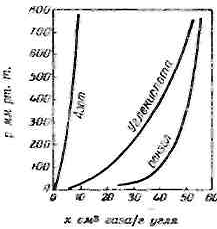
Рис. 1.3.1 — Кривые абсорбции
2. Закономерности процесса адсорбции, .1 Теории адсорбции
Единой теории, которая достаточно корректно описывала бы все виды адсорбции на разных поверхностях раздела фаз, не имеется; рассмотрим поэтому некоторые наиболее распространенные теории адсорбции, описывающие отдельные виды адсорбции на поверхности раздела твердое тело — газ или твердое тело — раствор.
Теория мономолекулярной адсорбции Ленгмюра
Теория мономолекулярной адсорбции, которую разработал американский химик И. Ленгмюр <#»541160.files/image002.gif»>
- Рис. 2.1.1 — Изотерма мономолекулярной адсорбции
В состоянии равновесия скорость адсорбции равна скорости десорбции. Скорость десорбции прямо пропорциональна доле занятых активных центров (х), а скорость адсорбции прямо пропорциональна произведению концентрации адсорбата на долю свободных активных центров (1 — х):
![]() (2.1.1)
(2.1.1)
![]() (2.1.2)
(2.1.2)
![]() (2.1.3)
(2.1.3)
Отсюда находим х:
![]() (2.1.4)
(2.1.4)
Разделив числитель и знаменатель правой части уравнения (2.1.4) на k A , получим:
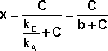 (2.1.5)
(2.1.5)
Максимально возможная величина адсорбции Г о достигается при условии, что все активные центры заняты молекулами адсорбата, т.е. х = 1. Отсюда следует, что х = Г / Го . Подставив это в уравнение (2.1.5), получаем:
![]() (2.1.6)
(2.1.6)
![]() (2.1.7)
(2.1.7)
изотерма мономолекулярной адсорбции
При описании процесса адсорбции газов в уравнении (2.1.7) концентрация может быть заменена пропорциональной величиной парциального давления газа:
![]() (2.1.8)
(2.1.8)
Теория мономолекулярной адсорбции Ленгмюра применима для описания некоторых процессов адсорбции газов и растворенных веществ при небольших давлениях (концентрациях) адсорбата.
Теория полимолекулярной адсорбции Поляни
На практике часто (особенно при адсорбции паров) встречаются т.н. S-образные изотермы адсорбции (рис. 2.1.2), форма которых свидетельствует о возможном, начиная с некоторой величины давления, взаимодействии адсорбированных молекул с адсорбатом.
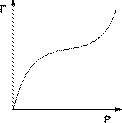
Рис. 2.1.2 — Изотерма полимолекулярной адсорбции
Для описания таких изотерм адсорбции М. Поляни <#»541160.files/image012.gif»> (2.1.9)
![]() (2.1.10)
(2.1.10)
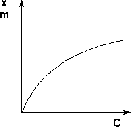
( а )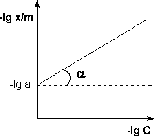
|
( б ) |
Рис. 2.1.3 — Изотерма адсорбции Фрейндлиха в обычных (а) и
логарифмических координатах (б)
Показатель степени n и коэффициент пропорциональности а в уравнении Фрейндлиха определяются экспериментально. Логарифмируя уравнения (2.1.9 — 2.1.10), получаем:
![]() (2.1.11)
(2.1.11)
![]() (2.1.12)
(2.1.12)
lg
(2.1.13)
2.2 Адсорбция на границе раствор — пар
поверхностно-активными
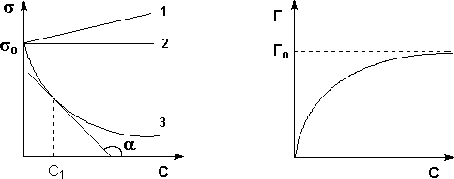
Рис. 2.2.1 — Изотермы поверхностного Рис. 2.2.2 — Изотерма адсорбции
натяжения растворов ПАВ (1, 2) и ПАВ на границе раствор-пар
ПИАВ (3)
Уменьшение поверхностного натяжения и, следовательно, поверхностной энергии происходит в результате адсорбции ПАВ на поверхности раздела жидкость — пар, т.е. того, что концентрация поверхностно-активного вещества в поверхностном слое раствора оказывается больше, чем в глубине раствора.
поверхностный избыток
График изотермы адсорбции ПАВ представлен на рис. 2.2.1 Из уравнения (2.2.1) следует, что направление процесса — концентрирование вещества в поверхностном слое или, наоборот, нахождение его в объеме жидкой фазы — определяется знаком производной dσ/dС. Отрицательная величина данной производной соответствует накоплению вещества в поверхностном слое (Г > 0), положительная — меньшей концентрации вещества в поверхностном слое по сравнению с его концентрацией в объеме раствора.
Величину g = -dσ/dС называют также поверхностной активностью растворенного вещества. Поверхностную активность ПАВ при некоторой концентрации С1 определяют графически, проводя касательную к изотерме поверхностного натяжения в точке С = С1 ; при этом поверхностная активность численно равна тангенсу угла наклона касательной к оси концентраций:
![]() (2.2.2)
(2.2.2)
Нетрудно заметить, что с ростом концентрации поверхностная активность ПАВ уменьшается. Поэтому поверхностную активность вещества обычно определяют при бесконечно малой концентрации раствора; в этом случае её величина, обозначаемая gо , зависит только от природы ПАВ и растворителя. Исследуя поверхностное натяжение водных растворов органических веществ, Траубе и Дюкло установили для гомологических рядов поверхностно-активных веществ следующее эмпирическое правило:
В любом гомологическом ряду при малых концентрациях удлинение углеродной цепи на одну группу СН2 увеличивает поверхностную активность в 3 — 3.5 раза.
Для водных растворов жирных кислот зависимость поверхностного натяжения от концентрации описывается эмпирическим уравнением Шишковского:
![]() (2.2.3)
(2.2.3)
Здесь b и K — эмпирические постоянные, причём значение b одинаково для всего гомологического ряда, а величина К увеличивается для каждого последующего члена ряда в 3 — 3,5 раза.
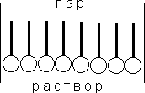
Рис. 2.2.3 — Предельная ориентация молекул ПАВ в поверхностном слое
Молекулы большинства ПАВ обладают дифильным строением, т.е. содержат как полярную группу, так и неполярный углеводородный радикал. Расположение таких молекул в поверхностном слое энергетически наиболее выгодно при условии ориентации молекул полярной группой к полярной фазе (полярной жидкости), а неполярной — к неполярной фазе (газу или неполярной жидкости).
При малой концентрации раствора тепловое движение нарушает ориентацию молекул ПАВ; при повышении концентрации происходит насыщение адсорбционного слоя и на поверхности раздела фаз образуется слой «вертикально» ориентированных молекул ПАВ (рис. 2.2.3).
Образование такого мономолекулярного слоя соответствует минимальной величине поверхностного натяжения раствора ПАВ и максимальному значению адсорбции Г (рис. 2.2.1-2.2.2); при дальнейшем увеличении концентрации ПАВ в растворе поверхностное натяжение и адсорбция не изменяются.
2.3 Адсорбция на границе твердое тело — газ
При адсорбции газов на твердых телах описание взаимодействия молекул адсорбата и адсорбента представляет собой весьма сложную задачу, поскольку характер их взаимодействия, определяющий характер адсорбции, может быть различным. Поэтому обычно задачу упрощают, рассматривая два крайних случая, когда адсорбция вызывается физическими или химическими силами — соответственно физическую и химическую адсорбцию.
Физическая адсорбция, Химическая адсорбция
Следует подчеркнуть, что явления физической и химической адсорбции чётко различаются в очень редких случаях. Обычно осуществляются промежуточные варианты, когда основная масса адсорбированного вещества связывается сравнительно слабо и лишь небольшая часть — прочно. Например, кислород на металлах или водород на никеле при низких температурах адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать химическая адсорбция. При повышении температуры увеличение химической адсорбции с некоторой температуры начинает перекрывать падение физической адсорбции, поэтому температурная зависимость адсорбции в этом случае имеет четко выраженный минимум (рис. 2.3.1).
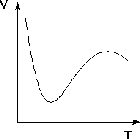
Рис. 2.3.1 — Зависимость объема адсорбированного никелем водорода от
температуры
2.4 Адсорбция на границе твердое тело — раствор, .4.1 Молекулярная адсорбция из растворов
Изотермы адсорбции растворенных веществ из раствора по своему виду аналогичны изотермам адсорбции для газов; для разбавленных растворов эти изотермы хорошо описываются уравнениями Фрейндлиха или Ленгмюра, если в них подставить равновесную концентрацию растворенного вещества в растворе. Однако адсорбция из растворов является значительно более сложным явлением по сравнению с газовой, поскольку одновременно с адсорбцией растворенного вещества часто происходит и адсорбция растворителя.
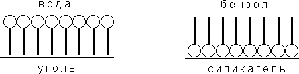
Рис. 2.4.1 — Ориентация молекул ПАВ на поверхности адсорбента
Зависимость адсорбции от строения молекул адсорбата очень сложна, и вывести какие-либо закономерности довольно трудно. Молекулы многих органических веществ состоят из полярной (гидрофильной) и неполярной (гидрофобной) группировок, т.е. являются поверхностно-активными веществами. Молекулы ПАВ при адсорбции на твердом адсорбенте ориентируются на его поверхности таким образом, чтобы полярная часть молекулы была обращена к полярной фазе, а неполярная — к неполярной. Так, при адсорбции алифатических карбоновых кислот из водных растворов на неполярном адсорбенте — активированном угле — молекулы ориентируются углеводородными радикалами к адсорбенту; при адсорбции из бензола (неполярный растворитель) на полярном адсорбенте — силикагеле — ориентация молекул кислоты будет обратной (рис. 2.4.1).
2.4.2 Адсорбция из растворов электролитов, Обменная адсорбция
специфической адсорбции
Рис. 3.1.1 — Схема установки для адсорбции активированным углем:
/, // -адсорберы; 1, 3 — конденсаторы; 2, 4 — сепараторы; 5 — газодувка;
- подогреватель;
- 7 — конденсатор;
- а, б, в, г, д, е — задвижки
На рис. 3.1.1 показана схема адсорбционной установки, предназначенной для извлечения углеводородов из газов. В адсорбере / происходит поглощение, а в адсорбере // за это же время-десорбция, сушка и охлаждение. Из адсорбера / газ поступает в распределительную линию. На схеме показан цикл десорбции в адсорбере // , поэтому задвижки а и б открыты и в адсорбер поступает водяной пар. Отогнанные углеводороды вместе с водяными парами поступают в конденсатор 1, где конденсируется большая часть водяных паров; образующаяся при этом вода отделяется в сепараторе 2, а пары углеводородов с оставшимся небольшим количеством водяного пара конденсируются в конденсаторе 3. Вода отделяется в сепараторе 4; из сепаратора углеводороды направляются в сборник, а неконденсирующиеся пары-на компрессию для перевода их в конденсат.
После окончания десорбции задвижки а и б закрывают, открывают задвижки б, г, д и пускают в ход газодувку 5. Перед этим подается водяной пар в подогреватель б; нагреваясь в нем, газ поступает в адсорбер // через задвижки в и г. Выходя из адсорбера // через задвижку д, газ попадает в конденсатор 7 и далее засасывается газодувкой 5. Через некоторое время, когда из адсорбера // будет вытеснен оставшийся в нем после десорбции водяной пар и сконденсирован в конденсаторе 7, задвижку е закрывают и начинается циркуляция газа: через газодувку, подогреватель 6, адсорбер //, конденсатор 7 и снова газодувку. Поглощаемая газом в адсорбере // влага конденсируется в конденсаторе 7. После окончания сушки прекращают подачу пара в подогреватель 6 и газ направляется мимо него; при этом начинается цикл охлаждения адсорбера //. По его окончании газодувку 5 выключают, а задвижки переключают для перевода адсорбера //на поглощение, а адсорбер / на десорбцию.
Процесс адсорбции проводят также за три цикла. В этом случае после окончания первого цикла-адсорбции уголь нагревается горячим инертным газом и выделяющиеся при этом пары поглощенного вещества отводятся в конденсатор. Этот цикл-десорбция заканчивается продувкой угля водяным паром, после чего уголь охлаждается холодным воздухом. Таким образом, при этом методе отсутствует цикл сушки и полная регенерация угля достигается при охлаждении.
Известен также метод адсорбции, проводимый за два цикла; при этом нагретую паровоздушную смесь пропускают через горячий и влажный активированный уголь и одновременно с поглощением паров происходит также подсушивание угля. Затем через уголь пропускают холодную паровоздушную смесь с тем, чтобы одновременно с поглощением происходило охлаждение адсорбента. После окончания адсорбции производится десорбция водяным паром, после чего через горячий и влажный уголь вновь пропускают нагретую паровоздушную смесь. Экономически наиболее выгодным является именно этот метод, проводимый за два цикла, так как расход энергии меньше, а производительность установки значительно выше.
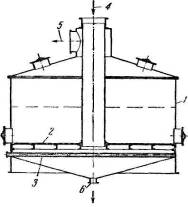
Рис. 3.1.2 — Угольный адсорбер:
- корпус;
- 2 — решетка;
- 3 — парораспределитель;
- 4 — вход
паровоздушной смеси; 5 — выход непоглощенного газа;
- выход влаги
На рис. 3.1.2 представлен вертикальный угольный адсорбер; активированный уголь располагается в виде слоя на решетке 2, паровоздушная смесь подается под решетку по трубе 4, а не поглощенная часть паровоздушной смеси удаляется через патрубок 5.
На рис. 3.1.3 представлен горизонтальный адсорбер и на рис. 6 кольцевой адсорбер, устройство которых не требует пояснении.
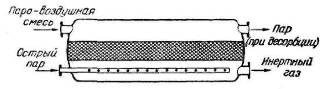
Рис. 3.1.3 — Горизонтальный адсорбер
3.2 Адсорбция силикагелем
Гель двуокиси кремния Si0 2 , или силикагель, применяется в сорбционной технике в виде зерен (напоминающих по размерам и структуре гранулированный уголь) или в виде тончайшей пыли.
Адсорбционные установки, работающие на зернистом силикагеле, аналогичны установкам на активированном угле с применением регенерации адсорбента.
Однако регенерация силикагеля и десорбция из него адсорбтива могут значительно отличаться от методов регенерации угля и десорбции из него адсорбированных продуктов. Отличие в методе регенерации вызвано тем, что силикагель не меняет своей структуры и адсорбционных качеств под воздействием высокой температуры. Так, например, широко практикуется регенерация силикагеля путем нагревания его до 300°, в то время как нагревание активированного угля даже до 200° недопустимо.
Адсорбцию силикагелем производят на установках с автоматическим переключением адсорберов, в которых десорбция и регенерация осуществляются одновременно путем продувки через адсорбент горячего воздуха.
Применение пылеобразного силикагеля позволяет осуществлять процесс адсорбции непрерывным методом с движением адсорбента и адсорбтива противотоком друг к другу (рис. 3.2.2).
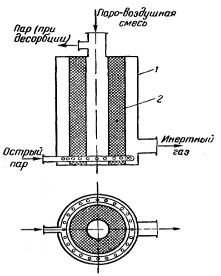
Рис. 3.2.1 — Кольцевой адсорбер:
- корпус адсорбера; 2- слой адсорбента
В адсорбер 1, который представляет собой полый стальной цилиндрический аппарат, состоящий из нескольких царг, снизу поступает газовая смесь. Навстречу газовому потоку в адсорбере перемещается сверху вниз охлажденная пыль силикагеля. Для полного поглощения адсорбтива достаточно контакта фаз в течение непродолжительного времени; пыль силикагеля, собирающаяся внизу аппарата, является насыщенной, а газы, уходящие из адсорбера, не содержат поглощаемого компонента. Отработанный силикагель из нижней части аппарата перемещается шнеком и подается в десорбер 2, где происходят одновременно десорбция и регенерация путем нагревания.
Освобожденная от поглощаемого газа газовая смесь выходит из адсорбера 1 в верхней части его и. пройдя последовательно через циклон 7 и пылеуловитель 8, подается газодувкой 9 в атмосферу или в какие-нибудь аппараты для дальнейшей обработки. Циклон соединяется трубопроводом с нижней частью аппарата, и осевшая в нем пыль адсорбента «самотеком» перемещается в десорбер. Для пневматического перемещения пыли силикагеля из десорбера в адсорбер используют газы, освобожденные от поглощаемого компонента, для чего отводящий газопровод соединен также с газодувкой 5.
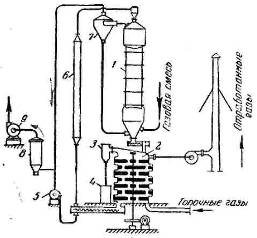
Рис. 3.2.2 — Схема установки для адсорбции силикагелем:
- адсорбер;
- 2 — десорбер;
- 3 — конденсатор;
- 4 — сборник;
- , 9 — газодувка;
- 6 — холодильник;
- 7 — циклон;
- 8 — пылеуловитель
Активность силикагеля несколько меньше, чем активированного угля; степень поглощения силикагелем составляет в среднем 92% и в лучшем случае достигает 95-97%. В то же время силикагель обладает преимуществами по сравнению с активированным углем: меньше расходуется адсорбента, так как силикагель может работать непрерывно гораздо дольше активированного угля и десорбция из силикагеля может проводиться при более высоких температурах.
Десорбер представляет собой нагреватель, имеющий несколько пустотелых полок, в которых циркулируют дымовые газы.
Пыль силикагеля постепенно перемещается в десорбере сверху вниз, с полки на полку, при помощи гребков. В десорбере из адсорбента полностью удаляются поглощенные им газы и пары. Образовавшиеся в десорбере пары поглощенного вещества направляются в конденсатор 3, и после конденсации собираются в сборник 4. Регенерированная пыль силикагеля через нижний шнек удаляется из десорбера. затем подается пневматически (газодувкой 5) через холодильник 6 в верхнюю часть адсорбера для повторного поглощения. Таким образом, осуществляется непрерывная адсорбция и замкнутая циркуляция пыли силикагеля в системе.
Расход адсорбента определяют по его динамической активности, которая для заданных условий принимается по опытным данным. Скорость десорбции газа, равно как и время, необходимое для осуществления регенерации адсорбента, также определяют по опытным данным.
3 Гиперсорбция
адсорбция промышленный адсорбент изотерма
гиперсорбцией
Схема одной из простейших адсорбционных установок непрерывного действия представлена на рис. 3.3.1.
Основным аппаратом установки является колонна 5, разделенная на несколько секций. Внутри этой колонны под действием силы тяжести твердый гранулированный адсорбент движется сверху вниз со скоростью, регулируемой механизмом выгрузки 8.
Газовая смесь, подлежащая разделению, подается в колонну разделения через специальную распределительную тарелку 4 и, проходя по адсорбционной секции колонны 3 противотоком к адсорбенту, отдает ему хорошо адсорбируемые компоненты, которые и поглощаются адсорбентом. Неадсорбированный газ проходит через холодильник 2, где охлаждается кодой, и удаляется из верхней части колонны в виде головной фракции.
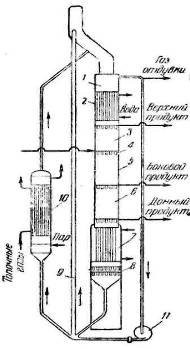
Рис. 3.3.1 — Схема установки для непрерывного разделения газовых
смесей методом гиперсорбции:
- бункер;
- 2 — холодильник;
- 3 — адсорбционная секция;
- распределительная тарелка;
- 5 — колонна;
- 6 — ректификационная
секция; 7 — отпарная секция; 8 — механизм выгрузки; 9 — газлифт;
- реактиватор; 11 — газодувка
Однако регенерация силикагеля и десорбция из него адсорбтива могут значительно отличаться от методов регенерации угля и десорбции из него адсорбированных продуктов. Отличие в методе регенерации вызвано тем, что силикагель не меняет своей структуры и адсорбционных качеств под воздействием высокой температуры. Так, например, широко практикуется регенерация силикагеля путем нагревания его до 300°, в то время как нагревание активированного угля даже до 200° недопустимо.
Адсорбцию силикагелем производят на установках с автоматическим переключением адсорберов, в которых десорбция и регенерация осуществляются одновременно путем продувки через адсорбент горячего воздуха.
Применение пылеобразного силикагеля позволяет осуществлять процесс адсорбции непрерывным методом с движением адсорбента и адсорбтива противотоком друг к другу
Десорбция поглощенного газа осуществляется в отпарной секции 7 колонны глухим паром и отдувкой сорбента острым перегретым паром. Последний выводится вместе с тяжелой фракцией-донным продуктом — и отделяется от него конденсацией.
В ректификационной секции 6 установки десорбированный компонент выводится из колонны в виде бокового и донного продуктов. При повышении температуры десорбированные тяжелые компоненты поднимаются в виде «флегмы» вверх по колонне, вытесняя плохо сорбируемые компоненты. Благодаря такому «флегмированию» может быть получен донный продукт высокой степени чистоты.
Освобожденный от поглощенных газов адсорбент после десорбции подается из нижней части колонны снова в бункер 1 колонны при помощи газлифта 9 газодувкой 11 и из бункера снова в колонну, совершая таким образом непрерывную циркуляцию.
В качестве адсорбента в описанной установке применяется активированный уголь высокой активации.
Для того чтобы активность угля не падала, часть адсорбента, направляемого газлифтом в бункер, отбирается и пропускается через реактиватор 10, где отпаривается при более высокой температуре. Реактиватор обогревается топочными газами. Отдувка сорбента производится острым паром, который отводится вверху реактиватора вместе с продуктами отдувки. Благодаря реактивации активность сорбента при длительной работе установки не снижается.
Работа установки полностью автоматизирована, что способствует получению продуктов высокой чистоты (99%).
Потери адсорбента от износа составляют за один цикл от 0,001 до 0.0005%.
Производительность колонны разделения определяется максимально допустимыми нагрузками по газу на единицу сечения колонны, при которых газовый поток еще не разрыхляет (взвешивает) слой адсорбента. При разделении газовых смесей нагрузка будет наибольшей в адсорбционной секции колонны. Особенно велика нагрузка адсорбционной секции колонны по сравнению с нагрузкой ректификационных секций в тех случаях, когда разделяемая смесь содержит большое количество легких компонентов. Для повышения производительности колонны в ней устанавливают несколько питающих тарелок, имеющих каждая свою адсорбционную секцию, где осуществляется противоточный контакт газа со свежим адсорбентом. Это достигается индивидуальной подачей адсорбента в верхнюю часть каждой секции и регулированием соответствующего отбора в основании каждой секции с помощью специального распределителя. Схема колонны с двумя питающими тарелками представлена на рис. 3.3.2.
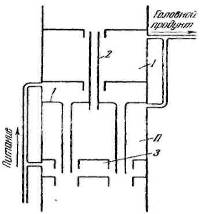
труба для подачи свежего адсорбента во вторую адсорбционную
секцию; 3 — распределительное устройство
Колонна имеет две адсорбционные секции I и II, разделенные перегородкой 1. Свежий адсорбент подается в секцию II по внутриколонным трубам 2. Оба потока сорбента из двух секций соединяются в пространстве, где помещается распределительное устройство 3, и направляются в ректификационную секцию колонны. Газ при этом также разделяется на два потока, каждый из которых проходит свою адсорбционную секцию. Повышение производительности при этом приблизительно прямо пропорционально числу питающих тарелок.
Распределительная тарелка имеет назначение равномерно распределять газ по сечению колонны и предотвращать унос сорбента газами. Тарелка представляет собой плоскую плиту с отверстиями, в которые завальцованы в определенном порядке патрубки длиной 0,46-0,61 м. Тарелки монтируются патрубками вниз; через патрубки движется адсорбент.
Механизм выгрузки определяет скорость движения адсорбента по колонне и сохраняет направление этой скорости в плоскости по всему сечению колонны. Он состоит из трех описанных выше распределительных тарелок с патрубками; две тарелки неподвижны, а одна-средняя-движется. При возвратно-поступательном движении патрубки средней тарелки попеременно заполняются сорбентом, ссыпающимся с верхней тарелки, и разгружаются через патрубки нижней тарелки. Скорость циркуляции сорбента определяется частотой колебаний подвижной тарелки. Благодаря большому числу патрубков и равномерному их распределению в тарелках выгрузка сорбента с единицы площади сечения колонны везде одинакова, что определяет его плоскопараллельное движение.
Передача адсорбента из колонны в газлифт осуществляется через гидрозатвор, схема устройства которого показана на рис. 3.3.3. Гидрозатвор представляет собой высокую трубу 1 небольшого диаметра, заполненную сорбентом. В нижней части гидрозатвора установлен механизм выгрузки клапанного типа 2, который связан с указателем уровня, помещенным в верхней части гидрозатвора. Такая связь обеспечивает синхронность выгрузки обоими механизмами и заполненность гидрозатвора сорбентом. Гидрозатвор устраняет возможность перетока в колонну газа, подаваемого газодувкой в газлифт.
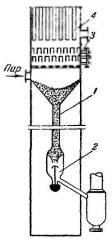
Рис. 3.3.3 — Схема устройства гидрозатвора:
- труба: 2 — механизм выгрузки;
- 5 — тарельчатый механизм;
- отпарная секция
Водяной холодильник 2 и отпарная секция 7 выполнены в виде кожухотрубных теплообменников высотой 0,4 м. Сорбент движется внутри трубок диаметром 25 мм, развальцованных в трубных решетках. Таких трубок в холодильнике 1335, а в отпарной секции-920. Реактиватор по конструкции аналогичен отпарной секции колонны.
Колонна имеет диаметр 1370 мм и общую высоту 26 м. Высота ректификационной секции 1520 мм. Рабочее давление 5,3 атм . Действительная скорость циркуляции адсорбента 8160 кгс/час; температура отпаривания 260°. Производительность установки 2108 нм3/час.
4 Адсорбция в кипящем (псевдоожиженном) слое
За последнее время в ряде отраслей промышленности находит применение адсорбция в кипящем слое, которая по сравнению с адсорбцией в неподвижном слое имеет ряд преимуществ, а именно:
- при сорбции адсорбентом, находящимся в псевдоожиженном состоянии, вследствие интенсивного движения частиц не происходит послойной отработки адсорбента;
- вследствие интенсивного перемешивания частиц адсорбента температура в кипящем слое выравнивается и предотвращается перегрев;
- адсорбент, находящийся в псевдоожиженном состоянии, оказывает относительно очень малое гидравлическое сопротивление;
- адсорбент представляет собой текучую фазу, легко транспортируемую из аппарата в аппарат.
Вместе с этим адсорбция в кипящем слое имеет и свои недостатки:
- в кипящем слое адсорбента отработавшие частицы адсорбента смешаны с неотработавшими. Поток, выходящий из адсорбера, встретив отработавшие частицы адсорбента, может вызвать десорбцию, что отрицательно скажется на степени разделения газовой смеси;
- вследствие интенсивного перемешивания частиц адсорбента в кипящем слое происходит их истирание;
- поэтому к адсорбенту предъявляются особые требования по механической прочности;
- при интенсивном движении частиц адсорбента в кипящем слое усиливается эрозия стенок аппарата.
На рис. 3.4.1 дана схема колонного аппарата для адсорбции в кипящем слое, применяемого при разделении углеводородных газов. Колонна снабжена контактными колпачковыми тарелками, схема устройства которых представлена на рис. 3.4.2. Частицы адсорбента, движущегося по колонне сверху вниз, переходят с тарелки на тарелку по переточным стаканам 1. Газ, который поддерживает частицы адсорбента на тарелке в состоянии псевдоожижения, проходит снизу вверх через патрубки 2 с колпачками 3. Для большей турболизации кипящего слоя установлены вертикальные перегородки 4, а для осуществления теплообмена-пучок трубок 5, в которых в зависимости от условий процесса может протекать охлаждающий или нагревающий агент.
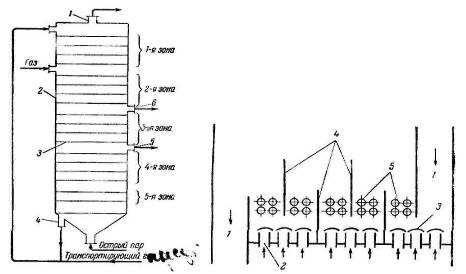
|
Рис. 3.4.1 — Схема колонного аппарата для разделения газов адсорбцией в кипящем слое: 1 — выход непоглощенной части газа; 2 — корпус колонны; 3 — контактная тарелка; 4 — выход регенерированного адсорбента; 5 — выход фракции газа С 3 ; 6 — выход фракции газа C2 |
Рис. 3.4.2 — Схема устройства контактной тарелки колонного адсорбера с кипящим слоем: 1 — переточные стаканы; 2 — патрубки; 3 — колпачок; 4 — перегородки; 5 — теплообменные трубки |
Колонна по высоте делится на пять зон. Газ, подлежащий разделению, поступает по трубе под нижнюю тарелку первой-верхней зоны, в которой протекает процесс адсорбции; свежий адсорбент подается в верхнюю часть этой зоны. В этой зоне из газовой смеси поглощаются углеводороды, содержащие два и три атома углерода, и небольшие количества метана. Непоглощенная часть газовой смеси, содержащей метан, водород, азот и двуокись углерода, удаляется из верха колонны по трубе 1. Так как процесс адсорбции в первой зоне колонны протекает с выделением тепла, тарелки этой зоны снабжены охладительными трубами, по которым протекает холодная вода.
Из первой зоны адсорбент по переточному каналу поступает во вторую, где поднимающийся с низа колонны инертный газ десорбирует из адсорбента метан; метан попадает в первую зону и уходит из колонны вместе с непоглощенной частью газа. Из второй зоны адсорбент поступает в третью, а затем в четвертую и пятую зоны. В третьей зоне происходит десорбция поглощенных газов с двумя углеродными атомами (фракция C 2 ) и в четвертой — с тремя углеродными атомами (фракция С3 ).
В пятой зоне адсорбент обрабатывается острым паром. Водяной пар выдувает из адсорбента углеводороды с тремя углеродными атомами. Адсорбент из пятой зоны выходит по трубе 4 и пневмотранспортом подается снова в верхнюю часть колонны.
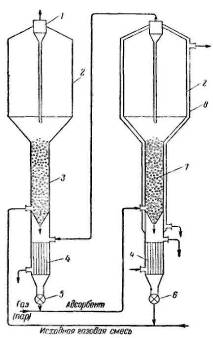
Рис. 3.4.3 — Схема установки для адсорбции и десорбции в кипящем
слое: 1 — циклон; 2 — сепаратор; 3 — адсорбер; 4 — теплообменники;
- , 6 — разгрузочные приспособления;
- 7 — десорбер;
- 8 — паровая
рубашка
На рис. 3.4.3 представлена схема установки для адсорбции и десорбции в кипящем слое, состоящей из адсорбера 3 и десорбера 7. В адсорбер 3 через трубу подаются исходная газовая смесь и регенерированный адсорбент из десорбера. В адсорбере создается кипящий слой адсорбента, в котором происходит адсорбция поглощаемой части газового потока. Непоглощенная часть газового потока через сепаратор 2 и циклон 1 удаляется из аппарата.
Из адсорбера адсорбент через разгрузочное приспособление 5 поступает в трубопровод и газом или паром, используемыми для десорбции, увлекается в десорбер 7, в котором десорбция проводится также в кипящем слое. Десорбер снабжен паровой рубашкой 8. Газ после десорбции проходит через теплообменник, где отдает тепло выходящему из адсорбера адсорбенту. Выходящий из десорбера регенерированный адсорбент охлаждается в теплообменнике 4.
На рис. 3.4.4 представлена схема устройства адсорбера с кипящим слоем.
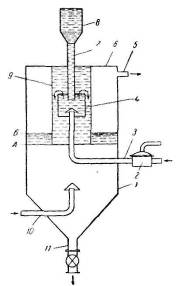
Рис. 3.4.4 — Адсорбер с регулируемой высотой кипящего слоя:
- корпус адсорбера;
- 2 — регулятор давления;
- 3 — трубопровод для
подачи регулировочного газа; 4 — вспомогательный бак; 5 — выход
непоглощенной части газа; 6 — крышка адсорбера; 7 — труба для подачи
адсорбента; 8 — загрузочный бункер; 9 — труба; 10 — труба для подачи
исходного газа; 11 — разгрузочная труба
Адсорбер имеет специальное приспособление для регулирования высоты кипящего слоя. Этот аппарат состоит из корпуса-резервуара 1, в верхней части которого расположен открытый сверху вспомогательный бак 4. Свежий адсорбент загружается через бункер 8 по трубе 7 в вспомогательный бак. Снизу в вспомогательный бак подведена труба 3. по которой через регулятор 2 нагнетается газ, необходимый для псевдоожижения адсорбента в баке 4. Бак 4 установлен в трубе 9, прикрепленной к крышке адсорбера; открытый конец трубы находится в кипящем слое адсорбента (в резервуаре 1).
Псевдоожиженный слой адсорбента из бака 4 по этой трубе переливается в резервуар. Исходная газовая смесь поступает в адсорбер по трубе 10 и создает кипящий слой в резервуаре 1. Скорость газового потока должна быть равна скорости витания ω вит . Освобожденная от поглощаемой части газовая смесь удаляется из адсорбера по трубе 5, а адсорбент, насыщенный поглощаемым газом, осаждается в нижней конической части резервуара и по трубе 11 удаляется из него.
Высота кипящего слоя в резервуаре колеблется в интервале уровней А-В. Подачу газа в бак 4 рассчитывают таким образом, чтобы при достижении уровня А кипящий слой адсорбента переливался через край бака в резервуар в количестве большем, чем уходит по трубе 11. В результате количество адсорбента в резервуаре увеличивается и уровень кипящего слоя в нем повышается. При этом будет возрастать толщина слоя адсорбента, сопротивление которого должен преодолевать газ, подаваемый через трубу 5. Вследствие этого при постоянстве давления этого газа, поддерживаемом регулятором 2, расход его будет соответственно уменьшаться. По достижении кипящим слоем уровня Б расход газа сократится настолько, что подача адсорбента в резервуар прекратится, а это приведет к понижению уровня кипящего слоя в резервуаре. Разность уровней А и Б зависит от чувствительности регулятора и практически может быть доведена до 100 мм и менее.
Опытные данные показывают, что процесс адсорбции в кипящем слое характеризуется теми же закономерностями, что и адсорбция в неподвижном слое. Так, время защитного действия слоя меняется прямо пропорционально высоте кипящего слоя. Коэффициент защитного действия адсорбента зависит от скорости газового потока, начальной концентрации газовой смеси и физико-химических свойств системы.
При адсорбции в кипящем слое можно принимать скорость газового потока в три-четыре раза большей по сравнению со скоростью при адсорбции в неподвижном слое и значительно интенсифицировать процесс адсорбции.
5 Расчет адсорберов периодического действия
В аппаратах периодического действия с неподвижным слоем адсорбента высотой L процесс собственно сорбции протекает в две стадии. Первая стадия считается с момента начала пропускания газовой смеси через слой адсорбента до полного насыщения нижних слоев адсорбента. В течение этой стадии на какой-то высоте слоя адсорбента L 0 , называемой работающей высотой, происходит полный переход распределяемого между фазами вещества из газовой фазы в адсорбент и газовая смесь выходит из адсорбера, будучи полностью освобождена от поглощаемого адсорбентом вещества.
При дальнейшей работе адсорбера адсорбент постепенно насыщается поглощаемым веществом и, наконец, наступает момент, когда адсорбент перестает поглощать распределяемый между фазами компонент и начинается проскок этого компонента через слой адсорбента. Время от начала процесса до момента проскока называют временем защитного действия слоя адсорбента.
Количество поглощенного вещества может быть выражено следующим образом:
G=αfa L
G=wy fa C0 τ’
где L — высота слоя адсорбента в м ;
fa
wy
С0
τ’
Сравнивая два последних уравнения, находим:
τ’=α/wy C0 *L
Фактическое время защитного действия τ слоя адсорбента длиной L всегда меньше τ’ . Разность:
τ0 =τ’- τ
называется потерей времени защитного действия.
τ’
τ= α/wy C0 *L- τ0
τ= K3 L- τ0
K3 = α/wy C0
Уравнение можно выразить и так:
где h — величина, характеризующая неиспользованную статическую активность слоя адсорбента.
Соответственно потеря времени защитного действия слоя получится из равенства
τ0 = K3 h
Процесс адсорбции в неподвижном слое адсорбента является неустановившимся, поэтому определение времени защитного действия слоя адсорбента и изменения концентрации газа по высоте слоя представляет собой весьма сложную задачу.
Связь между концентрацией газовой смеси в любой момент времени и высотой слоя адсорбента выражается уравнением:
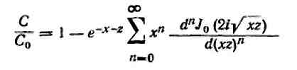 (3.5.9)
(3.5.9)
а между равновесной концентрацией в каждый данный момент времени и высотой слоя адсорбента уравнением
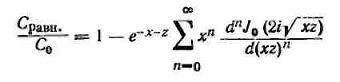 (3.5.10)
(3.5.10)
где С — содержание поглощаемого компонента в газовой фазе в любой момент времени τ на высоте слоя L в кгс/м3 ;
С0
С сравн . — равновесная концентрация газовой фазы в кгс/м3 ;
J0 (2i√xz)
x=Kv L/wy
z=Kv/ A(τ-L/wy )
Kv
L — высота слоя адсорбента в м ;
wy
А — константа из уравнения изотермы. Допуская линейную зависимость между концентрацией газа и поглощенным количеством вещества, числовое значение А можно найти из уравнения α=АС’равн .;
τ — длительность процесса адсорбции в с ек .
i=√-1
C/C0
Продолжительность адсорбции при заданной толщине слоя адсорбента и начальной концентрации газа определяется в зависимости от того, к какому участку кривой изотермы адсорбции относятся заданные концентрации газовой смеси.
Для первой области изотермы адсорбции зависимость между α и Срав — приближенно может быть признана линейной, т. е. можно допустить, что в этой области изотерма приблизительно отвечает закону Генри:
α=ГСрав
где Г — безразмерный коэффициент, равный отношению α0 / α0 :
α0
В этом случае длительность адсорбции определяется из уравнения:
![]() (3.5.15)
(3.5.15)
где 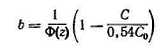 (3.5.16)
(3.5.16)
Ф(z)
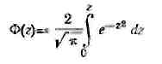 (3.5.17)
(3.5.17)
С —
Числовые значения функции Крампа в зависимости от величины z , находят по таблицам.
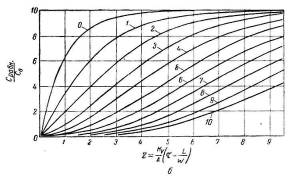
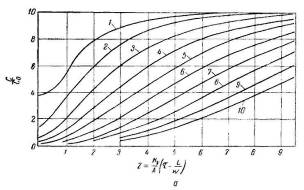
Рис. 3.5.1 — Зависимость отношений С/С 0 и Сравн /С0 от значений х и z (на
кривых указанна величина х )
Во в торой области изотермы адсорбции зависимость между α и Сравн — выражается кривой, выпуклой по отношению к оси абсцисс. В этом случае приближенно длительность адсорбции определяется по уравнению
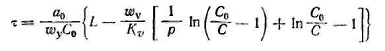 (3.5.18)
(3.5.18)
Здесь ![]() (3.5.19)
(3.5.19)
α∞
В третьей области изотермы адсорбции величина поглощаемого адсорбентом вещества достигает предела и остается постоянной и не зависящей от содержания поглощаемого вещества в газовой фазе. В этом случае длительность адсорбции определяется по уравнению
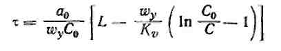 (3.5.20)
(3.5.20)
3.6 Расчет адсорберов непрерывного действия
Процесс адсорбции в аппаратах непрерывного действия является установившимся и к нему применимы общие уравнения массопередачи.
Если концентрации поглощаемого вещества находятся в пределах линейного участка кривой изотермы адсорбции, то можно воспользоваться уравнением массопередачи, которое для данного случая выражается так
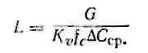 (3.6.1)
(3.6.1)
где G — количество поглощаемого адсорбентом вещества в кгс/сек;
Kv
fc
∆Сср
Эта величина определяется из выражения:
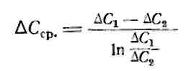 (3.6.2)
(3.6.2)
∆С
∆С
Если концентрация поглощаемого вещества находится в пределах криволинейного участка изотермы адсорбции, высота слоя адсорбции может быть найдена по уравнениям, которые для данного случая могут быть выражены так:
L=hm м
h=V2 /Kv fc —
V2
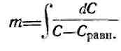 (3.6.4)
(3.6.4)
m — число единиц переноса, которое находят графическим путем.
Заключение
Адсорбционные явления чрезвычайно широко распространены в живой и неживой природе. Толщи горных пород и почвы являются огромными колоннами с адсорбентами, по которым перемещаются водные и газовые растворы. Легочная ткань подобна адсорбенту — носителю, на котором удерживается гемоглобин крови, обеспечивающий перенос кислорода в организм. Многие функции биологических мембран живой клетки связаны со свойствами их поверхности, так, например, общая площадь биологических мембран в организме человека достигает десятков тысяч квадратных метров. Даже такие наши чувства, как обоняние и вкус, зависят от адсорбции молекул соответствующих веществ в носовой полости и на языке.
Сегодня адсорбция составляет основу многих промышленных операций и научных исследований. Наиболее важные из них — очистка, выделение и разделение различных веществ, адсорбционная газовая и жидкостная хроматография.
Адсорбция является важной стадией гетерогенного катализа и коррозии. Исследования поверхности тесно связаны с развитием полупроводниковой техники, медицины, строительства и военного дела. Адсорбционные процессы играют ключевую роль при выборе стратегии защиты окружающей среды.
Адсорбционные методы исследования свойств поверхности позволяют количественно охарактеризовать происходящие при адсорбции межмолекулярные взаимодействия адсорбат-адсорбент и адсорбат-адсорбат, определить термодинамические характеристики адсорбционного равновесия (например, теплоту и энтропию адсорбции), а также исследовать геометрические параметры адсорбента (величину удельной поверхности, объем пор и распределение пор по размерам, характерные для данного материала).
Такие исследования необходимы для понимания факторов, управляющих адсорбционными процессами и обеспечивающих возможность выбора и разработки эффективных адсорбентов с необходимыми для решения конкретных задач свойствами.
Список использованной литературы
[Электронный ресурс]//URL: https://drprom.ru/kursovaya/adsorbtsiya-na-granitse-rastvor-gaz/
— Процессы и аппараты химической технологии: Учебник для вузов./ Дытнерский Ю.И. — Изд. 2-е. В 2-х кН. Часть 2. Массообменные процессы и аппараты. — М.: Химия, 1995.
— Киселев А.В. Межмолекулярные взаимодействия в адсорбции и хроматографии. — М.: Высш. шк., 1986.
— Грег С., Синг К. Адсорбция, удельная поверхность, пористость. — М.: Мир, 1984.
— Российский химический журнал. — 1995. — Т. 39 — №6.
