В зависимости от характера ковалентных связей при замещении в бензольном кольце возможны три типа реакций: гомолитическое, электрофильное и нуклеофильное замещение. При гомолитическом разрыве ковалентной связи образуются частицы, обладающие неспаренным электроном, — радикалы, например:
![]()
Радикальные реакции протекают в растворе, особенно, если эти реакции проводятся в неполярных растворителях и если они катализируются светом или веществами, способными разлагаться с образованием радикалов, например органическими пероксидами.
Радикалы, образовавшиеся в растворе, обычно менее избирательны при атаке других частиц или альтернативных положений в одной и той же частице, по сравнению с карбокатионами или карбанионами.
Радикальные реакции часто протекают с большой скоростью вследствие развития цепных процессов с низким расходом энергии.
Реакции замещения по радикальному типу изображаются следующими общими схемами:
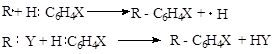
или
Кинетическое описание данной реакции:
![]()
При гомолитическом замещении бензольное кольцо атакуется нейтральным радикалом, существующем как кинетически независимая частица, либо возникающем только в переходном состоянии, в момент реакции. Место вступления радикала, атакующего молекулу монозамещенного бензола, должно зависеть от чередующейся полярности, наведенной имеющимся заместителем. Однако радикалы замещают преимущественно водородные атомы в орто- и пара- положениях к имещемуся заместителю, будь то ориентант I или II рода. Для разъяснения этого вопроса необходимо сравнить переходные состояния, возникающие при атаке радикалом орто- и пара- положений, с одной стороны, и мета- положением с другой.
Рассмотрим вначале замещение в молекуле, содержащей ориентант II рода, например нитрогруппу. При атаке пара- положения возникает переходное состояние (I), а при атаке мета- положения – переходное состояние (II):
Классификация реакций алкилирования
... способны к алкилированию. Этим реакция алкилирования значительно отличается от других процессов замещения в ароматическое ядро, например от хлорирования исульфирования. Правила ориентации при алкилировании в общем ... с внутримолекулярной миграциейалкильных групп, в результате которой среди диалкилбензолов преобладает мета-изомер, среди триалкилбензолов 1,3,5-изомер и т.д. Способность алкильных групп ...
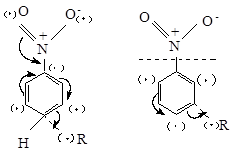
(I) атака в пара- (II) атака в мета-
положение положение
Реакция будет идти преимущественно через то переходное состояние, энергия которого меньше. Структурные особенности переходного состояния (I), возникающего при атаке радикалом пара- (или орто-) положения таковы, что в рассредоточении облака неспаренного электрона участвуют не только три углеродных атома бензольного кольца, но и два кислородных атома нитрогруппы. Возможностей рассредоточения облака неспаренного электрона в переходном состоянии (II) меньше, так как здесь нитрогруппа не может участвовать в этом процессе. Следовательно, энергия переходного состояния (II) выше, чем энергия переходного состояния (I) и радикальное замещение должно преимущественно идти в пара- (или орто-) положение.
Аналогичные отношения создаются при реакциях радикального замещения в тех случаях, когда производные бензола содержат ориентанты I рода, например NH 2 – или СН3 – группы. В этом случае соответствующие переходные состояния можно изобразить следующим образом:
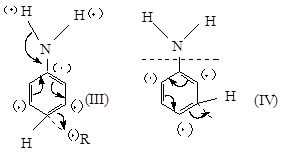
n – замещение м – замещение
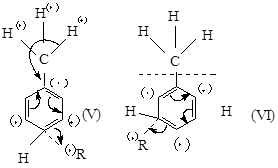
n – замещение м — замещение
Так как заместители NH 2 и CH3 в переходных состояниях IV и VI не участвуют в рассредоточении облака неспаренного электрона, энергия переходных состояний IV и VI выше энергии переходных состояний III и V соответственно. Это и является причиной преимущественного протекания радикальных реакций в пара- и (орто-) положения. Радикальное замещение в бензольном кольце облегчается как заместителями I рода, так и заместителями II рода.
При автокаталитической конденсации (под влиянием соленой кислоты) свободных триарилметильных радикалов по Чичибабину происходит образование n-бензгидрилтетрафенилметана, т.е. происходит радикальное замещение в пара-положение:
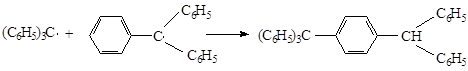
Арилирование производных бензола арилдиазогидратами (реакция Гамбера) приводит к образованию о- и n- замещенных, независимо от природы имевшегося заместителя:
![]()
При разложении фенилдиазоацетата в среде замещенных бензола во всех случаях образуется n- замещенные природные дифенилы:
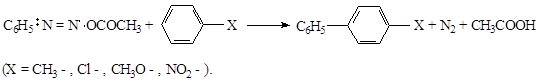
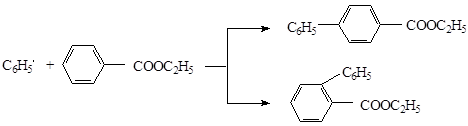
Фенильные радикалы, образующиеся при обработке иодбензола медным порошком в среде этилбензоата, реагируют с последним, давая эфиры дифенил – 2 и дифенил – 4 – карбоновых кислот:
Производство циклогексана из бензола
... того, он используется для удаления краски. 1.АНАЛИТИЧЕСКИЙ ОБЗОР 1.1 Обзор катализаторов Циклогексан получают гидрированием бензола. Это сложный каталитический процесс. Еще в начале нашего века Сабатье ... контакты на носителях. Способность никель-хромового катализатора поглощать серу позволяет использовать его для тонкой очистки сырья в условиях, когда гидрирование бензола протекает в небольшой ...
При распаде перекиси бензола в среде замещенных бензола констатировано образование орто- и пара- замещенных дифенила.
Для реакций этого типа предложен следующий вероятный механизм:
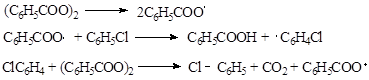
Свободно радикальное замещение при ароматическом атоме углерода редко происходит по механизму, в котором отрыв водорода сопровождается образованием арильного радикала. В этом случае необходимо знать, какое положение кольца будет атаковано, чтобы образовался интермедиат вида:
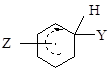
Эту информацию можно получить путем проведения реакции с различными группами Z и анализа процентного содержания орто-, мета- и пара- изомеров в продукте. Для свободно радикальных реакций замещения точность этого метода очень низка из-за множества побочных реакций. Например, орто- положение может быть более реакционно-способным, чем пара- положение, но при этом интермедиат, образующийся при атаке пара- положения, переходит в продукт, а интермедиат, образующийся при атаке орто- положения, вступает в побочную реакцию. Тогда анализ относительно содержания трех продуктов не дает истинного представления о том, какое положение более восприимчиво к атаке.
Тем не менее можно сделать некоторые обобщения:
1. Все заместители повышают реакционную способность в орто- и пара- положениях по сравнению с незамещенным бензолом, причем независимо от того, являются ли они электронодонорами или электроноакцепторными группами.
2. реакционная способность в мета- положении обычно близка к реакционной способности незамещенного бензола и может лишь незначительно отклонятся в ту или другую сторону. Это означает, что все заместители являются дезактивирующими или мета- направляющими.
3. реакционная способность в орто- положениях обычно несколько выше, чем в пара- положениях, за исключением случаев, когда объемные группы понижают реакционную способность орто- положения по стерическим причинам.
Некоторые радикалы оказываются более селективными, чем другие. Так, атом брома настолько селективен, что если в субстрате имеются только первичные атомы углерода, как в неопентане, то реакция протекает очень медленно или вообще не идет; в то же время изобутан можно селективно бромировать до трет-бутил-бромида с высоким выходом. Однако толуол реагирует с атомом брома почти мгновенно. Бромирование других алкилбензолов, например этилбензола кумола, происходит исключительно по a — положению, что указывает на селективность ![]() .
.
Некоторые свободные радикалы, например, трифенилметильный радикал, обладает столь низкой реакционной способностью, что практически не могут оторвать водород от субстрата. Реакционную способность радикалов можно представить следующим образом:
![]()
Соединения, изолируемые перегонкой с водяным паром: кетоны — ацетон
... сильной минеральной кислоты (например серная кислота) ацетон алкилирует фенол с образованием дифенилолпропана (бисфенола ацетона) (НОС 6 Н4 )2 С(СН3)2 , присоединяет цианид- ион с образованием ацетонциангидрина ... вещества, которые используются в быту, к которым и относится ацетон. Вдыхание паров ацетона используется токсикоманами для достижения эйфории, поэтому часто пострадавшими являются ...
Некоторые свободные радикалы проявляют электрофильные свойства (например Сl . ), а другие нуклеофильные (например, трет-бутильный радикал).
Эти свойства относительно слабо выражены по сравнению с электрофильностью положительно заряженного иона или нуклеофильностью отрицательно заряженного иона. Свободные радикалы преимущественно обладают нейтральным характером независимо от того, проявляют ли они склонность к электрофильному или к нуклеофильному поведению.
Растворитель обычно оказывает незначительное влияние на свободнорадикальные реакции замещения в отличии от ионных реакций. Очень часто реакции в растворах по своему характеру очень сходны с теми же реакциями в газовой фазе, где растворитель вообще отсутствует. Однако в некоторых случаях растворитель может вызвать ощутимые различия. Это объясняется образованием комплекса между ароматическим растворителем и радикалом:
![]()
Что делает радикал менее реакционноспособным и более селективным. Эффект такого типа не наблюдается в тех случаях, когда разница в способности отрывать уходящую группувызвана. В этих случаях ароматические растворители не вызывают заметных изменений.
Комплекс
![]()
Представляет собой короткоживущую частицу, которую удалось обнаружить с помощью видимого спектра при импульсном радиолизе.
Некоторые аномальные результаты получаются при хлорировании боковых цепей ароматических соединений, это можно объяснить образованием комплексов, но не с растворителем, а с реагирующей частицей.
Возможно, что наиболее полезным применением реакций ароматического замещения, протекающих по радикальному механизму, является синтез бифенилов:
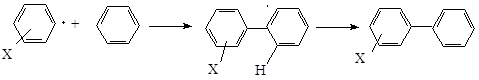
Арильный радикал генерируется в присутствии избытка второго ароматического соединения, которое подвергается замещению. Можно использовать любой из нескольких способов получения арильных радикалов. Наиболее общим является разложение диазониевого иона, но возможно также и термическое разложение N – нитрозоацетаинилидов или ароилпероксидов:
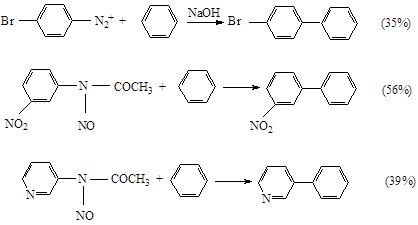
Ориентирующие влияния заместителей в реакциях радикального замещения невелики. При радикальном замещении заместители слабо влияют на стабильность переходных состояний. В результате гомолитическое ароматическое замещение обычно приводит к смеси всех возможных продуктов замещения в сравнимых количествах:
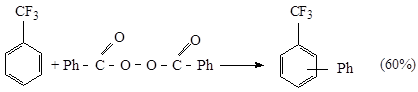
Арильные радикалы можно использовать для введения алькильных заместителей в ароматическое ядро. Арильный радикал генерируется при разложении арилдиазониевого иона, катализируемого медью, и затем атакует алкен. Образующийся радикал окисляется Cu (II) с образованием карбениевого иона, который превращается в алкен или галогенид:
По химии «Инертные газы»
... атома восемь электронов, образующих очень устойчивую систему. Также устойчива и электронная оболочка гелия, состоящая из двух электронов. Поэтому атомы благородных газов характеризуются ... реакция. XeF Чистый ХеF Дифторид ХеF Растворимость дифторида в воде невелика. Его раствор — сильнейший окислитель. Постепенно он саморазлагается на ксенон, кислород и фтороводород. В щелочной среде разложение ...
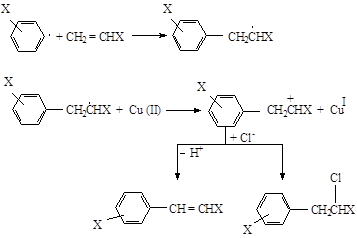
Эту реакцию называют реакцией арилирования по Мирвейну.
Арилирование алкенов:
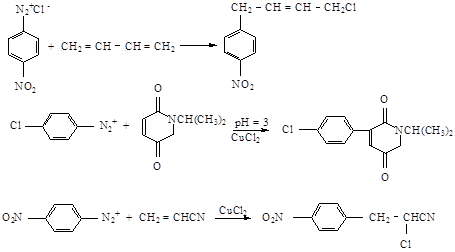
Гомолитическое ароматическое замещение может также происходить как реакция с переносом электрона, даже в отсутствие катализаторов переходных металлов. Например, облучение раствора еномета ацетона в жидком аммиаке с любым гамогенбензолом приводит к фенилацетону.
Предложенный механизм включает перенос электрона, разложение образовавшегося ароматического радикал – аниона и комбинацию фенильного радикала с енометом:
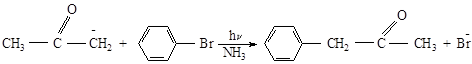
Реакция имеет цепной характер, так как радикал-анион фенилацетона может переносить электрон к бромбензолу:
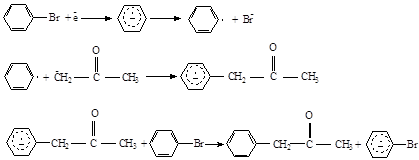
Аналогичная реакция происходит при использовании
a-цианокарбанионов, но выходы продукта алкилирования сильно уменьшаются вследствие образования побочных продуктов в результате выброса цианид — иона из радикал – аниона:
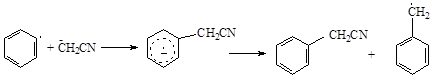
Существует ряд путей образования радикалов из нейтральных молекул. Наиболее важными из них являются: фотолиз, термолиз и окислительно-восстановительные реакции с переносом одного электрона при участии неорганических ионов, металлов или в ходе электролиза.
Генерирование радикалов при окислительно-восстановительных реакциях происходит путем одноэлектронного переноса; в них могут принимать участие такие ионы, как Fe 2+ и Fe 3+ , а также Cu + и Cu 2+ . Найдено, что ионы Cu + сильно ускоряют разложение арилпероксидов, например:
![]()
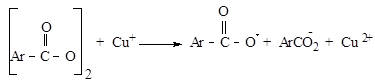
Эту реакцию можно использовать для генерирования радикалов так как при термолизе арилпероксидов возможно разложение радикала до ![]()
Ионы Cu + участвуют также в разложении солей диазония ArN2 + Cl — до ArCl + N2 (реакция Зандмейера), при котором весьма вероятно образование ![]() в качестве промежуточного соединения:
в качестве промежуточного соединения:
По химии «Электрохимический ряд напряжений металлов»
... металлов вытеснять другие из растворов их солей. Самый известный пример такой реакции - вытеснение из раствора ионов меди железом (восстановление меди ... концентрация восстановленной формы; n - число обмененных электронов. Например, для восстановительно-окислительного потенциала пары Fe ... значит, и окислительные свойства иона перманганата зависят ... Энциклопедия для детей. Том 17. Химия. / гл. ред. В.А. ...
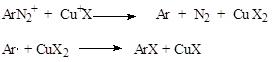
Первая стадия заключается в восстановлении иона диазония ионом меди (I), в результате чего образуется арильный радикал. Во второй стадии этот радикал отрывает галоген от хлорида меди (II), восстанавливая его до CuX.
Галогенид меди (I) регенерируется и по существу служит катализатором. Также CuX (I) является переносчиком электрона, так как медь имеет свободную орбиталь.
Механизм реакции Зандмейера, протекающий по радикальному типу с переносом электрона, можно представить следующим образом:
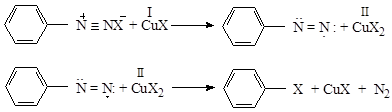
Кинетически реакция Зандмейера описываются следующим образом:
![]()
Реакция Зандмейера широко применяется для получения различных ароматических хлоридов и бромидов и по всей вероятности является лучшим введения хлора или брома в ароматическое кольцо, однако она не непригодна для получения фторидов и иодидов.
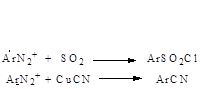
Под действием солей меди (I) диазонивая группа может быть замещена на нитро-, циано-, серосодержащие группы:
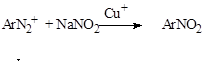
При наличии в субстрате электроноакцепторных групп катализатор не требуется.
1. Кери «Углубленный курс органической химии», М., «Химия», 1981г.
2. Нейланд «Органическая химия». 425 – 427.
3. Несмеянов А.Н. «Химия», 1974г. 98-99.
4. О.А. Реутов «Теоретические основы органической химии», М., 1964г., 327-333.
5. П. Сайкс «Механизмы реакций в органической химии», М., «Химия», 470 – 472, 242, 1991г.
6. Дж. Марч « Органическая химия», М., 1980., стр. 39-45, 62-70.
