В настоящее время под металлургией понимают ту область науки и промышленности, которая занимается получением металлов (иногда сплавов) из руд и других материалов и очисткой (рафинированием) чернового металла или сплава.
Важной задачей современности является рациональное использование и извлечение металлов из руд на основе применения безотходных технологических процессов.
Комплексное использование руд и концентратов — важнейшее условие дальнейшего развития металлургии. Оно обеспечивает высокие темпы и уровень развития народного хозяйства.
Комплексное рациональное использование сырья — это эффективная его переработка с извлечением всех ценных составляющих, полнота которого определяется современным уровнем развития науки и техники, с применением процессов, не создающих выбросов вредных веществ в окружающую среду и не нарушающих сложившийся кругооборот веществ в природе.
На международной конференции ЮНЕСКО признано, что комплексное использование сырья- научно-обоснованная стратегия освоения и охраны недр во всем мире.
Будущее металлургии — это превращение элементов. Это целая отрасль промышленности — радиационная металлургия, которая будет заниматься изготовлением редких химических элементов из более распространенных (И.П. Бардин).
Первым ученым металлургом был Агрикола (1494-1555 гг., изучавший металлургию на европейских заводах. В 1556 году вышла написанная им первая книга по металлургии и горному делу «Де Re Mtttalica», но научный уровень изложения в ней вопросов металлургии был очень низкий.
Открытие великим русским ученым М.В. Ломоносовым (1711-1765 гг.) закона сохранения массы веществ при химических реакциях (1748 г.) позволило на основе этого закона дать изложение способов извлечения металлов из руд на более высоком научном уровне.
М.В. Ломоносов стал основателем научной металлургии и автором первой на русском языке книги по металлургии. Его «Первые основания металлургии или рудных дел» (1763 г.) — выдающийся труд в истории металлургии и химии. Огромное значение в развитии теоретической металлургии имело открытие акад. Г.И. Гессом (1802-1850) закона постоянства сумм тепла реакций.
В 1834 г. М. Фарадей (1791-1867 гг.) открыл законы электролиза, являющиеся основой процессов электролитического получения и рафинирования металлов.
Большим достижением мировой науки было создание Д.И. Менделеевым (1834-1907 гг.) в 1869 году периодической системы элементов.
Национальная система стандартизации и ее влияние на развитие ...
... в процессе создания стандарта всех заинтересованных сторон. Национальная система стандартизации представляет собой национальные стандарты и общероссийские классификаторы технико-экономической и социальной информации, а также правила их создания и использования. Актуальность ...
Основы теории металлургических процессов в металлургии были разработаны акад. Н.Н. Бекетовым (1826-1911гг.).
Дальнейшее развитие теоретические основы металлургии получили в трудах таких ученых, как Д.К. Чернов, Н.С. Курнаков, М.А. Павлов, Н.Н. Карнаухов, А.А. Байков, П.П. Федотьев, Г.Г. Уразов, В.Я. Мостович, В.А. Ванюков и многие другие.
«Металлом называется светлое тело, которое ковать можно» (Ломоносов М.В., 1763 г.).
Промышленная классификация металлов
Все металлы делятся на две группы: черные и цветные.
1.Черные металлы. К ним относятся железо (и его сплавы), а также марганец, ванадий и хром, так как их производство тесно связано с выплавлением железа и его сплавов.
2.Цветные металлы. Они подразделяются на следующие группы:
1) тяжелые цветные металлы, которые делятся на основные — медь, никель, свинец, цинк, олово, играющие ведущую роль в народном хозяйстве и младшие — кадмий, кобальт, мышьяк, сурьма, висмут, ртуть, которые производятся в значительно меньших количествах по сравнению с основными металлами;
2) легкие цветные металлы также подразделяются на основные — алюминий, магний, титан, натрий и реже применяемые — бериллий, литий, барий, кальций, стронций, калий;
3) благородные металлы — золото, серебро, платина и металлы платиновой группы- осмий, иридий, родий, рутений, палладий;
4) редкие металлы — подразделяются на ряд групп:
- a) тугоплавкие — вольфрам, молибден, тантал, ниобий, цирконий, ванадий;
- б) рассеянные — таллий, галлий, германий, индий, рений, гафний, рубидий, цезий и другие;
- в) редкоземельные — лантан и лантаноиды;
- г) радиоактивные — полоний, радий, уран, торий, актиний, плутоний, нептуний и остальные трансурановые металлы.
Важнейшим промышленным металлом является железо, которое в чистом виде и сплавах с углеродом и другими элементами относится к группе черных металлов. Сплавами этой группы является сталь, чугун и ферросплавы. Из общей массы выплавляемых во всем мире металлов около 94% приходится на черные. Они представляют главный конструкционный материал в машино- и приборостроении и один из главных в строительной индустрии, транспорте и связи.
Все остальные металлы и их сплавы относятся к группе цветных металлов: их принято делить на легкие (плотность до 3 г/см 3 ) и тяжелые. Выделяют также благородные и редкие металлы.
Из цветных металлов важное промышленное значение имеют алюминий, медь, магний, свинец, цинк, олово, титан.
Но стоимость цветных металлов по сравнению с черными высока, поэтому во всех случаях, когда это допустимо, их стараются заменить черными металлами или неметаллическими материалами. Кроме перечисленных промышленное применение имеют также хром, никель, марганец, молибден, кобальт, ванадий, вольфрам, цирконий, тантал, ниобий, рений, индий, серебро, платина, золото, германий, селен, теллур.
Некоторые металлы находят широкое применение в технически чистом виде (с малым содержанием примесей), например, железо, медь и алюминий в электро- и радиотехнике. Другие металлы, например, тантал, ниобий, гафний, цирконий, кремний используют в сверхчистом виде, т.е. миллионными долями процента всех примесей или даже на уровне отдельных атомов примесей, в приборостроении, атомной технике, вычислительной технике.
Карбонилы и хлориды металлов VIII В группы, их свойства и применение
... Сиджвик и Бейли выдвинули свое объяснение строения одно- и двухъядерных карбонилов металлов. Они предположили, что группа СО является донором электронов, занимает одно координационное место и присоединяется через ...
Несравненно шире и разнообразнее применение металлических сплавов, которых насчитывается десятки тысяч марок.
Металлы получают из руд
Руда — природно-минеральное сырье, содержащее металлы или их соединения в количестве и в виде, пригодном для промышленного использования. Руда представляет собой совокупность минералов.
Классификация руд
Основное сырье для получения металлов — руда.
По химическому составу руды делятся на:
1) самородные, в которых металлы присутствуют в свободном состояние (золото, серебро, медь, платина);
2) окисленные, в которых металлы находятся в виде кислородных соединений, карбонатов или гидратов (Fe 2 O3 , PbCO3 , Al(OH)3 );
3) сульфидные (PbS, Cu 2 S, NiS), в которых металлы находятся в виде сернистых соединений.
По структуре руда неоднородна и состоит из следующих минералов:
1) рудные минералы первого основного металла;
2) рудные минералы других основных металлов (полиметаллические руды): например свинцово-цинковые или медно-никелевые руды;
3) минералы — спутники основных рудных минералов (золото, серебро, редкие и рассеянные металлы), находящиеся отдельно или в твердых растворах с основными металлами. Например постоянный спутник никеля — кобальт, иногда платина и металлы платиновой группы: спутники свинца и цинка — кадмий, индий, таллий и другие редкие металлы;
4) основная масса руды — пустая порода (не содержащая металлов), состоящая из кварца, силикатов, алюмосиликатов и других сложных минералов.
При переработке руды необходимо полное комплексное использование ее ценных составляющих.
На многих металлургических заводах извлекают по 10-15 металлов не только основных, но и металлов — спутников. А также других ценных компонентов (сера, фосфор и др.).
В соответствии с подразделением металлов и исходных руд различают металлургию черных и цветных металлов.
Классификация металлургических процессов
В зависимости от вида энергии, используемой при основных процессах различают пирометаллургию, гидрометаллургию и электротермический метод.
В пирометаллургии металлы и сплавы получают и рафинируют при сжигании топлива, экзотермических реакциях электроплавке, электролизе расплавов, дистилляции (восстановление металлов в газообразном состоянии с последующей конденсацией), термической диссоциации из летучих соединений, металлотермии. Наиболее распространенной в пирометаллургии является плавка, основанная на сжигании топлива в печах. Исходный материал для плавки называют шихтой. В состав шихты входят топливо, руды, металлы в виде лома, флюсы, шлаки предыдущей плавки.
В гидрометаллургии металлы получают из руд путем выщелачивания и выделения из растворов без нагрева до высокой температуры.
Электротермический метод — получение металлов путем электролиза расплавов солей (оксидов) и растворов
Топливо: каменный уголь, кокс, мазут, природный газ.
Огнеупорные материалы — материалы, применяемые для футеровки печей.
Требования к огнеупорам — высокая температура размягчения, химическая стойкость. Огнеупорные материалы изготовляют из минерального сырья и применяют в виде кирпичей. Их применяют для кладки стен, пода и свода печей, а также для генераторов, дымовых труб, конвейеров, ковшей и т.п.
Автоматизация процесса нагрева металла в печах сопротивления
... 79 шар Ш2,5мм. Рисунок 1.1-Вал 1.4 Основные недостатки техпроцесса нагрева металла в печах 1. Время нагрева стальных заготовок в нагревательных печах до заданной температуры (или скорости нагрева) зависит, ... труд, особенно в тяжелых и вредных условиях для человека. Постоянное расширение сферы автоматизации является одной из главных особенностей промышленности на данный этап. Особое внимание уделяется ...
По химическим свойствам огнеупоры делятся на: кислые, основные и нейтральные.
Кислые — состоят преимущественно из кремнезема SiO 2 ; они вступают в химическое взаимодействие с основными огнеупорами и шлаками, но стойки к кислым шлакам.
Основные — состоят преимущественно из основных оксидов (MgO и CaO).
Нейтральные — почти не взаимодействуют ни с основными ни с кислыми огнеупорами и шлаками (хромитовые и углеродистые огнеупоры).
Кислые огнеупоры
Динас (динасовый кирпич) содержит 93-96% SiO 2 ; 2-3% CaO (t размягчения 1690-1730о С).
Кварцевый песок (93-97% SiO2 ) применяют для наварки и ремонта отдельных частей металлургических печей.
Основные огнеупоры
Магнезит (магнезитовый кирпич и металлургический магнезитовый порошок) состоит на 91-94% из MgO, 1-2% CaO, 2-3% Fe 2 O3 , около 2% SiO2 , около 1% Al2 O3 . Огнеупорность магнезита выше 2000о С, но под нагрузкой размягчается при 1500о С. Магнезит применяют для футеровки подов и стен основных мартеновских, двухванных и электрических сталеплавильных печей, а также печей цветной металлургии.
Хромомагнезит и магнезитохром содержат 30-70 % MgO и 10-30 % Cr 2 O3 . Свойства примерно как у магнезита.
Доломит CaCO 3 и MgCO3 . Обжигают при разогреве печи. Кирпичи делают с использованием каменноугольной смолы 7-9 %. Смолодоломит применяют для футеровки конвертеров. Огнеупорность t= 1800-1900о С.
Глиноземистые огнеупоры: шамотные (менее 65% SiO 2 и 30-45% Al2 O3 );высокоглиноземистые (более 45% Al2 O3 ).
Шамотные кирпичи — самые распространенные огнеупоры (t размягчения 1770о С), устойчивы против кислых и основных шлаков при t=1250-1350o C, они дешевы. Недостаток — низкая t размягчения под нагрузкой (t= 1250-1400o C).
Шамотными кирпичами выкладывают шахты доменных печей, нагревательные печи, газогенераторы, вагранки, разливочные ковши.
Высокоглиноземистые огнеупоры дороже шамотных, но огнеупорность их выше (до 2000 о С).
Их применяют для кладки высокотемпературных частей металлургических печей.
Глиноземистые огнеупоры обладают слабокислыми и слабоосновными свойствами (их не относят к группам).
Нейтральные огнеупоры
К нейтральным огнеупорам относятся хромитовые и углеродистые огнеупоры.
Хромитовые огнеупоры содержат не менее 25% Cr 2 O3 и имеют огнеупорность около 1800о С. применяют их для разделения слоев кислых и основных огнеупоров с целью предотвращения взаимодействия между ними.
Углеродистые огнеупоры содержат до 90% углерода и делятся на графитовые и угольные. Из графитовых изготавливают тигли для плавки различных металлов, а из угольных — отдельные части металлургических печей (t=2000 о С).
В сталеплавильных печах нельзя применять так как науглероживают сталь.
Металлургия цветных металлов
... и др.). Следует отметить, что чем выше в исходной меди содержание благородных металлов, тем ниже будет себестоимость электролитной меди. Именно поэтому при конвертировании медных штейнов ... На сегодняшний день существует несколько основных процессов автогенных плавок : процесс «Норанда», «Уоркра», «Мицубиси» и Ванюкова. К сожалению, разработка новый конструкций печей ...
Шлаки — образуются при выплавке металлов и имеют небольшую плотность (2-4 г/см 3 ), всплывают над жидким металлом, изолируя его от непосредственного влияния печных газов. Они образуются из сплавленной пустой породы, флюсов, золы топлива и огнеупорной футеровки по мере ее разрушения, из поглощенных газов и выделяющихся из металла соединений. Состав шлаков, t плавления, текучесть, химическая активность во многом определяют успех плавки и выход металла заданного состава. Шлаки основные с преобладание основных оксидов и кислые с преобладанием кислотных оксидов.
Пирометаллургические процессы
Эти процессы в большинстве случаев протекают при высоких температурах и часто с расплавлением материалов. Пирометаллургические процессы по температуре и по характеру принимающих участие фаз разделяются на две группы: обжиг и металлургическая плавка.
Обжиг
Обжиг — это такой металлургический процесс, который ведут при высокой температуре, но чаще даже без частичного расплавления фаз. Все процессы при обжиге проходят между твердыми и газообразными фазами, при температуре 500-1000-1200 о С. Процессы обжига делятся на следующие:
1. Кальцинирующий обжиг (прокалка).
Цель его — изменить химический состав тех рудных минералов, которые находятся в сырье. Здесь протекают в основном реакции диссоциации. Такому обжигу подвергают карбонаты
CaCO 3 ![]() CaO + CO2
CaO + CO2
Или гидроксидов
Al(OH) 3 ![]() Al2 O3 + 3H2 Oпар
Al2 O3 + 3H2 Oпар
Окислительный обжиг сульфидных руд и концентратов. Цель — перевод сульфидов металлов в оксиды
ZnS +1,5 O 2 ![]() ZnO + SO2
ZnO + SO2
(сульфатизирующий обжиг)
ZnS + 2O 2 ![]() ZnSO4
ZnSO4
1. Обжиг с агломерацией — процесс, при котором порошкообразный материал превращается в кусковый. Этот процесс осуществляется за счет рекристаллизации материала без образования жидкой фазы или за счет образования некоторого количества жидкой фазы, которая при застывании связывает (склеивает) частицы порошка в кусковый продукт
2PbS + 3O 2 + SiO2 ![]() PbO + PbO∙SiO2 + 2SO2
PbO + PbO∙SiO2 + 2SO2
легкоплавкие
Этот процесс применяется перед плавкой руды в шахтной печи.
1. Восстановительный обжиг делится на магнетизирующий и восстановительный
a) магнетизирующий обжиг железных руд:
3Fe 2 O3 + CO ![]() 2Fe3 O4 +CO2
2Fe3 O4 +CO2
Этот вид обжига может применятся перед обогащением железных руд с целью перевода слабо магнитных соединений в сильно магнитные (Fe 3 O4 ).
a) восстановительный обжиг, например UO 3 и U3 O8 в UO2
Цветные металлы в строительстве
... Расход сырья, топлива и электроэнергии на производство 1т металлов. Число сопутствующих веществ в руде Расход руды, т Металл Расход топлива и электроэнергии Цветные Тяжелые 4 более 300 олово 1т 11 ... сырья. Главным образом это -- автогенные процессы, совмещающие в себе обжиг, плавку и конвертирование. В этих процессах большая часть серы переходит в отходящие газы с достаточно высоким и постоянным ...
UO 3 + H2 ![]() UO2 + H2 O
UO2 + H2 O
1. Хлорирующий обжиг или хлорирование. Цель его — превратить оксиды или сульфиды металлов в хлориды.
ZrO 2 + 2Cl2 + C ![]() ZrCl4( газ ) + CO (CO2 )
ZrCl4( газ ) + CO (CO2 )
1. Фторирующий обжиг или фторирование. Цель его — превратить оксиды в фториды.
UO 2 + 4HF ![]() UF4 + 2H2 O
UF4 + 2H2 O
Металлургические плавки
В этих процессах жидкие фазы играют основную роль, но это не только расплавление, а сложный процесс, сопровождающийся многочисленными химическими превращениями. В этих процессах в общем случае исходные твердые вещества реагируют между собой и с газообразной фазой, давая сумму жидких фаз и измененную газообразную фазу. Образовавшиеся жидкие фазы обладают малой взаимной растворимостью и поэтому разделяются. Металлургические плавки делятся на рудные и рафинировочные.
Рудные плавки — это те, в которых обработке подвергается руда или концентрат. По характеру химически протекающих реакций они разделяются на
1) Восстановительная плавка — (например доменный процесс)
2)
Fe 2 O3 + SiO2 + C + CaCО3 →Fe(ж) + CaO∙SiO2(ж) + CO(газ) +CO2(газ)
руда кокс флюсы шлак
Чугун и шлак — две жидкости плохо растворяющиеся одна в другой, разделяются по плотности (вверх шлак вниз чугун).
С помощью восстановительной плавки получают свинец, олово.
3) Окислительная концентрационная плавка. Цель ее — не получение металлов в свободном виде, а перевод его в обогащенный продукт — штейн (сплав сульфидов).
Плавка медных или никелевых руд на штейн.
CuS + FeS 2 + O2 + SiO2 → Cu2 S·FeS + FeO·SiO2 + SO2( газ )
штейн шлак
Плавка ведется в присутствии воздуха. В результате медный штейн (сплав FeS и Cu 2 S) с более высоким содержанием меди, чем исходная руда, железистый шлак и газ. Штейн и шлак нерастворимы один в другом и разделяются по плотности. При плавке руды, содержащей 2-5% Сu (концентрационный и одновременно окислительный).
4) Электролиз расплавленных солей (электролитическая плавка).
В результате этого процесса получается металл в твердом или жидком состоянии. Электролизом расплавленных солей (хлоридов, фторидов оксидов и др.) можно получить в свободном виде любой металл.
5) Металлотермические плавки;
6) Реакционные плавки, основанные на взаимодействие сульфидов и оксидов при нагревании.
Рафинировочные плавки. Цель их — рафинирование металлов от примесей. При этом используют различия в свойствах основного металла и металлов примесей. Эти плавки имеют следующие разновидности.
Производство чугуна и стали
... для доменной плавки. 2. Производство чугуна. 2.1. Исходные материалы., Железные руды. Железная руда состоит из рудного вещества и пустой породы. Рудным веществом чаще всего являются окислы, силикаты и карбонаты железа. А пустая ...
1) Ликвационное рафинирование. Оно основано на образовании и разделении по плотности двух фаз, из которых основная по количеству — жидкая или твердая — состоит из рафинируемого металла. Примесь же концентрируется во второй твердой или жидкой фазе, не растворимой в основном металле. Например, медь плохо растворяется в расплавленном свинце при 350 о С и всплывает на его поверхность в виде твердого раствора свинца и меди.
2) Дистилляционное рафинирование. Разделение металлов в этом процессе ведется на основе в давлениях паров металла и его примесей и осуществляется либо ректификацией, либо способом однократной дистилляции. Например, магний (t кип. =1107о С) отгоняется от алюминия (tкип. =2500о С) из их сплавов.
3) Окислительное рафинирование. Оно основано на различии сродства к кислороду у основного металла и у примеси. Например, железо, как примесь окисляется в расплавленной меди при вдувании в нее воздуха, а образующуюся закись железа не растворяется в жидкой меди и всплывает на ее поверхность:
(Cu + Fe) ж + 0,5 O2 →Cuж + FeOТВ
4) Хлорное рафинирование. Этот процесс основан на различном сродстве металла и примеси к хлору. Например, цинк можно отделить от свинца, пользуясь его большим сродством к хлору:
(Pb + Zn) ж + Cl2 →Pbж +ZnCl2ж
Образующийся хлорид цинка не растворяется в жидком свинце и всплывает на его поверхность.
5) Сульфидирующие плавки. Эти процессы основаны на различном сродстве металлов к сере. Например, отделение меди от свинца с помощью серы:
(Pb + Cu )ж + S2 →Pbж +Cu2S т в
6) Карбонильное рафинирование. Основано на образовании некоторыми металлами в специально подобранных условиях летучих соединений типа Металл(CO) n . Например, отделение никеля от меди.
(Ni + Cu) ж + 4CO→Ni(CO)4 +Cu
Гидрометаллургические процессы
Эти процессы протекают при t=100-300 0 С на поверхности соприкосновения твердой и жидкой фаз. Они делятся на следующие виды:
1. Выщелачивание. В этом процессе металл из руды переводится в раствор с последующим отделением пустой породы. В качестве растворителей применяют растворы кислот, щелочей, солей. Пример — растворение оксида цинка из обожженного цинкового концентрата в растворе серной кислоты с последующим отделением нерастворившихся остатков (кеков) от раствора отставанием и фильтрацией
(ZnO+Fe 2 O3 +SiO2 )тв.+H2 SO4 =ZnSO4 +(Fe2 O3 +SiO2 )тв.
обоженный цинковый концентрат кек
2. Очистка растворов от примесей. Растворы содержат помимо основного металла, и ряд примесей, перешедших в них при выщелачивании. Для очистки растворов от примесей применяют следующие приемы:
а) осаждение примесей реагентами. Например: осаждение примесей железа из сульфатных цинковых растворов оксида цинка:
Fe 2 (SO4 )3 +ZnO+H2 O→Fe(OH)3 +ZnSO4
б) экстракция органическими растворителями. Некоторые органические растворители обладают способностью растворять и одновременно образовывать с солями одних металлов комплексные соединения. Пример — экстракция азотного уранила трибутилфосфатом:
Технология производства чугуна
... доменных печей и использовать для получения чугуна сравнительно бедные железные руды. Чем выше содержание железа в шихте и лучше ее газопроницаемость, тем выше производительность печи, ниже ... самый распространенный метод обогащения), основанная на различии магнитных свойств минерала и пустой породы. Окускованием Современные технологии производства чугуна, стали, ферросплавов и литья включают в ...
UO 2 (NO3 )2 + 2 ТБФ→UO2 ∙2NO3 ∙2ТБФ
в) адсорбционные и ионообменные процессы с применением ионитов (синтетических смол).
Некоторые смолы обладают способностью к обмену ионов Н + , имеющихся в их составе, на некоторые катионы, находящиеся в растворе. Пример — извлечение урана из растворов ионообменными смолами
UO 2 SO4 + катионит HR→UO2 R2 + H2 SO4
г) кристаллизация, обычно в форме дробной кристаллизации, т.е. кристаллизации повторенной многократно, в результате чего в одном конце цепи кристаллизаторов получаются чистые кристаллы соли одного металла, а на другом конце — раствор примеси. Например — кристаллизационное разделение оксифторидов циркония и гафния, основанное из их различной растворимости в воде.
3. Осаждение металла из раствора в свободном виде. Для осаждения металла из раствора можно использовать один из
1) электролитическое осаждение из водных растворов
2) цементацию — вытеснение одного металла из раствора другим
Fe + CuSO 4 →FeSO4 +Cu
3) восстановление газообразным (H 2 , CO, CH4 ) или твердым восстановителем под давлением.
Чугуном называют сплав, содержащий более 2,14 % углерода, сталью — меньше 2,14 % углерода.
Очень чистое и сверхчистое железо применяют в электротехнике, где используют его магнитные свойства, а также при производстве особо качественных сталей.
Получение чугуна в доменной печи и передел чугуна на сталь (двухступенчатая схема) в настоящее время является основой в металлургии и в перспективе по этой схеме будет выплавляться основная масса стали. Однако уже теперь существует одноступенчатая схема, при которой отпадает необходимость в дорогостоящем коксе. Построен Оскольский электрометаллургический комбинат по производству стали методом прямого восстановления железа.
Исходные материалы для доменной плавки
Железные руды.
Для получения чугуна используют красные, бурые и магнитные железняки (их рудные минералы — оксиды) и железный шпат (карбонат).
Fe 2 O3 — гепатит (красный железняк, минерал), пустая порода их SiO2 и кальцит CaCO3 иногда глина Al2 O3 ∙2SiO2 ∙H2 O и др. Гематитовые руды содержат в среднем 51-66 % Fe, а чистый гематит — 70 % Fe.
Fe 2 O3 ∙nH2 O — лимонит (бурый железняк, минерал), кристаллизует оксид железа. Пустые породы сходны по составу с пустыми породами красного железняка. Массовое содержание железа колеблется от 55 до 30 % и ниже.
FeO∙Fe 2 O3 (Fe3 O4 ) — магнитный оксид железа (минерал магнитный железняк).
В пустых породах присутствуют силикаты (полевые шпаты, граниты), сульфиды, кальциты и т.д. Массовое содержание железа в богатых магнетитовых рудах колеблется от 50 до 72 %.
Шпатовый железняк или сидерит FeCO 3 , содержит 30-42 % Fe. При обжиге сидерита отщепляется диоксид углерода
FeCO 3 → FeO + CO2 и руда становится микропористой, что обеспечивает легкое восстановление железа при доменной плавке.
Металлургия меди
... 1. Таблица 1 - Ценностная структура медной и окисленной никелевой руд компонент руды содержание, % ценность, % компонент руды содержание, % ценность, % Медная руда Окисленная никелевая руда медь 2,5 26 никель 1,0 37,0 цинк ... марганец, и хром, производство которых тесно связано с металлургией чугуна и стали. Все остальные металлы относятся к, цветным. Название «цветные металлы» довольно условно, ...
Во многих месторождениях железные руды в составе своих минералов кроме железа содержат от долей процента до 1-2 %; хром, никель, ваннадий, кобальт, титан, медь, такие руды называют комплексными, а чугуны и стали, выплавленные из них называют легированными. Иногда содержат руды и марганец (1-2 %).
Марганцевые руды
Из главных минералов марганцевых руд пиролюзит MnO 2 ; манганит MnO2 ∙Mn(OH)2 ; псиломелан nMnO∙MnO2 n∙H2 O. Марганцевые руды содержат 20-55 % Mn. При выплавке ферромарганца эти руды являются основной частью шихты.
Подготовка руд к доменной плавке
Дробление. Добытые руды d 1200 мм, для плавки необходимы d=30-100 мм, поэтому дробление используют. Для получения концентрата руду дробят, измельчают до d=1-0,1 мм. Для обогащения руду обрабатывают промывкой, обжигом, магнитной сепарацией.
Промывку применяют для обогащения руд, содержащих песчано-глинистые породы: при промывке вода уносит легкие частицы пустой породы.
Обжиг руды производят для удаления влаги, диоксида углерода и частично выжигания серы, в результате чего руда очищается и обогащается соединениями железа. Кроме того, обжиг немагнитного оксида железа Fe 2 O3 производят в целях перевода его в магнитное соединение Fe3 O4 (3Fe2 O3 +CO→2Fe3 O4 + CO2 ), чтобы можно было производить магнитное обогащение. Для магнитного обогащения используют аппараты магнитные сепараторы. Содержание железа в концентрате 60-70 %.
Для придания пригодности к доменной плавке, мелкие и порошкообразные концентраты окусковывают (агломерация, окатывание).
Агломерация. Шихта составляется из мелкого и порошкообразного концентрата с добавлением топлива (угля), флюса (известняка).
Спекание производят при t=1100-1200 0 С на агломерационных ленточных машинах.
CaCO 3 ®CaO + CO2 ; Fe2 O3 →FeO→FeO +SiO2 →Fe2 SiO4
Окатыши — прочнее агломерата. Для получения окатышей 88-90 % концентрата смешивают 0,3-1,5 % бетонита (глина), эту смесь увлажняют, гранулируют до частицы 10-20 мм, сушат, t=250-400 0 C, затем обжиг (t=1200-13500 C) и охлаждение.
При введении в шихту известняка получают также офлюсованные окатыши для доменной плавки.
Топливо. Основное топливо для доменных печей — каменноугольный кокс. Для снижения расхода кокса и интенсификации процесса в доменную печь вдувают природный газ, а также мазут и угольную пыль.
Флюсы. Во всех железных рудах, а также в золе от кокса в избытке содержатся кремнезем и глинозем. Для их сплавления в шихту в качестве флюса добавляют известняк или доломит; они способствуют также ошлаковыванию серы, вредной примесью в чугуне.
Загрузка доменной печи коксом, рудой и флюсом осуществляется отдельными порциями — колошами.
Доменная плавка и их продукты
Доменная печь — является шахтной печью, в которой выделяют колошник, шахту, распар, заплечики, горн и лещадь.
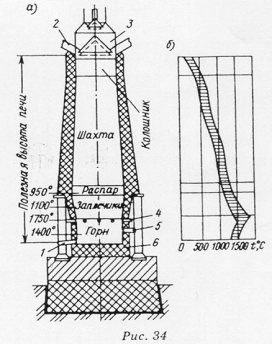
Печь в стальном кожухе выкладывают огнеупорами: лещадь и горн — из углеродистых блоков, заплечики, распар, шахту, колошник — шамотным кирпичом.
Через колошниковый затвор в доменную печь загружают шихту. Шахта имеет форму усеченного конуса, расширяющегося книзу, что способствует свободному опусканию шихты. На уровнераспара и заплечиков образуется губчатое железо, которое затем науглероживается, плавится и стекает в горн. В горне на лещади накапливается жидкий чугун, его плотность 6,9 г/см 3 , а плотность шлака 2,5 г/см3 , поэтому слой шлака находится над чугуном. Периодически и чугун, и шлак выпускают через летки (5,1), t чугуна при выпуске 1300-14000 С, шлака — на 40-800 С выше.
Окислительное дутье подается через фурмы под давлением.
Крупные доменные печи оборудуются четырьмя летками для выпуска чугуна. Печи с полезным объемом 5500м 3 имеют общую высоту более 100м и дают 4-4,5 млн.т чугуна в год.
Доменный процесс
При доменной плавке железо и другие металлы восстанавливаются из оксидов и науглероживаются, а пустые породы и зола топлива шлакуются.
Кислород дутья вступает в реакцию с углеродом кокса
С + О 2 → СО2 +∆Н t > 1000o C
CO 2 + C → 2CO — ∆H
Восстановление железа происходит в средней части шахты. При опускании шихты к распару эти реакции протекают быстрее
3Fe 2 O3 + CO → 2Fe3 O4 + CO2 +∆H3 O4 + CO → 3FeO + CO2 — ∆H+ CO → Fe + CO2 + ∆H= 400-1000o C H2 O +C →H2 + CO — ∆H
Fe 2 O3 + H2 → 2Fe3 O4 + H2OО + C → Fe + CO — ∆H
На уровне заплечников также восстанавливаются частично
MnO + C → Mn + CO — ∆H 2 + 2C → Si + 2CO — ∆H3 (PO4 )2 + 5C → 3CaO + 5CO + 2P — ∆H
Науглероживание железа начинается в шахте вслед за его восстановлением
Fe + 2CO→Fe 3 C + CO2
карбид железа
Однако, быстрое науглероживание железа происходит в распаре и в заимчиках
Fe + C→Fe 3 C
Помимо углерода в железе растворяются восстановленные марганец, кремний и фосфор, сера из кокса реагирует с железом и марганцем, образуя FeS и MnS. При плавке комплексных руд восстанавливаются также хром, ванадий, никель, кобальт, медь.
Если в шихту добавляют флюс CaCO 3 , то CaCO3 =CaO +CO2
CaO + FeS +C →Fe +CaS + ∆H
удаляется сера в шлак
Продукты доменного производства
По назначению чугуны делятся на передельные, идущие в переплавку на сталь (а также частично для литейного производства), литейные, применяемые исключительно для фасонного литья, и ферросплавы, служащие при производстве стали для ее раскисления и легирования.
Массовое содержание углерода как в передельном, так и в литейных чугунах составляет 3,2-4,5 %.
- 90 % выплавляемого чугуна составляет передельный чугун, 9-12 — литейный, ферросплавы — менее 1 %.
Ферросплавы имеют повышенное (более 10 %) массовое содержание одного из нескольких элементов (Mn, Si, Cr и др.) В доменных печах выплавляют лишь ферромарганец, другие — в электропечах.
По цвету излома вес углерод или его большая часть находится в виде графита, что и придает излому серый или темно-серый цвет. Серый чугун применяют исключительно как литейный, характерным для него является повышенное содержание кремния и пониженное содержание серы. Этот чугун при литье хорошо заполняет формы, заготовки из него легко обрабатываются режущими инструментами.
В белом чугуне весь углерод находится в виде цементита Fe 3 C (карбид), что и определяет белый цвет излома. Основная масса его используется для передела на сталь; находят применение также чугунные отливки с отбеленной поверхностью для деталей, в которых требуется высокая твердость и износоустойчивость: прокатные валки, шары мельниц, лемехи плугов; твердость и износоустойчивость придает цементит.
Шлак из доменной печи по желобу стекает в ковш. Затем его гранулируют струей воздуха или пара над водяным бассейном. Из гранулированного шлака приготовляют шлакобетон, шлаковый кирпич; при гранулировании паром из шлака получают шлаковую вату для тепловой изоляции.
Прямое получение губчатого железа. (Курская обл., руда Лебединского месторождения, на ней работает Оскольский электрометаллургический комбинат).
Получаемая железная губка содержит менее 0,01 % S и менее 0,003 % P.
Основная масса железной губки производится в шахтных печах. С печи высотой 10-14 м, диаметр 3-3,5 м, производительность 1000-1500 м в сутки металлизованных окатышей.
В шахте имеются две зоны: зона восстановления и зона охлаждения.
В зоне восстановления окатыши омываются встречным потоком восстановительного газа, содержащего CO и H 2 .
Аналогично как в доменной печи, в результате в окатышах образуется железо в виде губки (пористой массы).
Восстановительный газ получают при конверсии (неполном сжигании) природного газа,
2CH 4 + O2 →2CO + 4H2 +∆H2 H6 + O2 →2CO +3H2 +∆H
которая производится в находящемся при печи реакторе.
В зоне охлаждения окатыши омываются оборотным газом, который подается непрерывно в шахту компрессорами. Металлизированные окатыши через затвор периодически выдаются из шахты. В зависимости от назначения получаемых окатышей степень металлизации их определяется различно.
Степень металлизации окатышей, идущих для доменной плавки, 60-80 %; для выплавки стали — 85-90 %; для производства железного порошка — 98-99 %.
Переработка чугуна в сталь. Сталь является материальной основой промышленного производства и строительства, важнейшим продуктом черной металлургии. В сравнении с чугуном она имеет более высокие механические свойства; ее можно обрабатывать давлением; многие сорта стали в расплавленном состоянии обладают достаточной жидкотекучестью для получения фасонных отливок. Основная масса стали (90-92 %) подвергается обработке давлением (прокатке, прессованию, ковке, штамповке).
Задача передела чугуна в сталь состоит в том, чтобы из чугуна удалить избыток углерода, кремния, марганца и других примесей. Особенно важно при этом удалить вредные примеси серы и фосфора, придающие стали хрупкость. Углерод чугуна, соединяясь с кислородом, превращается в газ СО, который улетучивается. Другие примеси переходят в различные соединения, нерастворимые или малорастворимые в металле; эти соединения вместе с флюсами образуют на поверхности металла шлак.
Производство стали в кислородных конвертерах
В производстве стали широко используют кислородно — конвертерные процессы при продувке кислородом сверху, а также через днище и при комбинированной продувке (сверху и через днище).
Их преимуществами являются высокая производительность, которая обеспечивается интенсивностью процессов окисления элементов, а также меньшие по сравнению с мартеновскими цехами затраты на
В кислородных конвертерах могут выплавляться как углеродистые, так и легированные стали. Конвертеры бывают стационарные и вращающиеся. Вместимость стационарных конвертеров от 100 до 400 т.
В конвертер сначала погружают скрап, далее заливают чугун, затем засыпают известь, а также боксит, железную руду и окалину (если нужно), после чего производят продувку кислородом под давление 900-1000 кПа.
Fe + ½O 2 → FeO + ∆H
Образуются две жидкие фазы: металл (d=7,8г/см 3 ); шлак (d=2,5 г/см3 ).
FeO + Si → 2Fe + SiO 2 + ∆H
FeO + Mn → Fe + MnO + ∆H
фосфор выгорает по реакции
FeO + 2Р → P 2 O5 + 5Fe + ∆H
углерод выгорает по реакции
FeO + C → Fe + CO + ∆H
CO + ½O 2 → CO2 + ∆H
Разогрев ванны способствует растворению извести, боксита и оксидов железа, в результате образуется активный основной шлак с избытком свободного оксида кальция, который связывают фосфор в нерастворимое в металле и шлаке соединение:
P 2 O5 + CaO → (CaO)4 P2 O5 + ∆H
FeS + CaO → FeO + CaS + ∆H — шлакование серы
Раскисление стали, выпущенной в ковш, необходимо, так как содержание оксида железа в ней повышено, что вызывают в стали красноломкость
FeO + 2Al → 3Fe + Al 2 O3 + ∆H
(продувка 30 минут)
Производительность кислородных конвертеров 250 тонного — 1200 тыс. т стали в год.
Производство стали в мартеновских и двухванных печах
В мартеновских печах сталь выплавляют из твердого или жидкого чугуна, стального и чугунного лома, окисленных и металлизированных окатышей с добавками железных руд, окалины флюсов т ферросплавов; при этом получают побочный продукт- мартеновский шлак.
Мартеновская печь
Ее плавильное пространство ограничено снизу подиной; сверху — сводом, с боков — стенками. В передней стенке печи находится окна через которые поступает шихта. Подина печи наклонена к задней стенке, в которой находится летка, закрытая во время плавки пробкой из огнеупорной массы; для выпуска стали пробку снаружи пробивают.
Основные химико-физические процессы, происходящие при плавке в мартеновской печи, аналогичны процессам при конверторной плавке.
Двухванные печи, получают перестраиванием мартеновских, причем капитальные затраты в пять-шесть раз меньше, чем при строительстве новых мартеновских печей.
Производительность двухванных печей примерно в два раза выше производительности мартеновских.
Производство стали в электропечах
Выплавка стали в электропечах получает все большее развитие. Отсутствие окислительного пламени и незначительный доступ воздуха. А то и полное его отсутствие дают возможность создать в печах нейтральную или восстановительную среду и весьма полно раскислять сталь. Высокая температура в печи позволяет наводить высокоизвестковистые шлаки для более полного удаления серы и фосфора. Благодаря возможности лучшего управления плавкой удается выдавать сталь точно заданного состава.
В настоящее время этот способ широко применяют для выплавки высококачественных углеродистых и легированных сталей. А также ферросплавов.
Печи бывают дуговые и индукционные.
Плавка в дуговых электропечах
Преимущество имеют основные электропечи, в которых получают высококачественную сталь с минимальным содержанием серы и фосфора.
При нагреве электрическими дугами в плазме дуги развивается температура 10000 о С и выше.
Шихта для плавки в дуговой печи состоит на 90% и более из скрапа и металлизированных окатышей, чугуна 5-10%.
Производство стали в электропечах
Выплавка стали в электропечах получает все большее развитие. Отсутствие окислительного пламени и незначительный доступ воздуха, а то и полное его отсутствие дают возможность создать в печах нейтральную или восстановительную среду и весьма полно раскислять сталь. Высокая температура в печи позволяет наводить высокоизвестковые шлаки для более полного удаления серы и фосфора. Благодаря возможности лучшего управления плавкой удается выдавать сталь точно заданного состава.
В настоящее время этот способ широко применяют для выплавки высококачественных углепородистых и легированных сталей, а также ферросплавов.
Печи бывают дуговые и индукционные.
Плавка в дуговых печах. Преимущество имеют основные электропечи, в которых получаю высококачественную сталь с минимальным содержанием серы и фосфора.
При нагреве электрическими дугами в плазме дуги развивается температура 10000 о С и выше.
Шихта для плавки в дуговой печи состоит на 90 % и более из скрапа и металлизированных окатышей, чугуна 5-10 %.
Для окисления примесей в расплавленный металл погружают железную руду и окалину, а для наводки необходимого шлака — флюсы. К концу первого (окислительного) периода плавки в основном заканчивается удаление фосфора, остаточное содержание фосфора не превышает 0,01-0,02 %.
Задача второго периода — окончательная очистка от примесей. Для этого наводят новый шлак из извести и плавкого шпата или шамота с последующей добавкой молотого кокса.
Сначала металл раскисляют, забрасывая ферромарганец и ферросилиций или комплексный сплав марганца, кремния и железа — силико-марганец.
FeO + Si→2Fe + SiO 2 + ∆H
FeO + Mn →Fe + MnO + ∆H
FeO + C →Fe + CO + ∆H
Сера переходит в шлак по реакции
FeS + CaO →FeO + CaS +∆H
В перегретом шлаке углерод кокса, реагирует с известью, образует карбид кальция
CaO + 3C→CaC 2 +CO
FeO + CaC 2 →3Fe + CaO +2CO
раскислитель
3MnO + CaC 2 →3Mn + CaO + 2CO
Раскисление производят также порошковыя ферросилицием или алюминием.
При электроплавке стали широко применяют продувку кислородом (если в шихте много легированных отходов).
В этом случае получают большую экономию дорогих ферросплавов, электроэнергии электродов. Производительность печей увеличивается на 20-30 %.
Плавка в индукционных печах. Работа индукционных печей основана на передаче электромагнитной энергии путем индукции. Индукционные печи применяют при производстве слитков и фасонного литья из высоколегированных, для выплавки углеродистых сталей с минимальным содержанием углерода и различных других сплавов.
Металлургия цветных металлов
Цветные металлы — медь, никель, кобальт, алюминий, магний, титан, свинец цинк, олово, — обладают ценными свойствами и поэтому несмотря на относительно высокую стоимость широко применяются в промышленности.
Однако во всех случаях, когда это возможно, цветные металлы заменяют черными металлами или неметаллическими материалами.
Производство меди
Медь по применению в промышленности занимает одно из первых мест среди цветных металлов. Высокая пластичность, электро- и теплопроводность, повышенная коррозийная стойкость — ценнейшее свойство меди. Вследствие высокой электропроводности медь — лучший металл для электромашиностроения, изготовление кабелей и проводов для передачи электроэнергии. Медь является основой в сплавах, широко применяемых во всех отраслях машино- и приборостроения.
Медные руды
Медные руды делятся на две основные группы: сульфидные, в которых медь связана с серой в составе сульфидных минералов и окисленные, где медь входит в виде оксидов. Встречается самородная медь с массовым содержанием Cu до 99,9 %. На сульфидные руды приходится около 80 % всех мировых запасов меди. Наиболее распространен в сульфидных рудах халькопирит (медный колчедан) CuFeS 2 . За ним следует халькозин (медный блеск) Cu2 S, борнит Cu2 FeS3 и реже ковеллин CuS. Из окисленных руд наиболее распространен малахит CuCO3 ∙Cu(OH)2
Среднее содержание меди в промышленных рудах составляет 1-2 %, минимальное 0,3 %. Руды, содержащие 3 % меди и более считаются богатыми. В состав пустой породы медных руд входит кварц, барит, кальцит и различные алюмосиликаты.
Получение меди
Около 20 % меди получают из руд гидрометаллургическим способом, при котором руда обрабатывается растворителем, переводящим медь в раствор. Из раствора медь осаждают электролизом или химическим способом. Этот способ применяют для переработки бедных окисленных и самородных руд.
Основную массу меди получают пирометаллургическим способом, т.е. выплавляют из сульфидного медного концентрата (продукта обогащения руды флотацией).
Полученные медные концентраты подвергают обжигу в многоподовых печах или в печах «кипящего слоя» для окисления железа, уменьшения содержания серы, удаления мышьяка, сурьмы и других примесей. Основные реакции при обжиге:
FeS + 3,5O 2 →Fe2 O3 +2 SO2 + ∆H
Cu 2 S + 1,5O2 →Cu2 O + SO2 +∆H
Основным продуктом обжига является огарок, который плавят в пламенных отражательных, шахтных или электрических печах. В результате плавки получают два несмешивающихся расплава: на поду печи — штейн — расплав сульфидов, поверх его шлак — расплав оксидов, в который переходит вся пустая порода и большая часть железа в окисленном состоянии. Основные реакции плавки:
Cu 2 S + 6 Fe2 O3 →2 Cu + 4Fe3 O4 +SO2
2Cu + FeS →Cu 2 S + Fe
Fe + Fe 3 O4 → 4FeO
FeO + SiO 2 →Fe2 SiO4
флюс шлак
Cu 2 S + FeS →штейн
Переработка штейна осуществляется в конвертерах, где через жидкий штейн в присутствии кварцевого флюса продувают воздух, в результате чего сера выгорает по реакции:
FeS + 1,5O 2 →FeO + SO2
а железо шлакуется 2FeO + SiO 2 →Fe2 SiO4
шлак
Сернистый газ отводится по газопроводу на очистку от пыли и на производство серной кислоты; шлак сливается из конвертера и в конвертере остается почти чистый сульфид меди. На этом заканчивается первый период плавки. После удаления шлака белый штейн продувают на черновую медь (второй период), при этом происходит окисление сульфидов меди:
Cu 2 S + 1,5O2 →Cu2 O +SO2
черновая медь
Реакции окисления серы и железа обеспечивают поддержание в конвертере t =1250-1350 о С, черновая медь содержит 98,5-99,5 % Cu и до 1,5 % рудных примесей, главным образом железа, серы, кислород, а также никель, кобальт и др. металлы (Ag, Au).
Черновая медь подвергается огневому и электролитическому рафинированию.
Огневое рафинирование
Производят в отражательных печах для удаления железа, серы и др. примесей, ухудшающих свойства меди. Медь окисляется:
Cu +½O 2 →Cu2 O
Cu 2 O +Ме→МеO + 2Cu
примесь
МеО +SiO 2 →nМеО∙mSiO2
шлак
Электролитическое рафинирование
Производят с целью получения наиболее чистой меди (99,99 % Сu) и попутного извлечения золота, серебра, селена, теллурия, которые почти всегда содержатся в конвертерной меди и при огневом рафинировании полностью остаются в ней.
К А + (Cu
толщина катода СuSO 4 + H2 SO4
=0,6-0,7 мм (200 г/л)
Cu 2+ + 2ē→Cu Cu — 2ē→Cu+2
Нерастворимые примеси и в их числе золото, платина, серебро, селен, теллур в виде твердых частиц (шлам) собираются на дне ванны, их периодически удаляют.
Медь первичная по ГОСТ 859-78 подразделяется на марки с массовым содержанием Cu от 99,950 до 99,993 %. Медь поставляется в качестве полуфабрикатов в виде прутков, листов, лент, проволоки, фольги и др.
Технологическая схема переработки медных сульфидных руд
Металлургия никеля
Никель был открыт еще в 1751 году, но в течении последующих 50-70 лет он не находил промышленного применения; его использовали лишь как ювелирный металл. Только в 1825-1826 годах в Швеции было организовано первое (в небольших количествах) промышленное получение никеля.
Развитие никелевой промышленности длительное время сдерживалось отсутствием рациональных методов переработки известных в то время никелевых руд. И никель тогда использовался только для получения медно-никелевого сплава, необходимого для чеканки разменной монеты. В конце XIX и начале ХХ века когда стали известны многие ценные физические и технические свойства этого металла и были открыты богатые залежи никелевых руд в Новой Каледонии и в Канаде, начался рост производства никеля.
В настоящее время никель стал одним из необходимейших в промышленности металлом, так как он обладает многими свойствами выгодно отличающими его от некоторых других цветных металлов.
Никель — твердый, гибкий, ковкий металл он допускает все виды обработки; из него можно изготовить тончайшие листы, трубки, ленту. Никель тугоплавкий, поэтому широко применяется в технике высоких температур, а также стоек в кислотах. Прочность и антикоррозионная стойкость никеля выше, чем других тяжелых цветных металлов. Никель образует соединения и сплавы со многими металлами и сообщает им разнообразные и очень ценные свойства (повышенную прочность, вязкость, кислотостойкость, жаропрочность), а также придает им красивый внешний вид.
В природе никель находится в виде оксидов NiO,Ni 2 O3 и сульфидов NiS, Ni3 S2 , (Fe, Ni)9 S8 ; NiAsS.
Технологическая схема
В шихту добавляем гипс CaSO 4 ∙nH2 O или пирит FeS2 , чтобы сульфировать металлы.
CaSO 4 + 4CO →CaS + 4CO2
NiO + 2CaS + CO → Ni 3 S2 + 2CaO + CO22 O3 + CO → 2FeO + CO2 + CaS → FeS + CaO3 S2 + mFeS → n∙Ni3 S2 ∙mFeS
никелевый штейн 2 → FeS +½S2
FeS + 3NiO + CO → 2FeO + Ni 3 S2 + CO2
Брикетирование проводят под давлением. Агломерация производится на спекательных машинах.
В условиях шахтной плавки:
NiO + CO → Ni + CO 2
Fe + CO → Fe + CO 2
nNi + mFe → nNi∙mFe — ферроникель.
В результате бессемерования получают Ni 3 S2 — чистый штейн → файнштейн, железо в этом процессе удаляется в шлак, CO переходит в шлак, его концентрация увеличивается в несколько раз.
Шлаки конверторные направляют на плавку для получение кобальта.
Бессемерование никелевого штейна
(nNi 3 S2 ∙mFeS)
1) 2Fe + O 2 + SiO2 → 2FeO∙SiO2
2) окисление FeS
2FeS + SO 2 + SiO2 → 2FeO∙SiO2 + 2SO2
3) Ni + ½ O 2 → NiO
NiO + Fe → FeO + Ni 3 S2 + 3½O2 → 2NiO + 2SO2
3NiO + 3FeS + O 2 → Ni3 S2 + 3FeO + SO2
файнштейн
FeO + SiO → 2FeO·SiO 2
шлак
Разливают файнштейн в песочные изложницы. Всплывшая FeO снимается деревянными скребками
Переработка файнштейна
Ni 3 S2 + 4N2 O → 7Ni + 2SO2
Гидрометаллургия никеля
В качестве растворителя используют раствор серной кислоты.
Оксид никеля растворяется
NiO + H 2 SO4 = NiSO4 + H2 O
раствор
Хвосты содержат
Ni — 0,06 %;
- CO — 0,008 %;
- Fe — 47,5 %; -4,5 %.
— 0,76 %; — 2,01 %; — 3,7 %;
Товарный раствор содержит
Ni — 4,28 г/л
СO — 0,46 г/л
Al — 1,66 г/л
Mn — 1,42 г/л
Mg — 1,98 г/л
H 2 SO4 — 47 г/л
Для избавления от H 2 SO4
H 2 SO4 + CaCO3 = ↓CaSO4 + CO2 + H2 O
гипс
Осаждение никеля сероводородом
NiSO 4 + H2 S →↓NiS + H2 SO4
Остальные примеси остаются в растворе.
Концентрат MeS содержит
Ni — 55 % Извлечение Ni и Co 92-95 %
Co — 5,8 %
Fe — 0,3 %
Cu — 1 %
S — 35,62 %
Zn — 1,72 %
Переработка концентрата
Металлургия цинка
Цинк — металл серебристо-белого цвета. При комнатной температуре он хрупок, на при t =100-150 о С приобретает пластичность, легко прокатывается в листы, металл коррозийно устойчив.
Применяют его главным образом для приготовления различных сплавов (латунь 60 % Cu; 40 % Zn).
В природе Zn находится в виде сульфидов (ZnS — сфалерит минерал) — цинковая обманка (карбонат); ZnCO 3 — цинковый шпат (минерал смитсонит).
Получение цинка
Восстановление цинка из сульфидных руд производят в две стадии:
1. Окислительный обжиг руды
2ZnS + 3O 2 = 2ZnO + 2SO2 ↑
2. Восстанавливают оксид цинка
ZnO + C = Zn + CO↑
Гидрометаллургия. В качестве растворителя используют H 2 SO4
(ZnO + Fe 2 O3 + SiO2 ) тв. + H2 SO4 = ZnSO4 + (Fe2 O3 +SiO2 ) тв.
обожж. цинковый конц-т кек
Из раствора ZnSO 4 электролизом получают металл Zn.
Производство алюминия
Алюминий легкий металл. Обладает высокой пластичностью, хорошей электропроводностью, стойкостью против азотной и органических кислот, однако разрушается щелочами, соляной и серной кислотами; на воздухе он устойчив против коррозии, так как на поверхности его имеется плотная оксидная пленка, изолирующая внутренние слои от действия атмосферы.
Рудами алюминия служат породы богатые глиноземом Al 2 O3 и залегающие крупными массами на поверхности земли. К таким породам относятся бокситы, нефелины, алуниты и каолины (глины).
Важнейшая алюминиевая руда — бокситы — состоит из гидроксидов алюминия и железа, кремнезема, соединений кальция, магния. В качестве руд используют также нефелины и алуниты.
Производство алюминия складывается из двух основных процессов: получение глинозема Al 2 O3 из руды и электролиза глинозема.
Производство глинозема
Получают его тремя способами: щелочным, кислотным и электротермическим.
Наибольшее распространение получил мокрый щелочной способ К.И. Байера, применяемый для переработки высокосортных бокситов с небольшим содержанием (5-6 %) кремнезема. По этому способу боксит после дробления и размола выщелачивают концентрированным раствором гидрокисда натрия в автоклавах при t = 250 o C и давлении 2500-3000 кПа. Автоклавы обогревают перегретым паром.
Гидроксид алюминия из боксита быстро и достаточно полно растворяется с образованием алюмината натрия
Al(OH) 3 + NaOH → NaAlO2 + 2H2 O
Кремнезем боксита также растворяется с образованием силиката натрия Na 2 SiO3 , который реагирует с алюминатом натрия и водой, в результате чего образуется натриевый алюмосиликат Na2 O∙Al2 O3 ∙2SiO2 ∙nH2 O, выпадающий в осадок. Поэтому чем больше кремнезема в боксите, тем меньше извлечения глинозема в раствор.
Разложение алюминиевого раствора для получения кристаллического гидроксида алюминия называют выкручиванием.
Производят его в баках, куда для ускорения процесса вводят небольшое количество гидроксида алюминия кристаллического, играющего роль центров кристаллизации.
Реакция гидролиза идет в разбавленных водой растворах при медленном перемешивании пульпы.
NaAlO 2 + 2H2 O→Al(OH)3 + NaOH
Длительность выкручивания 75-90 часов, кристаллический Al(OH) 3 после промывки фильтруют и обжигают для полного обезвоживания t=1200о С в трубчатых вращающихся печах.
Полученный глинозем Al 2 O3 охлаждают и направляют на электролиз. По сухому щелочному способу, разработанному под руководством А.А. Яковкина, для бокситов с повышенным содержанием кремнезема руду и известняк (CaCO3 ) после дробления смешивают с содой Na2 CO3 и спекают при t=1200-1300о С в барабанных вращающихся печах.
В результате получаются окатыши спека, содержащие металлалюминат натрия Na 2 O∙Al2 O3 , а также нерастворимые в воде двухкальцевый силикат (CaO)2 ∙SiO2 , метаферрит натрия Na2 O∙FeO и др.
Далее спек выщелачивают содовым раствором, в результате алюминат натрия переходит в раствор. Для выделения гидроксида алюминия алюминатный раствор разлагают методом карбонизации, для чего через раствор пропускают печные газы, содержащие CO 2 .
Na 2 O∙Al2 O3 + CO2 +3H2 O→2Al(OH)3 +Na2 CO3
Кристаллический гидроксид кальцинируют (обжигают) и получают глинозем Al 2 O3 . Раствор соды идет на выщелачивание или выпаривание для получения соды. Для получения глинозема из нефелина его спекают только с известняком и получают глинозем, сода не нужна, так как в нефелине содержится до 20 % Na2 O + K2 O. Известково-кремнистый шлам, выпадающий при выщелачивании нефелинового спека, используют для производства цементита.
После карбонизации в растворах содержится много оксидов натрия и калия: их используют для получения поташа и соды.
Электролиз глинозема
Алюминий получают при электролизе глинозема, растворенного в криолите (Na 2 AlF6 ).
Электролизная ванна имеет стальной кожух, выложенный изнутри шамотным кирпичом. Подина и стены ванны составлены из углеродистых блоков, к которым подведены катодные глины. Углеродистые аноды самообжигающиеся: по мере сгорания они опускаются и наращиваются сверху за счет жидкой анодной массы.
В расплаве криолита поддерживается содержание глинозема 8-10 %, периодически загружаются новые порции.
Потенциал электролитической диссоциации глинозема (1,7 В) меньше, чем криолита (3,7 В).
Глинозем диссоциирует
Al 2 O3 →2Al3+ +3O2-
Катод Al 3+ + 3ē→Al
Анод 2О -2 — 4 ē→О2 ↑
С+О 2 →СО2 (анод выгорает)
Напряжение тока 4-4,3 В, сила тока до 140000А. Для получения 1 кг алюминия расходуется 60-70 МДж электроэнергии и около 2 кг глинозема. Накапливающийся на подине ванны жидкий алюминий периодически отбирают сифоном или вакуум-ковшом. Полученный алюминий подвергают рафинированию путем дополнительно электролитического процесса, при котором анодом является исходный жидкий алюминий, а катодом — рафинированный жидкий алюминий.
Качество алюминия определяется степенью его чистости.
ГОСТ 11060-74 установлены марки от А 0 (99,0 % Al) до A 999 (99,999 % Al).
Алюминий первичный поставляется в чушках или слитках до 1000 кг Из первичного алюминия изготовляют фасонные прессованные и прокатные профили: полосы, уголки, швеллеры, тавры, прутки, проволоку, трубы, ленты, листы, плиты, фольгу; изготовляют также порошок, пудру.
Алюминий для раскисления стали, производства ферросплавов, металлотермии выпускают марок АВ 85 до АВ 97 (ГОСТ 295-79 Е).
Производство магния
Магний — очень легкий металл. Основным его недостатком является малая химическая стойкость. Чистый магний используют в металлотермии и в качестве твердого топлива в реактивной технике и в сплавах.
Руды для производства магния — магнезит MgCO 3 ; доломит MgCO3 ∙СaCO3 , карналлит MgCl2 ∙KCl∙6H2 O и бишофит MgCl2 ∙6H2 O, получаемый из морской воды и озер.
Магнезит и доломит подвергают механическому обогащению и обжигу при t=850-900 о С
MgCO 3 →MgO + CO2 ↑
MgCO 3 ∙СaCO3 → MgO∙СaO + 2CO2 ↑
MgO-название каустический магнезит. Существует два способа получения магния: электролитический и термический.
Электролитический способ:
1) получение безводного MgCl 2
обработка MgO +Cl 2 +C→ MgCl2 +CO в электрической шахтной печи.
2) электролиз расплава MgCl2
MgCl 2 ↔ Mg2+ + 2Cl—
Катод Mg 2+ + 2ē → Mg
Анод 2Cl — — 2ē → Cl2 ↑
t = 700 o C, напряжение 6-7 В, сила тока 30000-70000 А. Аноды из графита катоды из стали.
Плотность электролита увеличивается добавкой CaCl 2 , чтобы он превышал плотность магния поэтому магний всплывает на поверхность электролита, откуда по мере накопления извлекается вакуумным ковшом. Расход электроэнергии на 1 т магния составляет 55000-60000МДж.
Рафинирование магния производится или переплавкой его вместе с рафинирующими флюсами (смесь хлористых солей щелочных и щелочно-земельных металлов) или возгонкой в вакууме при давлении 10-20 Па при t = 600 o C. Таким способом получают магний высокой чистоты (99,9 % Mg).
Термический способ — восстановление магния нефтяным коксом в герметической электропечи при t = 1900-2000 o C. Испаряющийся Mg охлаждается до t = 200o C, собирается, очищается путем дистилляции и переплавляется.
Восстанавливают оксид магния также кремнием в вакууме t = 1160oC, остаточное давление 10 Па.
MgO + Si = 2Mg + SiO 2
Побочные продукты процесса металлургии магния: хлор, который по хлоропроводам отводится для дальнейшего использования; CO 2 — выделяется в атмосферу; СО — горючий газ (угарный газ).
Производство титана
Титан обладает большой прочностью, высокой стойкостью в агрессивных средах и небольшой плотностью (4,5 г/см 3 ), поэтому он является весьма ценным конструкционным материалом. Титан и его сплавы широко используются в самолето — и ракетостроении, химическом машиностроении и судостроении, для транспортирования агрессивных жидкостей.
Основную массу титана для производства полуфабрикатов и сплавов на его основе получают магниетермическим способом в виде губчатого титана (титановая губка).
Рудами для получения титана являются ильменит, содержащий FeTiO 3 и рутил, содержащий TiO2 .
Руды подвергают обогащению (мокрому или электромагнитному), в результате чего получают титановые концентраты. Извлечение титана из концентратов — трудная задача, так как при высоких t реагирует он с О 2 и N2 , а в расплавленном состоянии со всеми известными огнеупорами.
Металлургия титана включает следующие процессы:
1) Получение в электрической шахтной печи тетрахлорида титана TiCl 4 при нагревании брикетов из смеси титановых концентратов или технического оксида титана TiO2 с углем в потоке хлора; тетрахлорид титана после конденсации паров получается в виде загрязненной красноватой жидкости, которую очищают дистилляцией.
2) Получение губчатого титана восстановлением тетрахлорида титана при взаимодействии с магнием в нейтральной атмосфере (аргон или гелий) при t =950-1000oC в зоне реакции
TiCl 4 + 2Mg = 2MgCl2 + Ti
3) Получение слитков титана в электрических дуговых печах под вакуумом. Для получения слитков губку прессуют с целью получения из нее электродов. Такой электрод подается в верхнюю часть печи и является одним полюсом постоянного тока. Другим полюсом служит медная водоохлаждаемая изложница. По мере плавления расходуемого электрода из губки и затвердевания слитка около холодных стенок дно изложницы опускается до получения заготовки нужной длины. Сила тока при плавке до 5400 А, напряжение около 30В.
Выпускаются три марки чистого титана (ГОСТ 19807-91): ВТ1-00 (99,42 % Ti); ВТ1-0 (99,32 % Ti) и ТВ-2 (98,25 % Ti).
В результате металлургических процессов образуется много различных отходов твердых и газообразных в том числе ядовитых газов SO 2 , CO по этому в металлургической промышленности остро стоят вопросы безотходного производства и охраны окружающей среды.
Литература
[Электронный ресурс]//URL: https://drprom.ru/kursovaya/metallurgiya/
1. В.Н. Никифоров Технология металлов и других конструкционных материалов. — СПб: Политехника, 2003, 382 с.
2. И.П. Бардин и отечественная металлургия. Академия наук СССР. Институт металлургии им. А.А. Байкова. изд-во «Наука», Москва, 1983.
3. А.Н. Зеликман, Г.М. Вольдман, Л.В. Белявская. Теория гидрометаллургических процессов.- М.: Металлургия, 1983, 424 с.
4. А.П. Вольский, Е.М. Сергиевская. Теория металлургических процессов. — изд-во «Металлургия», 1968, 344 с.
5. Гафаров Р.А., Емельянов В.Н., Нехорошкин Г.Ф. В помощь электролизнику.- Мурманское книжное издательство, 1970, 92 с.
6. Грань Т.В., Крылов А.С. Изд-во «Металлургия», 1970, 96 с.
