Галогены (от греч. halos — соль и genes — рождающий, рождённый) находятся в главной подгруппе VII группы периодической системы химических элементов.
К галогенам относят фтор, хлор, бром, иод и астат.
|
Хим. знак |
Распределение электронов |
||
|
по энергетическим уровням |
по энергетическим уровням и подуровням |
по орбиталям |
|
|
F |
+9F 2ē, 7ē |
+9F 1s22s22p5 |
1s2 2s2 2p5 +9F |
|
Cl |
+17Cl 2ē, 8ē, 7ē |
+17Cl 1s22s22p63s23p53d0 |
3s2 3p5 3d0 +17Cl … |
|
Br |
+35Br 2ē, 8ē, 18ē, 7ē |
+35Br …3d0 ׀ 4s24p54d0 |
4s2 4p5 4d0 +35Br … |
|
I |
+53I 2ē, 8ē, 18ē, 18ē, 7ē |
+53I …4d0 ׀ 5s25p55d0 |
5s2 5p5 5d0 +53I … |
На наружном энергетическом уровне атомов галогенов находятся семь электронов:
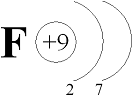
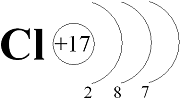
До восьми электронов (октета) на наружном энергетическом уровне, т.е. до устойчивого состояния атомов, характерного для благородных газов, атомам галогенов недостаёт по одному электрону. К тому же атомы галогенов по сравнению с атомами металлов того же периода обладают бόльшим зарядом ядра, меньшим атомным радиусом и имеют по одному неспаренному электрону. Поэтому атомы всех галогенов энергично присоединяют недостающий электрон. Например,
+ ē → Cl-.
Фтор в химических реакциях проявляет только окислительные свойства, и для него характерна степень окисления -1. Остальные галогены могут проявлять и восстановительные свойства при взаимодействии с более электроотрицательными элементами — фтором, кислородом, азотом, при этом степени их окисления могут принимать значения +1, +3, +5, +7. Восстановительные свойства галогенов усиливаются от хлора к йоду, что связано с ростом радиусов их атомов: атомы хлора примерно вдвое меньше, чем у йода.
1. Общая характеристика фтора
Фтор — (от др.-греч. <http://ru.wikipedia.org/wiki/%D0%94%D1%80%D0%B5%D0%B2%D0%BD%D0%B5%D0%B3%D1%80%D0%B5%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> φθόρος «разрушение, порча, вред», далее от φθείρω «уничтожать, истреблять, губить») — элемент <http://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82> 17-й группы периодической таблицы химических элементов <http://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2> (по короткой форме периодической системы <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%80%D0%BE%D1%82%D0%BA%D0%B0%D1%8F_%D1%84%D0%BE%D1%80%D0%BC%D0%B0_%D0%BF%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D1%8B_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2> — элемент главной подгруппы VII группы), второго периода, с атомным номером <http://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80> 9[5] <http://ru.wikipedia.org/wiki/%D0%A4%D1%82%D0%BE%D1%80> . Обозначается символом F (лат. <http://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D1%82%D0%B8%D0%BD%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> Fluorum).
Фтор — чрезвычайно химически активный неметалл <http://ru.wikipedia.org/wiki/%D0%9D%D0%B5%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB> и самый сильный окислитель, является самым лёгким элементом из группы галогенов <http://ru.wikipedia.org/wiki/%D0%93%D0%B0%D0%BB%D0%BE%D0%B3%D0%B5%D0%BD%D1%8B> . Простое вещество <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%81%D1%82%D0%BE%D0%B5_%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE> фтор (CAS-номер <http://ru.wikipedia.org/wiki/%D0%A0%D0%B5%D0%B3%D0%B8%D1%81%D1%82%D1%80%D0%B0%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80_CAS> : 7782-41-4 <http://www.chemnet.com/cas/supplier.cgi?exact=dict&terms=7782-41-4> ) при нормальных условиях <http://ru.wikipedia.org/wiki/%D0%A1%D1%82%D0%B0%D0%BD%D0%B4%D0%B0%D1%80%D1%82%D0%BD%D1%8B%D0%B5_%D1%83%D1%81%D0%BB%D0%BE%D0%B2%D0%B8%D1%8F> — двухатомный газ <http://ru.wikipedia.org/wiki/%D0%93%D0%B0%D0%B7> (формула F2) бледно-жёлтого цвета <http://ru.wikipedia.org/wiki/%D0%A6%D0%B2%D0%B5%D1%82> с резким запахом <http://ru.wikipedia.org/wiki/%D0%97%D0%B0%D0%BF%D0%B0%D1%85> , напоминающим озон <http://ru.wikipedia.org/wiki/%D0%9E%D0%B7%D0%BE%D0%BD> или хлор <http://ru.wikipedia.org/wiki/%D0%A5%D0%BB%D0%BE%D1%80>
.1 Медико-биологическая роль фтора
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз <http://ru.wikipedia.org/wiki/%D0%A4%D0%BB%D1%8E%D0%BE%D1%80%D0%BE%D0%B7> (крапчатость эмали) и остеосаркома <http://ru.wikipedia.org/wiki/%D0%9E%D1%81%D1%82%D0%B5%D0%BE%D1%81%D0%B0%D1%80%D0%BA%D0%BE%D0%BC%D0%B0> , соответственно[13] <http://ru.wikipedia.org/wiki/%D0%A4%D1%82%D0%BE%D1%80> .Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50 %[14] <http://ru.wikipedia.org/wiki/%D0%A4%D1%82%D0%BE%D1%80> .
Предельно допустимая концентрация связанного фтора[15] <http://ru.wikipedia.org/wiki/%D0%A4%D1%82%D0%BE%D1%80> в воздухе промышленных помещениях равна 0,0005 мг/литр воздуха.
Итак, фтор в человеческом теле выполняет следующие функции:
- поддерживает твёрдость и прочность костной ткани, в том числе и зубов;
- позволяет правильно формироваться всем костям скелета, ускоряет срастание костей при переломах;
- совместно с фосфором и кальцием предохраняет зубы от разрушения вследствие кариеса, устраняет в них микротрещины;
- принимает участие в процессе кроветворения;
- предотвращает ломкость волос и ногтей;
- укрепляет иммунитет и поддерживает его на должном уровне;
- улучшает состояние человека при остеопорозе;
- ускоряет всасывание железа;
- выводит из организма вредные вещества вроде радионуклидов и солей тяжелых металлов.
2. Общая характеристика хлора
Хлор (от греч. <http://ru.wikipedia.org/wiki/%D0%93%D1%80%D0%B5%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> χλωρός -«зелёный») — элемент <http://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82> 17-й группы периодической таблицы химических элементов <http://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2> (по устаревшей классификации <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%80%D0%BE%D1%82%D0%BA%D0%B0%D1%8F_%D1%84%D0%BE%D1%80%D0%BC%D0%B0_%D0%BF%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D1%8B_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2> — элемент главной подгруппы VII группы), третьего периода, с атомным номером <http://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80> 17[3] <http://ru.wikipedia.org/wiki/%D0%A5%D0%BB%D0%BE%D1%80> . Обозначается символом Cl (лат. <http://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D1%82%D0%B8%D0%BD%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> Chlorum).
Химически активный неметалл <http://ru.wikipedia.org/wiki/%D0%9D%D0%B5%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB> . Входит в группу галогенов <http://ru.wikipedia.org/wiki/%D0%93%D0%B0%D0%BB%D0%BE%D0%B3%D0%B5%D0%BD%D1%8B> (первоначально название «галоген» использовал немецкий химик Швейгер <http://ru.wikipedia.org/wiki/%D0%A8%D0%B2%D0%B5%D0%B9%D0%B3%D0%B5%D1%80> для хлора — дословно «галоген» переводится как солерод — но оно не прижилось и впоследствии стало общим для 17-й (VIIA) группы элементов, в которую входит и хлор[4] <http://ru.wikipedia.org/wiki/%D0%A5%D0%BB%D0%BE%D1%80> ).
Простое вещество <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%81%D1%82%D0%BE%D0%B5_%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE> хлор (CAS-номер <http://ru.wikipedia.org/wiki/%D0%A0%D0%B5%D0%B3%D0%B8%D1%81%D1%82%D1%80%D0%B0%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80_CAS> : 7782-50-5 <http://www.chemnet.com/cas/supplier.cgi?exact=dict&terms=7782-50-5> ) при нормальных условиях <http://ru.wikipedia.org/wiki/%D0%9D%D0%BE%D1%80%D0%BC%D0%B0%D0%BB%D1%8C%D0%BD%D1%8B%D0%B5_%D1%83%D1%81%D0%BB%D0%BE%D0%B2%D0%B8%D1%8F> — ядовитый <http://ru.wikipedia.org/wiki/%D0%AF%D0%B4> газ <http://ru.wikipedia.org/wiki/%D0%93%D0%B0%D0%B7> желтовато-зелёного цвета <http://ru.wikipedia.org/wiki/%D0%A6%D0%B2%D0%B5%D1%82> , тяжелее воздуха, с резкимзапахом <http://ru.wikipedia.org/wiki/%D0%97%D0%B0%D0%BF%D0%B0%D1%85> . Молекула <http://ru.wikipedia.org/wiki/%D0%9C%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D0%B0> хлора двухатомная (формула Cl2)
Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений, активируя окислительное фосфорилирование. Он необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами, стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием энергии. Xлор положительно влияет на поглощение корнями кислорода, соединений калия, кальция, магния. Чрезмерная концентрация ионов хлора в растениях может иметь и отрицательную сторону, например, снижать содержание хлорофилла, уменьшать активность фотосинтеза, задерживать рост и развитие растений.
Учитывая связь хлора и натрия, следует отметить, что поступление в организм этих элементов тесно взаимосвязано. У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Именно этим объясняется его совместное участие с ионами натрия и калия в создании постоянного осмотического давления и регуляции водно-солевого обмена.
Под воздействием ГАМК (нейромедиатор) ионы хлора оказывают тормозящий эффект на нейроны путем снижения потенциала действия. В желудке ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока. Хлорные каналы представлены во многих типах клеток, митохондриальных мембранах и скелетных мышцах. Эти каналы выполняют важные функции в регуляции объема жидкости, трансэпителиальном транспорте ионов и стабилизации мембранных потенциалов, участвуют в поддержании рН клеток.
В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований.
.1 Медико-биологическая роль соединений хлора
Соединения хлора используются в приготовлении пищи (NaCl), для обеззараживания питьевой воды (хлорирование), дезинфекции, отбеливании тканей, в качестве реагента для многих химических процессов (HCl, HClO4), а также широко используются в химической и целлюлозно-бумажной промышленности при производстве органических растворителей и полимеров.
Хлор применяется для производства гербицидов, пестицидов и инсектицидов.
Хлор элемент входит в состав желудочного сока, препаратов для лечения ряда желудочно-кишечных заболеваний. В медицине широко используются бактерицидные свойства хлорсодержащих препаратов.
3. Общая характеристика брома
Бром (от др.-греч. <http://ru.wikipedia.org/wiki/%D0%94%D1%80%D0%B5%D0%B2%D0%BD%D0%B5%D0%B3%D1%80%D0%B5%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> βρῶμος «вонючка», «вонючий») — элемент <http://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82> 17-й группы периодической таблицы химических элементов <http://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2> (поустаревшей классификации <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%80%D0%BE%D1%82%D0%BA%D0%B0%D1%8F_%D1%84%D0%BE%D1%80%D0%BC%D0%B0_%D0%BF%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D1%8B_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2> — элемент главной подгруппы VII группы), четвёртого периода, с атомным номером <http://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80> 35[3] <http://ru.wikipedia.org/wiki/%D0%91%D1%80%D0%BE%D0%BC> . Обозначается символом Br (лат. <http://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D1%82%D0%B8%D0%BD%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> Bromum).
Химически активный неметалл <http://ru.wikipedia.org/wiki/%D0%9D%D0%B5%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB> , относится к группе галогенов <http://ru.wikipedia.org/wiki/%D0%93%D0%B0%D0%BB%D0%BE%D0%B3%D0%B5%D0%BD%D1%8B> . Простое вещество <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%81%D1%82%D0%BE%D0%B5_%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE> бром (CAS-номер <http://ru.wikipedia.org/wiki/%D0%A0%D0%B5%D0%B3%D0%B8%D1%81%D1%82%D1%80%D0%B0%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80_CAS> : 7726-95-6 <http://www.chemnet.com/cas/supplier.cgi?exact=dict&terms=7726-95-6> ) при нормальных условиях <http://ru.wikipedia.org/wiki/%D0%9D%D0%BE%D1%80%D0%BC%D0%B0%D0%BB%D1%8C%D0%BD%D1%8B%D0%B5_%D1%83%D1%81%D0%BB%D0%BE%D0%B2%D0%B8%D1%8F> — тяжёлая едкая жидкость <http://ru.wikipedia.org/wiki/%D0%96%D0%B8%D0%B4%D0%BA%D0%BE%D1%81%D1%82%D1%8C> красно-бурого цвета <http://ru.wikipedia.org/wiki/%D0%A6%D0%B2%D0%B5%D1%82> с сильным неприятным запахом <http://ru.wikipedia.org/wiki/%D0%97%D0%B0%D0%BF%D0%B0%D1%85> . Молекула <http://ru.wikipedia.org/wiki/%D0%9C%D0%BE%D0%BB%D0%B5%D0%BA%D1%83%D0%BB%D0%B0> брома двухатомна (формула Br2)
.1 Медико-биологическая роль брома
Многие аспекты биологической роли брома в настоящее время еще не выяснены. Бром является незаменимым микроэлементом, который оказывает благоприятное воздействие на здоровье человека. Благодаря брому начинает лучше функционировать центральная нервная система, щитовидная железа, а также регулируется половая сфера.
В человеческом организме бром очень широко распространен. Он содержится в гипофизе, почках, щитовидной железе, в мышечной и костной ткани, а также в крови. В общей сложности в органах и тканях человека содержится приблизительно 200-300 миллиграммов брома. Выводится данный микроэлемент из организма естественным путем — вместе с потом и мочой.
В человеческом организме бром выполняет множество полезных функций — они принимает участие в активации пепсина, способствует активизации липазов, амилазов, а также некоторых других ферментов; улучшает деятельность щитовидной железы и предотвращает возникновение эндемического зоба, а также принимает активное участие в регуляции деятельности центральной нервной системы. Кроме того, на основе брома изготавливают медицинские препараты, которые применяются с целью подавления полового влечения.
Следует иметь в виду, что бром не совместим с йодом, алюминием, хлором и фтором.
В медицине бромид натрия и бромид калия применяют как успокаивающие средства.
Бром концентрируется в железах внутренней секреции, и его недостаток в организме человека ведет к нарушению нормального соотношения между процессами возбуждения и торможения.
Органические соединения брома применяют для ингаляционного наркоза (галотан — 1,1,1-трифтор-2-хлор-2-бромэтан, CF3CHBrCl), в качестве обезболивающих, успокоительных, антигистаминных и антибактериальных препаратов, при лечении язвенных болезней, эпилепсии, сердечно-сосудистых заболеваний. Изотоп брома с атомной массой 82 находит применение в медицине при лечении опухолей и при изучении поведения бромсодержащих препаратов в организме.
4. Общая характеристика йода
Ио́д <http://ru.wikipedia.org/wiki/%D0%99%D0%BE%D0%B4> (тривиальное (общеупотребительное) название <http://ru.wikipedia.org/wiki/%D0%A2%D1%80%D0%B8%D0%B2%D0%B8%D0%B0%D0%BB%D1%8C%D0%BD%D0%BE%D0%B5_%D0%BD%D0%B0%D0%B7%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5> — йод; от др.-греч. <http://ru.wikipedia.org/wiki/%D0%94%D1%80%D0%B5%D0%B2%D0%BD%D0%B5%D0%B3%D1%80%D0%B5%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> ἰώδης — «фиалковый (фиолетовый <http://ru.wikipedia.org/wiki/%D0%A4%D0%B8%D0%BE%D0%BB%D0%B5%D1%82%D0%BE%D0%B2%D1%8B%D0%B9_%D1%86%D0%B2%D0%B5%D1%82> )») — элемент <http://ru.wikipedia.org/wiki/%D0%A5%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82> 17-й группы периодической таблицы химических элементов <http://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2> (по устаревшей классификации <http://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D1%80%D0%BE%D1%82%D0%BA%D0%B0%D1%8F_%D1%84%D0%BE%D1%80%D0%BC%D0%B0_%D0%BF%D0%B5%D1%80%D0%B8%D0%BE%D0%B4%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%BE%D0%B9_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D1%8B_%D1%8D%D0%BB%D0%B5%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2> — элемент главной подгруппы VII группы), пятого периода, с атомным номером <http://ru.wikipedia.org/wiki/%D0%90%D1%82%D0%BE%D0%BC%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80> 53. Обозначается символом I (лат. <http://ru.wikipedia.org/wiki/%D0%9B%D0%B0%D1%82%D0%B8%D0%BD%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> Iodum).
Химически активный неметалл <http://ru.wikipedia.org/wiki/%D0%9D%D0%B5%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB> , относится к группе галогенов <http://ru.wikipedia.org/wiki/%D0%93%D0%B0%D0%BB%D0%BE%D0%B3%D0%B5%D0%BD%D1%8B> .
Простое вещество <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%81%D1%82%D0%BE%D0%B5_%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2%D0%BE> иод (CAS-номер <http://ru.wikipedia.org/wiki/%D0%A0%D0%B5%D0%B3%D0%B8%D1%81%D1%82%D1%80%D0%B0%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D0%B9_%D0%BD%D0%BE%D0%BC%D0%B5%D1%80_CAS> : 7553-56-2 <http://www.chemnet.com/cas/supplier.cgi?exact=dict&terms=7553-56-2> ) при нормальных условиях <http://ru.wikipedia.org/wiki/%D0%9D%D0%BE%D1%80%D0%BC%D0%B0%D0%BB%D1%8C%D0%BD%D1%8B%D0%B5_%D1%83%D1%81%D0%BB%D0%BE%D0%B2%D0%B8%D1%8F> — кристаллы <http://ru.wikipedia.org/wiki/%D0%9A%D1%80%D0%B8%D1%81%D1%82%D0%B0%D0%BB%D0%BB%D1%8B> чёрно-серого цвета <http://ru.wikipedia.org/wiki/%D0%A6%D0%B2%D0%B5%D1%82> с фиолетовым металлическим блеском <http://ru.wikipedia.org/wiki/%D0%91%D0%BB%D0%B5%D1%81%D0%BA> , легко образует фиолетовые пары <http://ru.wikipedia.org/wiki/%D0%9F%D0%B0%D1%80> , обладающие резким запахом <http://ru.wikipedia.org/wiki/%D0%97%D0%B0%D0%BF%D0%B0%D1%85> . Молекула вещества двухатомна (формула I2).
.1 Медико-биологическая роль йода
Основная биологическая функция йода состоит в поддержании функции щитовидной железы и построении ею гормона — тироксина. Йод пока является единственным известным микроэлементом, участвующим в образовании гормона.Физиологическая роль тироксина, основой образования которого является йод, очень велика: контроль за интенсивностью основного обмена, влияние на водно-солевой, жировой и углеводный обмены. Как гормон, тироксин находится в постоянной связи с другими железами внутренней секреции, особенно с гипофизом и половыми железами. Он активно воздействует на физическое и психическое развитие человека, участвует в регуляции деятельности центральной нервной системы, влияет на эмоциональный тонус человека, на деятельность сердечно-сосудистой системы и печени.В обычных условиях в организме человека содержится 20-50 мг йода. Наибольшая концентрация йода (8 мг из общего количества) содержится в щитовидной железе.Суточная потребность взрослого человека — 50-200 мкг йода (0,05-0,2 мг).
галоген фтор йод хлор
Она полностью обеспечивается при нормальном сбалансированном питании (40-200 мкг) за счет продуктов растительного и животного происхождения. Лишь небольшая часть йода (около 5-10%) поступает с водой.
Наиболее высокое содержание йода в морских водорослях:
в сухой ламинарии — 160-800 мг на 100 г продукта,
в сухой морской капусте — 200-220 мг на 100 г продукта.
В морской рыбе и продуктах моря содержание йода достигает 300-3000 мкг на 100 г продукта.
При длительном хранении продуктов и кулинарной обработке может теряться до 65% йода.
Недостаточность йода широко распространена и носит эндемический характер. Основной причиной является недостаточное содержание йода в окружающей среде, а следовательно и в продуктах питания. Проявляется недостаточность йода увеличением щитовидной железы (эндемический зоб).
В ряде случаев может развиваться гипотиреоз (недостаточность функции щитовидной железы), проявляющийся резким снижением физической и умственной работоспособности, сухостью кожи, выпадением волос, снижением температуры тела, отечностью лица и другими симптомами.
Для профилактики развития зоба в эндемических зонах население использует в питание йодированную соль (25 г йодида калия на 1 тонну соли), что обеспечивает ежедневное поступление в организм человека до 200 мкг йода.
Заключение
Галогены — элементы седьмой группы системы Менделеева. К ним относятся: хлор, фтор, йод, астат, бром. Роль галогенов в организме человека заключается в их уникальном свойстве поддерживать важные химико-биологические обменные процессы (все процессы жизнедеятельности человека).
Фтор содержится во всех человеческих органах и играет важную роль в строении костей, зубов. Бром содержится в почках, печени, крови, мозге. Йод важен для функционирования щитовидной железы. Хлор помогает поддерживать в организме осмотическое давление лимфы и крови, сохраняет баланс воды.
Список литературы
[Электронный ресурс]//URL: https://drprom.ru/referat/biologicheskaya-rol-schelochnyih-metallov-i-galogenov/
Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 211. — 623 с. — 100 000 экз.
Стасиневич Д.С. Иод // Краткая химическая энциклопедия / Отв. ред. И. Л. Кнунянц <http://ru.wikipedia.org/wiki/%D0%9A%D0%BD%D1%83%D0%BD%D1%8F%D0%BD%D1%86,_%D0%98%D0%B2%D0%B0%D0%BD_%D0%9B%D1%8E%D0%B4%D0%B2%D0%B8%D0%B3%D0%BE%D0%B2%D0%B8%D1%87> . — М.: Советская Энциклопедия, 1963. — Т. 2. Ж-Малоновый эфир.
Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 84. Фтор, бром, иод // Неорганическая химия: Учебник для 7-8 классов средней школы. — 18-е изд. — М.: Просвещение <http://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%BE%D1%81%D0%B2%D0%B5%D1%89%D0%B5%D0%BD%D0%B8%D0%B5_(%D0%B8%D0%B7%D0%B4%D0%B0%D1%82%D0%B5%D0%BB%D1%8C%D1%81%D1%82%D0%B2%D0%BE)> , 1987. — С. 197-199. — 240 с. -1 630 000 экз.
