Алюминий является важнейшим металлом, объем его производства намного опережает выпуск всех остальных цветных металлов и уступает только производству стали. Высокие темпы прироста производства алюминия обусловлены его уникальными физико-химическими свойствами, благодаря которым он нашел широкое применение в электротехнике, авиа- и автостроении, транспорте, производстве бытовой техники, строительстве, упаковке пищевых продуктов и пр.
Алюминиевая промышленность России, созданная в советское время, занимает доминирующее положение в производстве цветных металлов в стране и по выпуску металла находится на втором месте в мире. В последние годы, в силу известных причин, техника для производства алюминия практически не модернизируется, технология электролиза не совершенствуется, объем научных исследований недопустимо сокращен и заметно отстает от передовых стран. В то же время за рубежом широко ведется модернизация оборудования, совершенствуется технология, что позволило резко поднять экономическую эффективность и экологическую безопасность производства алюминия.
В последнее время машиностроение во все большей мере требует легких металлов, особенно в авиастроении, железнодорожном транспорте. Поэтому развитие новых и более экономичных методов получения алюминия и усовершенствование уже существующих методов имеет большое значение.
В настоящее время по объему производства алюминий занимает первое место среди цветных металлов, и производство его постоянно расширяется.
Исторически первое упоминание о металлическом алюминии имело место в трудах First Century Roman. В знаменитой энциклопедии «Historia naturalis» можно найти следующую историю. Однажды римскому ювелиру было позволено показать императору Тибериусу обеденную тарелку из нового металла. Тарелка была очень светлой и блестела, как серебро. Ювелир рассказал императору, что он добыл металл из обыкновенной глины. Он также заверил императора, что только он и боги знают, как получить металл из глины. Император очень заинтересовался. Однако он сразу понял, что вся его казна, состоящая из золота и серебра придет в упадок, если люди начнут производить этот светлый металл из глины. Поэтому, вместо ожидаемого ювелиром вознаграждения, он был обезглавлен.
Неизвестно, насколько правдива эта история, но описанные события происходили за 2000 лет до открытия человечеством способа производства алюминия. Это произошло в 1825 г., когда датский физик Г. Эрстед получил несколько миллиграммов металлического алюминия термическим восстановлением хлорида алюминия калиевой амальгамой.
Производство металлов и их сплавов
... и легко поддающейся восстановлению. Ее пустая порода обычно состоит из глины. Магнитный железняк, Шпатовый железняк Для производства чугуна, кроме железных руд, требуются и другие материалы. К ... которые технически возможно и экономически целесообразно перерабатывать для извлечения содержащихся в них металлов. К железным рудам Эти руды содержат значительное количество рудного вещества или соединений ...
Немалые трудности в получении алюминия возникли вследствие следующих факторов:
- большое сродство алюминия к кислороду. Алюминий может быть восстановлен углеродом из оксида при температуре около 2000°С. Однако уже при 1200°С углерод взаимодействует с алюминием, давая карбид;
- высокий электрохимический потенциал алюминия (-1,67В).
Из водных растворов получить алюминий невозможно, так как на катоде практически будет идти процесс выделения водорода (разложения воды);
- высокая температура плавления глинозема (2050°С), что исключает возможность проведения электролиза расплавленного глинозема.
Промышленное производство алюминия связано с именем француза Анри Сент-Клер Девиля. Ему хорошо были известны эксперименты Г. Эрстеда и другого ученого – Ф. Велера, которому в 1827 г. удалось выделить крупинки алюминия. Причиной неудачи Ф. Велера было то, что эти крупинки на воздухе немедленно покрывались тончайшей пленкой оксида алюминия.
Прежде всего, А.С.-К. Девиль в процессе получения металла заменяет калий более дешевым натрием и проводит лабораторные опыты в крупном масштабе. Полученный хлорид алюминия загружался в большую стальную трубу, в которой на равном расстоянии друг от друга были расставлены сосуды, наполненные металлическим натрием. При нагреве происходило взаимодействие хлорида алюминия с натрием в газовой фазе и частицы алюминия оседали на дно трубы. Образованные в результате реакции зернышки тщательно собирали, плавили и получали слитки металла.
Новый способ производства алюминия оказался очень трудоемким. Кроме того, взаимодействие паров хлорида алюминия с натрием нередко протекает со взрывом. В лабораторных условиях это не представляло серьезной опасности, а в заводских условиях могло вызвать катастрофу. А.С.-К. Девиль заменил хлорид алюминия смесью А1С1 3 с NaCl. Теперь участники реакции находились в расплавленном состоянии. Взрывы прекратились, но, что самое главное, вместо небольших корольков металла, которые надо было собирать вручную, получали значительное количество жидкого алюминия.
Опыты на заводе Жавеля увенчались успехом. В 1855 г. был получен первый слиток металла массой 6 – 8 кг.
Эстафету производства алюминия химическим способам продолжил русский ученый Н. Н. Бекетов. Он проводил реакцию взаимодействия между криолитом (Na 3 AlF6 ) и магнием. Способ Н. Н. Бекетова мало чем отличался от метода А.С.-К. Девиля, но был проще. В немецком городе Гмелингеме в 1885 г. был построен завод, использующий способ Н. Н. Бекетова, где за пять лет было получено 58 т алюминия – более четверти всего мирового производства металла химическим путем в период с 1854 по 1890 г.
Получение алюминия химическим способом не могло обеспечить промышленность дешевым металлом. Он был малопроизводителен и не давал чистый без примесей алюминий. Это заставило исследователей разных стран мира искать новые способы производства алюминия.
На помощь ученым пришел электрический ток. Еще в 1808 г. Г. Дэви пытался разложить глинозем с помощью мощной электрической батареи, но безуспешно. Спустя почти 50 лет Р. Бунзен и А.С.-К. Девиль независимо друг от друга провели электролиз смеси хлоридов алюминия и натрия. Они были удачливее своего предшественника и сумели получить маленькие капельки алюминия. Однако в те времена не было еще дешевых и достаточно мощных источников электроэнергии. Поэтому электролиз алюминия имел только чисто теоретический интерес.
Алюминий магний и титан металлы будущего
... 13 раз меньше теплопроводности алюминия и в 4 раза - железа. Недостатки титана: высокая стоимость производства, титан значительно дороже железа, алюминия, меди, магния; активное взаимодействие при высоких ... titan-metallyi-buduschego/ Фрагмент справочника "Металлы и сплавы - марки и химический состав" 2. "Металловедение и термическая обработка цветных металлов и сплавов" Б.А. Колачев, В.А. Ливанов, ...
В 1867 г. была изобретена динамо-машина, а вскоре электроэнергию научились передавать на большие расстояния. Электричество начало вторгаться в промышленность.
В 1886 г. П. Эру во Франции и Ч. Холл в США почти одновременно положили начало современному способу производства алюминия, предложив получать его электролизом глинозема, растворенного в расплавленном криолите (способ Холла – Эру).
С этого момента новый способ производства алюминия начинает быстро развиваться, чему способствовали усовершенствование электротехники, а также разработка способов извлечения глинозема из алюминиевых руд. Значительный вклад в развитие производства глинозема внесли русские ученые К. И. Байер, Д. А. Пеняков, А. Н. Кузнецов, Е. И. Жуковский, А. А. Яковкин и др. В царской России не существовало собственной алюминиевой промышленности. Однако первые теоретические исследования в области электролиза алюминия принадлежали выдающемуся русскому ученому, основоположнику электрометаллургии цветных металлов в нашей стране проф. П. П. Федотьеву. В 1912 г. им совместно с В.П. Ильинским был опубликован труд «Экспериментальные; исследования по электрометаллургии алюминия», который был сразу переведен на многие иностранные языки и стал настольной книгой для металлургов всего мира. П.П. Федотьев и Ильинский в Петербургском политехническом институте (С. Петербургский государственный технический университет) провели тщательные исследования по выбору оптимального состава электролита, а также выяснили, как влияют на растворимость глинозема в криолите и температуру кристаллизации добавки фторидов натрия, алюминия и кальция.
28 марта 1929 г. в газете «Ленинградская правда» была опубликована заметка, в которой сообщалось о том, что на опытной установке завода «Красный выборжец» впервые получено из одной ванны 8 кг металлического алюминия. Это положило начало нашей алюминиевой промышленности.
В 1931г. был организован научно-исследовательский институт алюминиево-магниевой промышленности (ВАМИ), в 1932г. пущен Волховский, а в 1933г. – Днепровский алюминиевые заводы. С тех пор алюминиевая промышленность стала бурно развиваться в различных районах страны.
Электролиз криолитоглиноземных расплавов является основным способом получения алюминия, хотя некоторое количество алюминиевых сплавов получается электротермическим способом.
Первые промышленные электролизеры были на силу тока до 0,6 кА и за последующие 100 лет она возросла до 300 кА. Тем не менее, это не внесло существенных изменений в основы производственного процесса.
Общая схема производства алюминия представлена на рис. 2.1. Основным агрегатом является электролизер. Электролит представляет собой расплав криолита с небольшим избытком фторида алюминия, в котором растворен глинозем. Процесс ведут при переменных концентрациях глинозема приблизительно от 1 до 8 % (масс.).
Сверху в ванну опущен угольный анод, частично погруженный в электролит. Существуют два основных типа расходуемых анодов: самообжигающиеся и предварительно обожженные. Первые используют тепло электролиза для обжига анодной массы, состоящей из смеси кокса-наполнителя и связующего – пека. Обожженные аноды представляют собой предварительно обожженную смесь кокса и пекового связующего. Подробно технология производства анодной массы и обожженных анодов описана в литературе(см., например, [3, 4]).
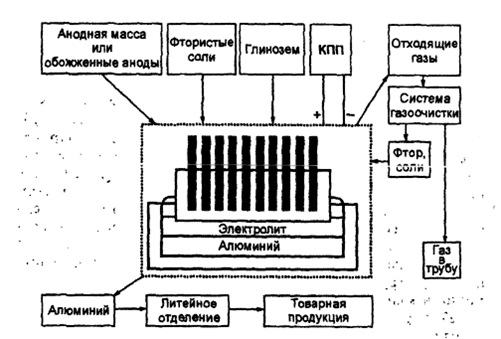
Рис. 2.1. Схема производства алюминия из глинозема.
Расплавленный алюминий при температуре электролиза (950–960°С) тяжелее электролита и находится на подине электролизера. Криолитоглиноземные расплавы – очень агрессивны, противостоять которым могут углеродистые и некоторые новые материалы. Из них и выполняется внутренняя футеровка электролизера.
Для преобразования переменного тока в постоянный на современных заводах применяются полупроводниковые выпрямители с напряжением 850В и коэффициентом преобразования 98,5%, установленные в кремниевой преобразовательной подстанции (КПП).
Один выпрямительный агрегат дает ток силой до 63 кА. Число таких агрегатов зависит от необходимой силы тока, так как все они включены параллельно.
Процесс, протекающий в электролизере, состоит в электролитическом разложении глинозема, растворенного в электролите. На жидком алюминиевом катоде выделяется алюминий, который периодически выливается с помощью вакуум-ковша и направляется в литейное отделение на разливку или миксер, где в зависимости от дальнейшего назначения металла готовятся сплавы с кремнием, магнием, марганцем, медью или проводится рафинирование. На аноде происходит окисление выделяющимся кислородом углерода. Отходящий анодный газ представляет собой смесь СО 2 и СО.
Электролизеры обычно снабжены укрытиями, отводящими отходящие газы, и системой очистки. Это снижает выделение вредных веществ в атмосферу. Технологический процесс требует, чтобы укрытие было герметично для обеспечения отсоса газа в коллектор с помощью вентиляторов. В удаляемых газах от электролизеров преобладают диоксид углерода (большая часть оксида углерода дожигается либо над электролитом, либо в специальных горелках после газосборного колокола), азот, кислород, газообразные и твердые фториды и частицы глиноземной пыли. Для их удаления и возвращения в процесс применяются различные технологические схемы.
Современные электролизеры оборудованы системой автоматического питания глиноземом (АПГ) с периодом загрузки 10–30 мин.
Суммарная реакция, происходящая в электролизере, может быть представлена уравнением
![]()
Таким образом, теоретически на процесс электролиза расходуются глинозем и углерод анода, а также электроэнергия, необходимая не только для осуществления электролитического процесса – разложения глинозема, но и для поддержания высокой рабочей температуры. Практически расходуется и некоторое количество фтористых солей, которые испаряются и впитываются в футеровку. Для получения 1 т алюминия необходимо:
| глинозема, кг | 1925 – 1930 |
| углерода анода, кг | 500 – 600 |
| фтористых солей, кг | 50 – 70 |
| электроэнергии (в переменном токе), кВт-ч | 14500 – 17500 |
Производство алюминия является одним из самых энергоемких процессов, поэтому алюминиевые заводы строят вблизи источников энергии.
Все материалы, поступающие на электролиз, должны иметь минимальное количество примесей более электроположительных, чем алюминий (железо, кремний, медь и др.), так как эти примеси при электролизе практически полностью переходят в металл.
Промышленный способ получения алюминия электролизом криолитоглиноземных расплавов, несмотря на длительное его применение, имеет ряд существенных недостатков: высокий удельный расход электроэнергии, низкие удельный съем металла и срок службы электролизеров, большие трудовые и капитальные затраты, выделение вредных веществ в атмосферу и ряд других. В связи с этим предлагаются другие способы получения алюминия. Рассмотрим некоторые из них.
3.1. Электротермическое получение алюминиево-кремниевых сплавов.
Получить чистый алюминий непосредственным восстановлением его оксида невозможно [5].
Карботермические процессы требуют высоких температур (около 2000°С) для восстановления глинозема и при отсутствии сплавообразующих компонентов металл связывается с углеродом, давая карбид алюминия (А1 4 С3 ).
Известно, что карбид алюминия и алюминий растворимы друг в друге и образуют весьма тугоплавкие смеси. Кроме того, А14 С3 растворяется в А12 О3 , поэтому врезультате восстановления оксида алюминия углеродом получаются смеси алюминия, карбида и оксида, имеющие высокие температуры плавления. Выпустить такую массу из печи обычно не представляется возможным. Даже если это и удается сделать, потребуются большие затраты на разделение.
В нашей стране впервые в мире разработан и осуществлен в промышленном масштабе с достаточно высокими технико-экономическими показателями способ получения силикоалюминия (алюминиево-кремниевых сплавов).
Общая технологическая схема производства алюминиево-кремниевых сплавов представлена на рис. 3.1. В качестве исходного сырья, кроме каолинов (Al 2 O3 ×2SiO2 ×2H2 O), могут быть использованы кианиты (Al2 O3 ×SiO2 ), дистенсиллиманиты (Al2 O3 ×SiO2 ) и низкожелезистые бокситы.
Сплав после электроплавки поступает на очистку от неметаллических примесей. Для этого подают флюс, состоящий из смеси криолита и хлорида натрия, который смачивает эти примеси и «собирает» их. Рафинированный силикоалюминий имеет средний состав (%): А1 – 61; Si – 36; Fe – 1,7; Ti – 0,6; Zr – 0,5; Ca – 0,7. Этот сплав не годится для производства силумина и требует очистки от железа. Наиболее распространен способ очистки марганцем, который образует с железом тугоплавкие интерметаллиды.
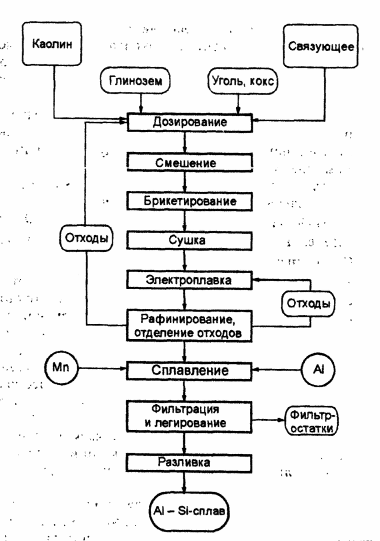
Рис. 3.1. Общая схема производства алюминиево-кремниевых сплавов.
Полученный сплав разбавляют техническим электролитическим алюминием или вторичным алюминием до состава, отвечающего различным сортам силуминов, и разливают в слитки.
Преимущества такого способа получения силумина перед сплавлением электролитического алюминия с кристаллическим кремнием состоят в следующем: большая мощность единичного агрегата – современные печи имеют мощность 22,5 MB×A, что примерно в 30 раз выше мощности электролизера на 160 кА, а, следовательно, уменьшение грузопотоков, снижение капитальных затрат и затрат труда; применение сырья с низким кремниевым модулем, запасы которого в природе достаточно велики.
Теоретически из алюминиево-кремниевого сплава можно выделить различными приемами чистый алюминий. Однако из-за сложности аппаратурного и технологического оформления в промышленности эти способы в настоящее время не реализуются.
3.2. Субгалогенидный процесс
Известно, что если нагреть смесь галогенида и загрязненного алюминия, то при понижении температуры выделяется чистый алюминий. Это открытие вызвало интерес к системам алюминий – галогенид алюминия. Было определено, что металлический алюминий реагирует с А1Х 3 (где X – галоген) при высокой температуре, образуя субгалогенид алюминия:
![]()
Поскольку субгалогенид алюминия является газообразным продуктом, равновесие смещается влево при понижении температуры. Например, А1С1(Г) можно получить из А1 и А1С1 3 в реакционной зоне при относительно высоких температурах, а затем перенести в парообразном состоянии в более холодную зону, где он диспропорционирует на чистый алюминий и хлорид алюминия. Константа равновесия для системы А1 – А1С13 выше, чем для системы А1 — A1F3 , и поэтому хлоридная система может быть использована для промышленных процессов. Температура образования субхлорида около 1300°С при атмосферном давлении. Этот процесс особенно привлекателен для выделения алюминия из сплавов, так как галогенид алюминия взаимодействует с алюминием и практически не взаимодействует с большинством других металлов. Трудности возникают только с некоторыми летучими галогенидамн, такими как FeCl3 , МпС12 , и некоторыми другими. Они могут образовывать смеси с А1С13 и загрязнять получаемый алюминий.
Фирмой «Alcan» разработана технология, включающая пять стадий:
1. Производство сырого сплава, например железо-кремниево-алюминиевого, в печи карботермическим восстановлением.
2. Взаимодействие между А1 и AJC1, в конвертере при температуре 1300 °С.
3. Разделение парообразных галогенидов и субгалогенида в ректификационных колоннах.
4. Возврат AICI, для реакции между хлоридом и жидким сплавом, богатым алюминием.
5. Разложение А1С1, получение алюминия и возврат А1С1 3 на ректификацию.
Субхлоридный метод представляет наибольший интерес для промышленного рафинирования алюминиевых сплавов.
3.3. Тот-процесс
Схема получения алюминия по способу Тота представлена на рис. 3.2. Алюминийсодержащее сырье после соответствующей подготовки хлорируют в кипящем слое в присутствии кокса и SiCl 4 . Последний используется для подавления реакции хлорирования SiO2 . В результате хлорирования в печах кипящего слоя (КС) получается парогазовая смесь (ПГС), в состав которой входят А1С13 , FeCl3 , TiCl4 и SiCl4 . В первом конденсаторе из ПГС выделяется около 75 % FeCl3 в твердом состоянии и направляется в реактор-окислитель, где взаимодействует с кислородом воздуха, в результате чего образуются Fe2 O3 и С12 . Хлор возвращается на хлорирование. Во втором конденсаторе выделяется оставшийся FeCl3 и происходит конденсация А1С13 . Хлориды титана и кремния конденсируются в третьем конденсаторе. Разделение этих хлоридов осуществляется в ректификационной колонне.
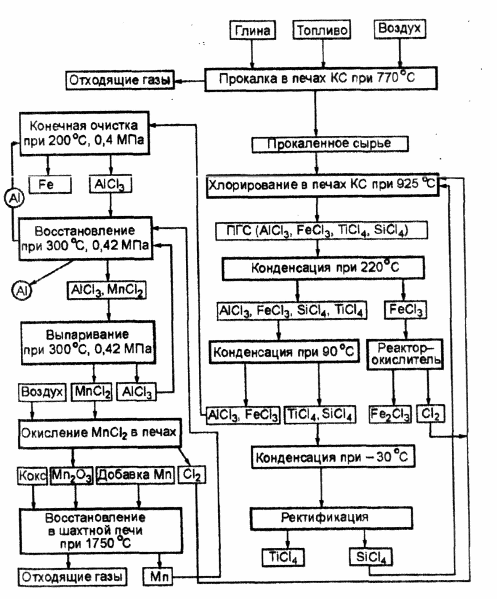
Рис. 3.2. Схема получения алюминия по методу Тота.
Хлориды алюминия и железа, выгруженные из второго конденсатора, нагреваются, перекачиваются в контактный очиститель, где контактируют в противотоке с подвижным слоем твердых частиц алюминия. При этом идет реакция:
![]()
Очищенный хлорид алюминия поступает на металлотермическое восстановление. Технически доступными восстановителями, имеющими большее сродство к хлору, чем алюминий, являются натрий, магний и марганец. Однако первые два элемента дороги и их производство весьма энергоемко. Поэтому, по мнению разработчиков процесса, определенные преимущества имеет использование марганца, который можно регенерировать из хлорида карботермическим методом со значительно меньшими энергозатратами. При восстановлении хлорида алюминия марганцем протекают реакции:
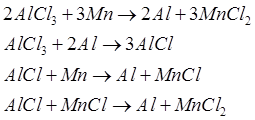
Алюминий из смеси МпС1 2 с непрореагировавшим А1С13 , выделяется в циклонных сепараторах, а хлориды марганца и алюминия разделяются в выпарном аппарате. Хлорид алюминия возвращается в реактор для получения алюминия, а хлорид марганца взаимодействует с кислородом с образованием твердых оксидов марганца и хлора. Оксид марганца восстанавливается до металла карботермическим методом в шахтных печах, куда загружают кокс и известняк. Марганец в печь добавляется для восполнения потерь его в ходе процесса.
К недостаткам данного процесса, как и других металлотермических методов, относятся загрязнение получаемого продукта металлом-восстановителем, необходимость организации производства по регенерации восстановителя и увлечение капитальных затрат.
Исследовательские работы по получению алюминия путем восстановления марганцем в лабораторном и укрупненном масштабах были выполнены в 1966 – 1973гг. В последующем в литературе не было сообщений о промышленном развитии данного направления, что, видимо, обусловлено значительными трудностями по технической реализации этого сложного многоэтапного процесса.
3.4. Электролиз хлоридных расплавов
В январе 1973 г. фирма «Alcoa» заявила о разработке нового способа получения алюминия. Фирма работала над процессом 15 лет и затратила 23 млн. долларов.
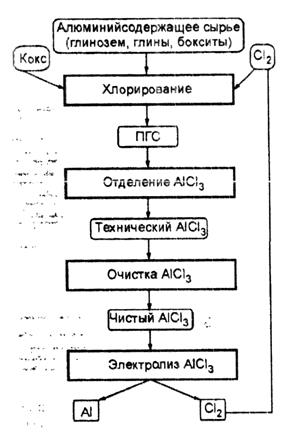
Данный способ предусматривает получение хлорида алюминия и последующий его электролиз. В 1976 г. появились сообщения о переходе фирмы «Alcoa» к промышленному внедрению хлоридной технологии получения алюминия. В г. Палестина (Техас, США) работал завод с проектной мощностью 30 тыс. т выпуска алюминия в год этим способом.
Принципиальная технологическая схема представлена на рис. 2.4.
 электролиз хлоридных расплавов 1">
электролиз хлоридных расплавов 1">
Рис. 3.3. Технологическая схема получения алюминия из хлорида.
Хлорид алюминия имеет высокое сродство к воде и тенденцию к образованию оксидов и гидрооксихлоридов. В связи с этим получение его в чистом виде является трудной задачей. Присутствие влаги вызывает коррозию, а присутствие кислородсодержащих соединений приводит к выделению осадков и окислению анодов. Фирмой «Alcoa» предложено хлорирование очищенного глинозема, что частично решает названные проблемы. Тем не менее, необходимо соблюдать повышенные требования к чистоте углерода при хлорировании в отношении водорода или влаги.
В последнее время появились сообщения, что фирме «Toth Aluminium Corporation» удалось получить в крупнопромышленном масштабе хлорид алюминия, содержащий не менее 99,97% основного компонента.
Полученный хлорид алюминия в гранулированном или парообразном состоянии поступает на электролиз. Электролизер, используемый в данной технологии, состоит из стального кожуха, футерованного шамотным и в нижней части дополнительно диатомовым кирпичом, т.е. теплоизоляционным непроводящим огнеупорным материалом, который слабо взаимодействует с хлоридными расплавами. На дне ванны расположен графитовый отсек для сбора жидкого алюминия. На крышке электролизера имеются отверстия для загрузки хлорида алюминия, периодического отсоса алюминия и непрерывного вывода газообразного хлора, используемого в производстве хлорида алюминия. Боковые стенки и крышка электролизера – водоохлаждаемые.
При электролизе используются графитовые нерасходуемые электроды. Это преимущество (по сравнению с электролизом криолитоглиноземных расплавов) вместе с относительно низкой температурой процесса (около 700ºС) дает возможность полной герметизации электролизеров.
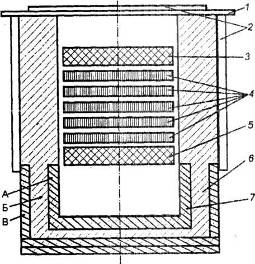
Рис. 2.5. Схема электролизера с биполярными электродами для электролиза хлорида алюминия.
1 – крышка: 2 – водяное охлаждение: 3 – анод; 4 – биполярные электроды; 5 – катод; 6 – футеровка; 7 – отсек для сбора алюминия. Материал: А – графит; Б – шамот; В – диатом.
Электролитическое разложение хлорида алюминия теоретически требуют более высокого напряжения, чем электролиз криолитоглиноземных расплавов, так как напряжение разложения хлорида алюминия много больше. Таким образом, к недостаткам процесса можно было бы отнести необходимость подвода в электролизер большого количества тепла и значительные потери напряжения. Однако высокие омические и тепловые потери значительно снижаются при использовании системы биполярных электродов. В электролизере верхний электрод является анодом, нижний – катодом, а между ними располагаются графитовые электроды, верхняя часть которых является катодом, а нижняя – анодом. В то же время результаты расчетов показывают, что с ростом числа биполярных электродов и снижением площади их сечения возрастают токи утечки, т.е. часть тока протекает по пропитанной электролитом части футеровки и каналам между футеровкой и биполями, не совершая электрохимическую работу. Эти токи утечки приводят к снижению выхода по току.
Вследствие близости температур плавления и кипения при атмосферном давлении хлорид алюминия возгоняется практически не плавясь. Температура сублимации составляет 180,2°С. Тройная точка соответствует температуре 192,6°С и абсолютному давлению 0,23 МПа. В связи с этим в качестве электролита используется расплавленная смесь хлорида алюминия (5 ± 2 % (масс.)), хлорида лития (~28% (масс.)) и хлорида натрия (67% (масс.)).
В указанных расплавах снижается активность А1С1 3 . Это в значительной степени обусловлено тем, что в расплавленных смесях хлоридов А1С13 связывается в комплексные анионы, например ![]() .
.
Междуполюсное расстояние составляет 1,0 – 1,5 см, температура – 700 ± 30ºС, плотность тока –0,8 – 2,5 А/см 2 .
Основные прогнозируемые и подтвержденные при промышленном внедрении в США преимущества предложенного фирмой «Alcoa» способа производства алюминия электролизом его хлорида по сравнению с электролизом криолитоглиноземных расплавов заключаются в возможности использования низкокачественного алюминийсодержащего сырья, снижении примерно на 30 % удельного расхода электроэнергии при электролизе, исключении расхода высококачественных углеродсодержащих электродных материалов, применении менее дефицитных и агрессивных хлоридов вместо фторидов, повышении производительности труда, снижении капитальных вложений, приведенных затрат, стоимости конечной продукции и вредных выбросов в окружающую среду.
В последнее время преимущества хлоридного способа получения алюминия становятся более ощутимыми в связи с удорожанием электроэнергии, исходных материалов для существующего промышленного способа производства алюминия, повышением требований к охране окружающей среды и отсутствием до сих пор положительных результатов по получению чистого глинозема из низкокачественного небокситового сырья.
Таким образом, наиболее перспективным из альтернативных способов получения алюминия является электролиз хлорида алюминия в электролизерах с биполярными электродами.
1. Розен Б. М., Розен Я. Б. Металл особой ценности. – М.: Металлургия, 1975. – 128 с.
2. Колодин Э. А., Свердлин В. А., Свобода Р. В. Производство обожженных анодов алюминиевых электролизеров. – М.: Металлургия, 1980, – 84 с.
3. Янхо Э. А., Воробьев Д. Н. Производство анодной массы. – М.: Металлургия, 1975. – 128 с.
4. Веткжов М. М., Цьшлаков А. М., Школьников С. Н. Электрометаллургия алюминия и магния. – М.: Металлургия, 1987. – 320 с.
5. Щенков В.В., Литвак СН. Разработка новых технологических процессов получения алюминия // Цв. металлургия: Бюл. НТИ / Цветметинформация. – 1974. – № 9. – С. 38 – 41.
6. Сандлер Р. А., Рапир А. Х Электрометаллургия алюминия и магния. – Л,: ЛГИ, 1983. – 94 с.
