Актуальность. Объектом исследования я выбрала основания и кислоты.
В химии, как и в жизни, нет однозначного понимания того или иного термина, все очень относительно. В моем реферате речь пойдет о понятиях кислоты и основания. Мы рассмотрим их в трех различных теориях. То, что верно с точки зрения одной теории, не совсем верно с точки зрения другой. В школьном курсе кислоты и основания рассматриваются только в одной теории, а мой реферат поможет расширить представления о них, позволит объяснить механизмы образования связей и покажет, какие противоречия существуют между этими теориями.
Объект исследования: неоднозначные понятия кислоты и основания.
Предмет исследования: понятия кислоты и основания с точки зрения теорий Аррениуса-Менделеева, Бренстеда, Льюиса.
Цель: Рассмотреть кислоты и основания с точки зрения трех различных теорий.
Задачи:
Изучить кислоты и основания в целом, их историю, классификацию и применение.
Рассмотреть кислоты и основания с точки зрения теории С. Аррениуса и теории Менделеева, протолитической теории И. Бренстеда, электронной теории Льюиса, объяснить следствия из этих теорий, изучить их недостатки.
Сравнить эти теории; основываясь на их недостатках и достоинствах, создать сравнительную таблицу.
1 глава. Общая информация о кислотах и основаниях
История кислот корнями уходит в далекое прошлое. Первой кислотой, которую человек получил, является уксусная (CH2OOH), потому что она образовывается при скисании вин. А само слово кислота — acidum (лат.), вероятно, происходит от слова уксус — acetum.
Затем в Х веке люди обнаружили серную кислоту (H2SO4) при прокаливании сульфатов (купоросов).
«Изучение купороса началось в древние времена. Некоторые из ранних обсуждений происхождения и свойств купороса можно найти в работах греческого врача Диоскорида (первый век н. э.) и римского натуралиста Плиния Старшего (23–79 н. э.).
Гален также обсуждал его медицинское использование. Использование купоросных веществ в металлургии описано в древнегреческих алхимических работах Зосимы из Панополиса, в тезисе «Phisica et Mystica» и папирусе «X» Лейдена.
Реферат кислоты основания соли оксиды
... = NaNO + HO Cu(OH) + 2HCl = CuCl + 2HO 4. Амфотерные оксиды и гидроксиды Основания реагируют с кислотами и наоборот. Всегда получается соль и вода. Ca(OH) + 2HCl = CaCl + 2HO HCO + 2NaOH ... по всем этим темам ( с параграфа 29-38 ) и классификация неорганических веществ и их реакций: Ответы на некоторые вопросы после параграфов: Какие вещества называют оксидами? Оксиды – это сложные ...
Исламские Джабир ибн Хайян (721-815 гг. н. э.), Рази (865-925 гг. н. э.) и Джамал Дин аль-Ватват (1318 г., написал книгу «Mabahij al-fikar wa-manahij al-‘ibar»), включили купорос в свои списки классификации минералов. Ибн Сина фокусировался на медицинском применении и разновидностях купороса.»1
Серную кислоту средневековые алхимики назвали купоросным маслом (это название упоминается в работах Винсента из Бове2 и в сочинении «Compositum de Compositis» Альберта Великого).
В XII веке химик Иоганну Глауберу3 удалось получить серную кислоту в результате сжигания смеси серы и калийной селитры (нитрата калия).
А в 1670 году английский натуралист Джон Рэй4 поместил в сосуд рыжих лесных муравьев, налил воды, вскипятил ее и пропустил через сосуд струю горячего пара, в результате чего получил муравьиную (метановую) кислоту, которая используется рыжими муравьями в качестве «химического оружия» для защиты и нападения.
Кто впервые получил соляную кислоту (HCl), до сих пор неизвестно, но предположительно это были алхимики Василий Валентин5 и Андреас Либавий6. В 1658 г. Иоганн Глаубер нашел новый способ получения соляной кислоты, который до сих пор применяется в лабораториях. В результате нагрева смеси поваренной соли и концентрированной серной кислоты получался дым, который при взаимодействии с водой превращался в соляную кислоту, или соляный спирт, как ее тогда называли.
NaCl + H2SO4(конц.) = NaHSO4 + HCl↑
Английский химик Роберт Бойль7 занимался изучением свойств соляной кислоты и в процессе опытов случайно пролил несколько капель на лепестки фиалок, которые стали ярко-красными. Это событие положило начало ряду опытов, в результате которых появилось понятие индикатор (лат. indicator — указатель) — вещество, позволяющее следить за составом среды или за протеканием химической реакции. Многие химики начали использовать индикаторы для распознавания кислот и оснований.
В начале XVIII века ученик Роберта 8 впервые получил борную кислоту(H3BO3), прокаливая буру с железным купоросом. Он назвал ее успокоительной солью (sal sedativum), а потом она получила название sal sedativum Hombergii.
А шведский химик и фармацевт Карл Шееле9 внес огромный вклад в развитие науки — его работы и открытия охватывают всю химию того времени. В том числе он открыл винную, яблочную, лимонную, молочную, мочевую, молибденовую, вольфрамовую, сероводородную, мышьяковую, плавиковую, синильную, галловую и щавелевую кислоты. Первой в 1769 году он выделил винную — из «винного камня», который содержался на стенках бочек с вином. Он нагрел его с серной кислотой, а после охлаждения обнаружил красные кристаллы — это и была винная кислота. Затем он начал исследовать настои разных растений и открыл другие кислоты. Яблочную (C4H6O4) он получил из незрелых яблок, лимонную (С6H8O7) — из сока неспелых лимонов, галловую (С7H6O5) — в вытяжках из чернильных орешков (галлов), молочную (С3Н6О3) — из кислого молока, мочевую (C5H4N4O8) он обнаружил в составе мочи.
Угольная кислота (H2CO3) была впервые получена Джозефом Пристли10 при растворении углекислого газа в воде и была названа содовой водой, которая почти сразу стала применяться в качестве напитка. За это Пристли был награжден золотой медалью.11 (http://www. critical. ru/calendar/oxigen2.htm, ссылка действительна на 29.03.15)
Химический состав кислот к концу XVIII века ученым был все еще не известен. Только после исследования кислорода и других газов французом Антуаном Лавуазье12 химики решили, что все кислоты содержат кислород, поэтому этот газ и получил такое название — «рождающий кислоты».
В 1786 году французский химик Клод Луи Бертолле13 с помощью химического обнаружил кислоты, которые не содержат кислород — синильную и сероводородную. Чуть позже Г. Дэви14 исследовал соляную и обнаружил там только хлор и .
А первая теория кислот была сформулирована немцем Юстасом Либихом15 в 1838 году. Основное положение этой теории звучит так:
«Кислота — вещество, способное реагировать с металлом с выделением водорода.»
Итак, к середине XIX века ученым уже было известно более 20 кислот, и они научились классифицировать вещества по результатам химического анализа и его химическим свойствам.
В настоящее время кислоты классифицируют по разным признакам.
По наличию атомов кислорода:
|
Кислородсодержащие |
Бескислородные |
|
H2SO4 — серная |
HF — фтороводородная |
|
HNO3 — |
HCl — соляная |
|
H2CO3 — угольная |
H2S — сероводородная |
|
H2SiO3 — кремниевая |
HBr — бромоводородная |
По количеству ионов водорода, образовывающихся в результате диссоциации:
|
Одноосновные |
Двухосновные |
Трехосновные |
|
HCl — соляная |
H2SO4 — серная |
H3PO4 — фосфорная |
|
HNO3 — азотная |
H2CO3 — угольная |
H3PO3 — борная |
|
HF — фтороводородная |
H2SO3 — сернистая |
H3AsO3 — мышьяковистая |
По растворимости в воде:
|
Растворимые |
Нерастворимые |
|
H2SO4 — серная |
H2SiO3 — кремниевая |
|
HNO3 — азотная |
|
|
H3PO4 — фосфорная |
По летучести:
|
Летучие |
Нелетучие |
|
H2S — сероводородная |
H2SiO3 — кремниевая |
|
HNO3 — азотная |
H2SO4 — серная |
|
HCl — соляная |
H3PO4 — фосфорная |
По степени диссоциации:
|
Сильные |
Средние |
Слабые |
|
H2SO4 — cерная |
HF — фтороводородная |
H2CO3 — угольная |
|
HNO3 — азотная |
H2SO3 — сернистая |
H2SiO3 — кремниевая |
|
HCl — соляная |
H3PO4 — фосфорная |
H2S — сероводородная |
В наше время кислоты нашли широкое применение в различных областях. Например, в быту: они нужны для чистки изделий, для готовки, многие из кислот используются в лекарствах — например, аскорбиновая кислота. Кроме того, в нашем организме содержится много кислот, к примеру, соляная способствует активизации пищеварительных ферментов, расщепляет белки.
Люди научились использовать огонь около 100 тысяч лет назад. Скорее всего, первым основанием, о котором узнал человек, был гидроксид кальция — при взаимодействии обожженного мела (карбонат кальция -> оксид кальция) с водой получалась белая кашица, которая в смеси с песком и водой превращалась в плотный камень белого цвета. Около 2000 лет назад люди использовали гидроксид кальция для строительства, в качестве бетона. Впервые название «негашеная известь» встречается в сочинениях Диоскорида, I веком.
А само понятие «основание» сформировалось только в XVII веке благодаря химику Гийому Франсуа Руэлю. Он заметил, что кислоты, известные в те времена как летучие жидкости (например, уксусная или соляная кислоты), превращаются в кристаллические соли только при взаимодействии с определенными веществами. Руэль выдвинул предположение, что эти вещества являются «основаниями» для образования твердых солей. К основаниям он причислил щелочи, «щелочные земли» и металлы. «Щелочными землями» в то время называли оксиды и гидроксиды щелочно-земельных металлов, например, кальция, стронция, бария.
Но сами эти металлы в чистом виде удалось получить только Г. Дэви в начале XIX века с помощью электролиза — нового метода разложения веществ, основанном на действии электрического тока. С помощью этого же метода Дэви смог определить состав щелочей,
в результате чего открыл несколько щелочных металлов — натрий, калий и литий.
Итак, термин «основания» появился в середине XVIII века, и это послужило началом для ряда опытов, в которых использовался электрический ток. В результате этих опытов химики того времени выяснили, что не все растворы проводят электрический ток.
Основания в наше время широко применяются в промышленности и быту. Например, гидроксид кальция Ca(OH)2 (гашёную известь) применяют для изготовления специального средства для борьбы с болезнями растений, а также вредителями, которые поедают листья и корни растений. Также с его помощью можно смягчать воду и нейтрализовать сточные воды. Вещества, получающиеся из этого гидроксида, например, известковое молоко широко используются в , например в производстве сахара, соды и других веществ. Гидроксид натрия NaOH применяют для того, чтобы очищать нефть, в процессе производства мыла, в текстильной промышленности. Гидроксиды калия (KOH) и лития (LiOH) используют в щелочных аккумуляторах. Гидроксид аммония (NH4OH) используется как удобрение, при производстве кормов для животных, а также в производстве соды и красителей. Гидроксид магния (Mg(OH)2) необходим в строительной промышленности и в изготовлении посуды из керамики. Также он используется в некоторых лекарствах.
2 глава. Первая теория кислот и оснований
В 19 веке многие ученые, например М. Фарадей16 и Г. Дэви17, применяя электричество в опытах, пытались связать кислотно-основные свойства веществ с электрическими явлениями. В этой области Фарадей преуспел больше всех – изучая разложение веществ под действием электрического тока, он ввел такие понятия, как электролиз, электрод, катод, , ион и другие, сформулировал законы электролиза. В результате этих исследований ученые выяснили, что молекулы некоторых веществ диссоциируют на положительные и отрицательные ионы под воздействием электрического поля, а эти ионы проводят ток. Этот процесс был назван электролитической диссоциацией.
Но затем ученые обнаружили ионы в растворах еще до включения тока, следовательно, стало ясно, что воздействие электрического поля не является причиной диссоциации.
В 1887 году шведский физико-химик Сванте Аррениус18 обобщил результаты различных исследований и сформулировал новую теорию электролитической диссоциации – электролиты распадаются на ионы в момент их растворения в воде. Его теорию многие ученые, например и П. Клеве19, не признали, потому что она полностью меняла предыдущее представление о кислотах и основаниях. Кислотой он назвал соединение, при диссоциации в водном растворе которого отщепляются ионы водорода. Основанием — соединение, диссоциирующем с отщеплением гидроксид-ионов ОН.
Также он разделил кислоты и основания на сильные и слабые. Разделение зависит от количества ионов, образующихся при диссоциации. Если ионов достаточно много, это сильный электролит, а если мало — слабый. Чтобы характеризовать «силу» диссоциации он ввел такое понятие, как степень электролитической диссоциации — количественная характеристика диссоциации электролитов.
После введения этого термина стали понятны свойства большинства электролитов — их сталисвязывать со свойствами ионов. Из-за этого теорию Аррениуса иногда называли ионной, и это название до сих пор можно встретить в некоторых статьях и книгах. Например,
, Монография по методике преподавания химии // http:///docs/1388/index-1565673.html ? page=27 ссылка действительна на 3.04.15
Новые представления о механизмах реакций расщепления углеводородов на катализаторах нефтепереработки, с.8 // http://chukingendm. ru/o_72e33e6a0b5de59a-8.html ссылка действительна на 3.05.15
Хотя ее до сих пор преподают в школах, она имеет достаточно много минусов. Используя ее, невозможно ответить на вопросы, связанные с появлением энергии и выделением теплоты, потому что Аррениус считал, что вода не вступает во взаимодействие с ионами, т. е. является инертной средой. Сейчас уже давно понятно, что это неверно. Но тогда Сванте Аррениус и другие ученые еще не подозревали о том, что они глубоко ошибаются.
Проводя многочисленные опыты с растворами серной кислоты и некоторых солей, начал догадываться о химическом взаимодействии между растворяемым веществом и растворителем. В 1887 году он создал химическую (гидратную) теорию растворов. Основа этой теории: образование раствора сопровождается химическим взаимодействием между растворяемым веществом и водой. Соединения, которые образовываются при этом, он назвал гидратами.
Таким образом теории Аррениуса и Менделеева противоречили друг другу, и каждый из них считал теорию другого ошибочной. Но со временем стало понятно, что обе теории правильные, но описывают растворение веществ с разных сторон.
Русский химик 20 смог объединить эти две теории, доказав, что при растворении в воде электролиты диссоциируют на ионы, которые тут же подвергаются гидратации — присоединении молекул воды к ионам. Его опыты объясняли, что происходит с энергией — диссоциация требует больших энергетических затрат, а гидратация сопровождается выделением значительного количества энергии, которое иногда даже перекрывает затраты на диссоциацию.
Например, растворение гидроксида натрия (NaOH) – экзотермический процесс: на разрушение кристаллической решётки тратится 884 кДж/моль, а при образовании гидратированных ионов Na+ и OH — выделяется соответственно 422 и 510 кДж/моль.
А если растворить в воде нитрат аммония (NH4NO3), то температура раствора понизится на 26,8 кДж/моль — энергии на распад молекулы требуется больше, чем выделяется при гидратации.
Итак, теория Каблукова, объединившая две теории, заложила фундамент современного представления о растворах. Но она описывала процесс растворения и поведение кислот и оснований лишь в водных растворах, поэтому понадобилось создать теорию, которая была бы применима также и с другими растворителями.
3 глава. Более поздние теории
В 1905 году Е. Франклину после проведения ряда опытов удалось провести аналогию между химическими реакциями электролитов в воде и в жидком .
Жидкий аммиак и вода сами по себе имеют множество схожих свойств, например, они оба слабо проводят электрический ток и одинаково взаимодействуют с щелочными металлами.
2K + 2H2O = H2 + 2KOH; 2K + 2NH3 = H2+ 2KNH2
Исследования Франклина привели к выводу, что теория Аррениуса очень ограниченна, т. к. описывает процесс растворения и поведение только водных растворов. В результате дальнейших опытов выяснилось, что не только аммиак имеет схожести с водой, сейчас таких веществ известно несколько десятков. Поэтому понадобилось разработать новую теорию, описывающую любые растворы.
А также химики обнаружили много веществ, проявлявших основные свойства, но не подходивших под определение Аррениуса, и в итоге сложилось новое представление об основаниях — это вещества, которые имеют способность отбирать у других веществ протоны и присоединять их к себе. В 1923 году датчанин И. Бренстед21 увидел, что при кислотно-основном взаимодействии протоны переходят от кислоты к основанию. Он воспользовался аналогией с окисилительно-восстановительными реакциями, но вместо переходов электронов от восстановителя к окислителю в кислотно-основном взаимодействии протоны переходят от кислоты к основанию. Вещества, которые обмениваются протонами, он назвал протолитами, поэтому его теория и была названа протолитической. Следовательно, согласно его теории, кислота — это вещество, способное отдавать протоны другому веществу (донор протонов), а основание — вещество, принимающее эти протоны (акцептор протонов).
Но она имела один недостаток — протоны могут отщеплять не только кислоты, но также и ионы. Получалось, что и эти ионы нужно было считать кислотами. А нейтральные молекулы и заряженные ионы, присоединяющие протоны — основаниями.
Также теория Бренстеда заставила пересмотреть роль растворителя в реакциях. Вода, которая считалась инертной средой при Аррениусе, оказалась очень активным веществом. Например, в реакциях с H2SO4, HNO3 и другими кислотами вода отнимает у них протоны, то есть выступает в качестве основания.
А в процессе растворения аммиака в воде молекулы аммиака отбирают протоны у молекул воды, следовательно аммиак является основанием, а вода — кислотой.
NH3+HOH ↔ NH4+ + OH-
Впоследствии выяснилось, что любой растворитель становится кислотой или основанием только при взаимодействии с другим веществом. Ученые начали проводить множество опытов и обнаружили, что на отсоединение протонов требуется энергия, ведь при этом происходит разрыв связей. Те вещества, у которых эти связи между молекулами слабые и процесс диссоциации происходит быстро, называются сильными электролитами (например, HCl, H2SO4).
Слабыми электролитами называют те вещества, которые диссоциируют не полностью из-за прочности связей (например, H2S, HClO).
Поэтому получается, что теория Бренстеда показала, как относительны понятия «кислота» и «основание». Она до сих пор является одной из главных о кислотах и основаниях.
Теория Бренстеда заставила пересмотреть роль растворителя в реакциях. Ученые начали проводить множество опытов и обнаружили, что на отсоединение протонов требуется энергия, ведь при этом происходит разрыв связей. Те вещества, у которых эти связи между молекулами слабые и процесс диссоциации происходит быстро, называются сильными электролитами (например, HCl, H2SO4).
Слабыми электролитами называют те вещества, которые диссоциируют не полностью из-за прочности связей (например, H2S, HClO).
Но потом химикам начали встречаться реакции, носящие кислотно-основный характер, хотя ни в одном из реагирующих веществ не содержалось частиц H+, например,
MgO+SO3=MgSO4
Реагируют основные и кислотные оксиды, но они обладают большим сходством с кислотами и основаниями. Ученые выделили такие вещества в отдельную группу, названную апротонными кислотами или L-кислотами (L-первая буква фамилии Г. Льюиса22 — химика, который первый ввел этот термин).
Остальные кислоты назывались Н-кислотами или бренстедовскими кислотами.
Итак, ограниченность протолитической теории заключается в том, что она исключает возможность проявления кислотного характера веществами, не содержащими водорода.
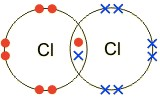
В 1923 году американский химик Г. Льюис стал первым, кто догадался связать кислотно-основное взаимодействие не с протонами, а с электронами. Льюис — создатель теории ковалентной связи. Согласно этой теории, химическая связь между атомами — это образование общих
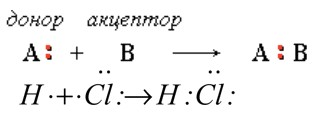
электронных пар. Существует два способа образования этих пар: обменный механизм (рис.1) и донорно-акцепторный. Во втором случае при взаимодействии двух веществ атом одного вещества (донор) отдает одну свою электронную пару, а атом другого (акцептор)предоставляет ячейку для этой пары, орбиталь (рис.2).
В результате взаимодействия появляется общая электронная пара. Рассматривая кислотно-основные реакции Льюис заметил, что при них всегда происходит донорно-акцепторное взаимодействие. Заметив закономерность, он сформулировал новое представление о кислотах и основаниях. Основание по его версии является донором электронных пар, а кислота — акцептором.
Итак, теория Льюиса не имела особых противоречий с теорией Бренстеда, она лишь включала гораздо больше веществ в понятия кислот и оснований.
В 1938 году русский химик Михаил Ильич Усанович предпринял попытку сформулировать обобщенную теорию кислот и оснований, то есть объединить протонную теорию Бренстеда и электронную теорию Льюиса в одну. Согласно этой обобщенной теории, кислота — это частица, которая способна отсоединять катионы (положительные ионы) и протоны, или присоединять анионы (отрицательные ионы) и электроны. Основание — частица, которая может присоединять протон и другие катионы или отдавать электрон и другие анионы. Главная мысль теории Усановича заключается в том, что понятия кислота и основание зависят от заряда частицы — положительного или отрицательного, а не от строения электронной оболочки, как считал Льюис.
Но недостаток этой теории заключается в том, что она слишком общая и недостаточно четко определяет понятия кислоты и основания. Сейчас она практически не используется.
4 глава. Сравнение теорий
|
Название теории |
Применимость теории |
Главная мысль |
Отличия от предыдущей |
|
Теория электролит. диссоциации |
только водные растворы |
Электролиты распадаются на ионы при растворении |
________ |
|
Протолитическая теория |
протонные кислоты |
При кислотно-основных реакциях осуществляется переход протонов от кислоты к основанию |
описывает все растворы |
|
Электронная теория Льюиса |
апротонные кислоты |
При кислотно-основных реакциях осуществляется переход электронов от основания к кислоте |
гораздо шире круг понятий кислоты и основания |
Заключение
Кислоты и основания известны людям с древнейших времен. Сейчас они довольно широко используются в различных областях — в быту, строительстве, на химическом производстве.
В конце XIX века появилась первая теория кислот и оснований, которая вызвала как позитивную, так и негативную реакцию химиков по всему миру. Химики, которые были не согласны с мыслями, изложенными в этой теории, сформулировали другую, но позже оказалось, что обе теории являются правильными, они всего лишь описывают растворение веществ с разных сторон.
Так как эти теории описывали только водные растворы, потребовалось создать новую, более общую теорию, и в 1905 году удалось это сделать Бренстеду. Согласно новой теории, в основе кислотно-основных реакций лежали переходы протонов от кислот к основаниям.
В 1923 году появилась электронная теория Льюиса, которая рассматривала химическую связь как образование общих электронных пар. Эта теория расширила круг кислот и оснований, но все же была не столь четкой, как теория Бренстеда.
Таким образом, в этом реферате были рассмотрены три теории кислот и оснований, описывающие эти вещества с разных сторон, выявлены их слабые и сильные стороны, и составлена сравнительная таблица.
Список литературы
[Электронный ресурс]//URL: https://drprom.ru/referat/osnovaniya/
Химия: Кислоты и основания //- М.: Просвещение, 2000. — С. 11-35. http://studyport. ru/referaty/estestvennye-nauki/3112-rastvory-rastvorimost Ссылка действительна на 15.03.2015 , , Выдающиеся химики мира. –М.: ВШ, 1991. 656 с. ; Большая советская энциклопедия. В 30 тт. // http://www. physchem. chimfak. rsu. ru/ Ссылка действительна на 15.03.2015 Биографии великих химиков. Перевод с нем. под ред. – М.: Мир, 1981. 320 с // http://www. physchem. chimfak. rsu. ru/ Ссылка действительна на 15.03.2015 С. Benedicks. Svante Arrhenius. Stockholm, 1938; Ю. И.. Соловьев, . Сванте Аррениус. M.: Изд-во АН СССР, 1959. В. А. КРИЦМАН // http://www. chem. /rus/elibrary/nobel/1903-Arrhenius. html Ссылка действительна на 15.03.2015 Современная Энциклопедия, 2000 //http://dic. academic. ru/dic. nsf/enc1p/29570 Ссылка действительна на 15.03.2015 Большая биографическая энциклопедия, 2009. //http://dic. academic. ru/dic. nsf/enc_biography/49264/Каблуков Ссылка действительна на 15.03.2015 Большой энциклопедический словарь / Ред. . – 2-е изд., перераб. и доп. – М. : Большая Российская энциклопедия, 2000. 1219 с. Мария Зацепина //http://www. alhimik. ru/great/great0.html Ссылка действительна на 15.03.2015 Мир Энциклопедий Аванта+, 2006 // http://murzim. ru/nauka/himiya/ Ссылка действительна на 29.03.15 Журнал «Химия», Изд-во «Первое сентября» // . ru/article. php? ID=200501401 Ссылка действительна на 29.03.15
1 http://one_vision. jofo. ru/238298.html ссылка действительна на 28.03.15
2 Винсент из Бове — (ок. 1190 — ок. 1264) — ученый монах-доминиканец, фр. писатель-энциклопедист, автор энциклопедии «Большое зерцало» («Великое зеркало»).
3 Глаубер Иоганн Рудольф (1604-1670) — немецкий химик и врач. Получил чистые азотную и соляную кислоты, многие соли, в т. ч. глауберову (1648).
Применил стекло для изготовления химической посуды. Основал промышленное стекловарение в Тюрингии. Получил жидкое стекло.
4 Джон Рэй (1627-1705) — английский натуралист. Опубликовал ряд важных работ о растениях и животных, а также классическую работу в традиции натуральной теологии — Wisdom of God, Manifested in the Work of Creation (1691), исследовал влияние света на окраску растений, собиратель английских пословиц и поговорок.
5 Василий Валентин — алхимик, живший в XIV или XV веке; его трактаты получили широкую известность в XVII веке.
6 Либавий Андреас (1550 — 1616) — немецкий химик и врач. В книге «Алхимия» (1597) систематически изложил практические сведения по химии, описал получение серной кислоты, а также хлорного олова.
7 Бойль Роберт (1627 — 1691) — английский химик и физик. Сформулировал (1661) первое научное определение химического элемента, развивал атомистическую теорию, положил начало химическому анализу. Установил (1662) один из газовых законов (закон Бойля-Мариотта).
8 Вильгельм Гомберг (1652—1715) — химик. Выделил из буры борную кислоту, составил легкоплавкие сплавы из олова, свинца и висмута, открыл фосфоресценцию расплавленной смеси хлористого кальция с известью (фосфор Гомберга).
9 (1742 — 1786) — шведский химик, по профессии . Первым получил многие неорганические и органические вещества, в том числе хлор (1774), глицерин, синильную кислоту (1782), ряд органических кислот, доказал сложный состав воздуха.
10 Пристли Джозеф (1733-1804) — британский химик и священник, открывший в 1774 г. кислород. Открыл также ряд других газов, в том числе аммиак и оксиды азота. Изучал свойства углекислого газа и изобрел газированные напитки. Был защитником позднее опровергнутой гипотезы флогистона.
11 http://www. critical. ru/calendar/oxigen2.htm, ссылка действительна на 29.03.15
12 Антуан Лоран Лавуазье (1743-1794) — французский естествоиспытатель, химик, один из основоположников современной химии. Систематически применял в химических исследованиях количественные методы. Выяснил роль кислорода в процессах горения, окисления и дыхания (1772-77), чем опроверг теорию флогистона. Один из основателей термохимии. Руководил разработкой новой химической номенклатуры (1786-87).
Автор классического курса «Начальный учебник химии» (1789).
13 Бертоллем Клод Луи (1748—1822) — французский химик, основатель учения о химическом равновесии. Одним из первых поддержал антифлогистическое учение А. Лавуазье. Разработал (совместно с Лавуазье и др.) новую химическую номенклатуру. Установил состав аммиака, природного газа, синильной кислоты, сероводорода. Открыл (1785) хлорат калия (бертолетову соль).
14 Дэви Гемфри (Хамфри) (1778-1829) — английский химик и физик, один из основателей электрохимии. Получил электролизом водород и кислород (из воды), K, Na, Ca, Sr, Ba, Mg и Li. Предложил водородную теорию кислот.
15 Либих Юстус (1803 — 1873) — немецкий химик, основатель научной школы, один из создателей агрохимии. Открыл (1823) изомерию. Получил ряд органических соединений. Один из создателей теории радикалов. Автор химической теории и гниения, теории минерального питания растений, доказал необходимость широкого применения минеральных удобрений.
16 Фарадей Майкл (1791-1867) — английский физик, основоположник учения об электромагнитном поле. Обнаружил химическое действие электрического тока, взаимосвязь между электричеством и магнетизмом, магнетизмом и светом. Установил законы электролиза, ввел понятия электрического и магнитного поля, высказал идею существования электромагнитных волн.
17 Дэви Гемфри (Хамфри) (1778-1829) — английский химик и физик, один из основателей электрохимии. Получил электролизом водород и кислород (из воды), K, Na, Ca, Sr, Ba, Mg и Li. Предложил водородную теорию кислот.
18 Аррениус Сванте Август (1859-1927) — шведский ученый, один из основателей физической химии. Автор теории электролитической диссоциации. Труды по химической кинетике (уравнение Аррениуса), а также по , астрофизике и биологии. Нобелевская премия (1903).
19 (1840 – 1905) – шведский химик, минералог, океанограф. Занимался исследованиями в области химии, геологии, ботаники, гидрографии. Основные химические работы посвящены изучению редкоземельных элементов и разработке методов их разделения.
20 (1857-1942) — российский физикохимик. Основные труды по электрохимии неводных растворов. Развил представление о сольватации ионов. Труды по истории химии.
21 Йоханнес-Николаус Брёнстед (1879 -1947) — датский физико-химик, член Датского королевского общества наук. С 1930 по 1947 год он возглавлял Физико-химический институт Высшей технической школы в Копенгагене.
Основные посвящены химической кинетике, катализу и термодинамике растворов. Главное достижение — формулировка основных положений «общей» или «расширенной» теории кислот и оснований.
22 Льюис Гилберт Ньютон (1875-1946) — американский физикохимик, основатель научной школы. Труды по химической термодинамике. Предложил электронную теорию неполярной химической связи (1912-16) и одну из современных теорий кислот и оснований (1923).
Впервые получил тяжелую воду (1933, совместно с Р. Макдональдом).
