Метод анализа, основанный на переведении определяемого компонента в поглощающее свет соединение с последующим определением количества этого компонента путем измерения светопоглощения раствора полученного соединения, называется фотометрическим.
По окраске растворов окрашенных веществ можно определять концентрацию того или иного компонента или визуально, или при помощи фотоэлементов — приборов, превращающих световую энергию в электрическую. В соответствии с этим различают фотометр’ический визуальный метод анализа, называемый часто колориметрическим, и метод анализа с применением фотоэлементов- собственно фотометрический метод анализа. Фотометрический метод является объективным методом, поскольку результаты его не зависят от способностей наблюдателя, в отличие от результатов колориметрического — субъективного метода.
Фотометрический метод анализа — один из самых старых и распространенных методов физико-химического анализа. Его распространению способствовали сравнительная простота необходимого оборудования, особенно для визуальных методов, высокая чувствительность и возможность применения для определения почти всех элементов периодической системы и большого количества органических веществ. Открытие все новых и новых реагентов, образующих окрашенные соединения с неорганическими ионами и органическими веществами, делает в настоящее время применение этого метода почти неограниченным.
Фотометрический метод анализа может применяться для большого диапазона определяемых концентраций. Его используют как для определения основных компонентов различных сложных технических объектов с содержанием до 20-30% определяемого компонента, так и для определения микропримесей в этих объектах при содержании их до 10-3 — 10-4%. Комбинирование фотометрических методов с некоторыми методами разделения — хроматографическим, экстракционным позволяет на 1-2 порядка повысить чувствительность определения, доведя «его до 10-5.
В некоторых случаях фотометрический метод может быть применен для одновременного определения в растворе нескольких ионов, хотя, как это будет показано ниже, его возможности ограничены.
Очень ценно использование фотометрических методов для решения многих теоретических вопросов аналитической и физической химии.
Фотометрия, раздел прикладной физики, занимающийся измерениями света. С точки зрения фотометрии, свет — это излучение, способное вызывать ощущение яркости при воздействии на человеческий глаз. Такое ощущение вызывает излучение с длинами волн от ~0,38 до ~0,78 мкм, причем самым ярким представляется излучение с длиной волны ок. 0,555 мкм (желто-зеленого цвета).
Фотометрическое определение железа в питьевой воде
... фотометрических методов анализа практически не имеет ограничений; в настоящее время известны достаточно простые фотометрические методы определения почти всех элементов или их соединений. Для фотометрического определения органических компонентов ... особенностями анализируемого материала или выбранной реакцией, а общими условиями работы той или другой лаборатории. Различают, по крайней мере, три ...
Поскольку чувствительность глаза к разным длинам волн у людей неодинакова, в фотометрии принят ряд условностей. В 1931 Международная комиссия по освещению (МКО) ввела понятие «стандартного наблюдателя» как некоего среднего для людей с нормальным восприятием. Этот эталон МКО — не что иное, как таблица значений относительной световой эффективности излучения с длинами волн в диапазоне от 0,380 до 0,780 мкм через каждые 0,001 мкм. Яркость, измеренная в соответствии с эталоном МКО, называется фотометрической яркостью или просто яркостью.
1. Фотометрический метод, .1 Объективные ошибки фотометрии
- Реакцию переведения определяемого иона в окрашенное соединение можно представить уравнением
Х + R ХR (II-9)
где X — определяемый ион в большинстве случаев бесцветный или слабоокрашенный;
- реагент, окрашенный иначе, чем соединение ХR;
- ХВ — окрашенное соединение.
Например, ион железа (III) слабожелтый, ион роданида бесцветный, а роданидный комплекс железа ярко-красный. Характер светопоглощения при образовании комплекса может сильно изменяться, примером такого изменения могут служить спектрофотометрические кривые, приведенные на рис. II-7.
Рассмотренная реакция обратима и константа диссоциации соединения ХR выражается уравнением:
[Х] [R] a2= —- = C— (II — 10)
[ХR] 1- a
где С — концентрация окрашенного соединения ХR;
- а — степень диссоциации соединения ХR.
Интенсивность окраски раствора, зависящая от соотношения концентраций окрашенных и бесцветных частиц, изменяется с изменением общей концентрации раствора, так как при этом происходит одновременное изменение степени диссоциации. В результате при разбавлении или при концентрировании растворов наблюдаются отклонения от основного закона фотометрии.

Рис. 1 — Спектрофотометрические кривые хлороформных растворов: 1- дитизона; 2 — комплекса кадмия с дитизоном
Рассматривая константу диссоциации окрашенного комплекса при разных концентрациях, А. К. Бабко сделал вывод, что отклонения от закона Бугера — Ламберта — Бера могут быть вычислены следующим образом. Предположим, что до разбавления молярный коэффициент поглощения исследуемого раствора равен |. Если разбавить раствор в п раз и одновременно увеличить толщину слоя во столько же раз, то при подчинении закону Бугера — Ламберта — Бера молярный коэффициент поглощения останется неизменным. Если светопоглощение раствора не подчиняется этому закону, е изменится и станет равным . При этом относительное изменение молярного коэффициента поглощения выразится формулой
ε — εn
Δ═ — (II — 11)
εn
и будет характеризовать степень отклонения от закона Бугера — Ламберта —
Бера.
Величина может быть связана со степенью диссоциации окрашенного комплекса уравнением: = ап -а1 , здесь ап-степень диссоциации после разбавления, а а1 — то же до разбавления.
Буровые растворы. Классификация, параметры, свойства
... счет совершаемой на забое механической работы. Буровой раствор, омывая породоразрушающий инструмент, в результате ... воздействие, основанное на процессах гидратации, диссоциации, ионообмена и химических превращений; 2) ... пород сводится к физико-химическим изменениям в структуре пород под действием ... и полные. Проницаемые зоны классифицируются по величине коэффициента, характеризующего проницаемость зоны ...
В большинстве случаев фотометрические определения проводят в присутствии избытка реактива, образующего окрашенное соединение. Рассматривая обратимый процесс образования окрашенного соединения, можно легко показать, что
Δ = — (n — 1)(II — 12)
РС
где К — константа диссоциации комплекса;
- р — избыток реагента;
- С — первоначальная концентрация определяемого иона;
- п — разбавление.
Основную роль в этой формуле играет член К/рС, так как величина п. обычно практически составляет 2-3 единицы. Воспользовавшись этой формулой, можно легко определить необходимый избыток реагента р для того, чтобы при разбавлении в определенное число раз ошибка не превышала некоторого наперед заданного значения.
Например, определим избыток КNCS при комплексообразовании с Fе3+ (К = 5-10-3), необходимый для того, чтобы при двукратном разбавлении значение не превышало 1%, если концентрация Fе3+ равна 10-2 моль/л. Воспользовавшись формулой (II-12), найдем:
- 10-3 5- 10-3_
,01 = _________ (2 — 1) , откуда р = ________________ = 50
р-10 -2 10 2 . 10 -2
т.е. к раствору, содержащему Fе3+, необходимо прилить равный объем 0,5 н, раствора KNCS.
Для более стойких комплексов значение р будет еще меньше.
- Большинство окрашенных соединений чувствительно к концентрации ионов водорода. При изменении рН раствора происходит изменение молярного коэффициента поглощения, а очень часто изменение и кривой светопоглощения. В качестве примера на рис. 11-8 приведены кривые светопоглощения галлия с морином при рН = 3,6 (кривая /) и рН = 4,6 (кривая 2).
В этом случае изменяется только оптическая плотность. Для комплекса;
- галлия с метилтимоловым синим, кривая 3 снята при рН = 1,8, а кривая 4 при рН = 6;
- здесь при изменении рН наблюдается изменение и положения максимума светопоглощения, и оптической плотности.
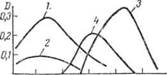
Рис. 2 — Изменение кривых светопоглощения комплексов галлия с морином (1 и 2) и метилтимоловым (3, 4) в зависимости от рН: 1 — рН-3,6; 2-рН = 4,6;3 — рН = 1,8; 4-рН=6.
Концентрация попов водорода оказывает различное влияние на комплексные соединения с разными анионами. В зависимости от природы аниона все комплексы можно разделить на две группы.
Комплексы с анионами сильных к и с л о т. К ним относятся окрашенные комплексы с иодидами, роданидами и анионами других кислот, Эти комплексы устойчивы при малых значениях рН и гидролизуются с образованием осадков при увеличении рН. Таким образом, для этих комплексов, условием устойчивости и применения основного закона фотометрии является высокая кислотность среды.
Комплексы с анионами слабых кислот. К ним относятся комплексы с большинством реагентов, применяемых в фотометрии: дитизоном, алюминоном и др. Рассматривая реакцию разложения комплекса ХR ионами водорода
ХR + H+ HR + Х+
и выражая константу равновесия этой реакции через константу нестойкости комплекса ХR и константу диссоциации слабой кислоты НR, можно для условия разложения окрашенного комплекса наполовину [Х+] = [ХR] получить уравнение:
Методы определения плотности растворов веществ и твердых тел
... при наличии примесей имеет серую, желтоватую, розоватую, бурую окраску. Плотность — 2,3 — 2,7 г/смі, твёрдость по ... веществ в организме. Водные растворы NaCl в медицине используют в качестве кровезамещающих жидкостей после кровотечений и при явлениях шока. Гипертонические растворы ... достаточно рассыпчатая и мягкая. Состав мела это практически исключительно (до 99% от всей массы) мелкие зерна ...
HR
[Н+] = [HR]—(II-13)XR
Это уравнение определяет условия разрушения таких комплексов кислотами. Например, при комплексообразовании с салициловой кислотой (для Си2+ K компл = 10-11, а для Fе3+ K компл = 10-16) согласно уравнению (II-13) комплекс с медью должен разлагаться при более высоком значении рН, чем комплекс с железом. И действительно, первый заметно разлагается при рН = 4,5, а второй устойчив даже при рН = 2. Из уравнения (П-13) можно сделать вывод о влиянии избытка комплексообразователя: чем больше последний, тем устойчивее комплекс и меньше рН, при котором наступает разложение. Например, указанный выше комплекс железа при двукратном избытке комплексообразователя начинает заметно разлагаться уже при рН = 2,5, а при 100-кратном избытке разложение наступает только при рН = 1,5. Значительное увеличение рН может привести к разложению комплекса с образованием гидроокиси соответствующего металла. Кроме этого, при сильном изменении рН может происходить изменение координационного числа и образование новых комплексов с другой окраской. Так, железо с салициловой кислотой при разных значениях рН образует различные комплексы:
рН Формула комплекса Окраска Максимумы
комплекса светопоглощения.
<4 [Fе(С7Н403)]+ Фиолетовая 530
- 9 [Fе(С7Н403)2]- Красная 430
>9 [Fе(С7Н403)з]3- Желтая 480
Зависимость устойчивости комплекса от рН удобно изображать графически. В большинстве случаев с увеличением рН оптическая плотность О сначала увеличивается (рис. П-9), что связано с упрочнением образующегося комплекса. В определенном интервале рН оптическая плотность становится постоянной, и именно этот интервал представляет наибольший интерес для аналитического использования, так как тут не требуется строгого соблюдения рН. При дальнейшем увеличении рН оптическая плотность раствора снижается в результате разложения окрашенного комплекса и образования гидроокисей.
- Очень часто отклонение от основного закона фотометрии вызывается процессом комплексообразовании, например:
Раствор СоСI2 синий при высокой концентрации, розовеет при разбавлении вследствие образования комплекса Со(СоСI4).
Одновременно с этим происходит изменение е.
Подобные же изменения могут происходить при комплексообразовании с участием молекул растворителя, например:
[Сu(МН3)4]2+ + 2Н2 [Сu(NH3)3Н20]2+ + NH4ОН
[Сu(NH3)3Н20]2+ + 2Н20 [Сu(NН3)2(Н20)2]2+ + NH4ОН
Все эти ионы имеют различные молярные коэффициенты поглощения. Поэтому с разбавлением раствора, содержащего ярко-синие [Сu(NНз)4]2+-ионы, и по мере образования голубых ионов [Сu(NН3)2(Н20)2]2+ будет происходить изменение оптической плотности, связанное не только с изменением концентрации,, но и с изменением молярных коэффициентов поглощения е окрашенных ионов. Изменение оптической плотности может происходить также вследствие введения в раствор посторонних ионов. Например, раствор Fе(NСS)3 при добавлении NaF обесцвечивается, так как происходит образование бесцветного комплекса [FеF6]3-.
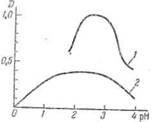
Рис. 3 — Зависимость оптической плотности от рН: 1-алюминон-алюминиевый комплекс; 2-кремнемолибденовая гетерополикислота
Взаимодействие лазерного излучения с веществом
... малых и очень больших плотностей потока излучения). Последнее связано со специфической особенностью лазерных экспериментов: в режиме ... энергии превращается в кинетическую) определяется свойствами облучаемых веществ и лежит в области Q ~ 10 9 ... излучением множества атомов и, сосредоточенная в оптическом резонаторе энергия генерируется таким образом, что вновь возникающее излучение оказывается в фазе с ...
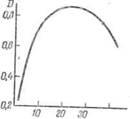
Рис. 4 — Изменение оптической плотности раствора окрашенного соединения во времени
— У большинства окрашенных соединений интенсивность окраски изменяется со временем. В общем случае вначале происходит постепенное возрастание оптической плотности, так как реакции образования окрашенных соединений идут во времени. Затем на определенный интервал времени окраска стабилизируется и именно этот период используется в фотометрическом анализе. Затем наступает явление «выцветания» окраски — уменьшение оптической плотности, связанное с действием кислорода воздуха, солнечного света и других факторов. Общий характер оптической плотности раствора окрашенного соединения во времени иллюстрируется рис. II-10. В некоторых случаях, например для купфероната ванадия, период созревания окраски очень мал и она стабильна в течение 30-40 мин. Окраска фос-форомолибденового комплекса, наоборот, медленно созревает, в течение 40-60 мин, а затем очень долгое время остается стабильной. Поэтому всегда при фотометрических исследованиях необходимо предварительными опытами установить интервал времени стабильности исследуемого окрашенного соединения.
- Интенсивность окраски, а следовательно, и поглощение зависят от температуры.
Поглощение некоторых соединений, например роданидпого комплекса вольфрама, возрастает с повышением температуры, а для роданидпого комплекса молибдена, соединения иода с крахмалом наблюдается обратная зависимость.
Следовательно, при фотометрировании необходимо соблюдать постоянную температуру; однако влияние температуры в большинстве случаев незначительно, и поэтому она должна поддерживаться постоянной в пределах ±1-3° С. Различие зависимости поглощения от температуры используется в термоспектрофотометрическом методе анализа.
- Отклонения от закона Бугера — Ламберта- Бера могут быть вызваны и посторонними веществами, присутствующими в растворе. Влияние посторонних веществ можно разделить на несколько типичных случаев.
Постороннее вещество окрашено. В этом случае на окраску исследуемого вещества накладывается окраска постороннего вещества. Если эта окраска постоянна, то калибровочныи график не проходит через начало координат, но может быть использован для определения исследуемого вещества. Если окраска постороннего вещества не постоянная, то в этом случае иногда можно выбрать подходящую длину волны, которую постороннее вещество не поглощает, а исследуемое поглощает. Иногда такие растворы можно фото-метрировать методами дифференциальной фотометрии. Наиболее радикальным методом подавления вредного влияния постороннего вещества является удаление его из раствора тем или другим путем (экстрагированием, окислением, осаждением и др.).
Постороннее вещество реагирует с реагентом. В этом случае образуется смешанная окраска исследуемого и постороннего вещества. Если концентрация постороннего вещества постоянна и окраска не очень интенсивна, то можно вести фотометрический анализ, но калибровочный график будет начинаться не от нуля. Как и в первом случае, можно использовать фотометрирование при подходящей длине волны. В некоторых случаях можно вести фотометрический анализ, измеряя вначале суммарную оптическую плотность, а затем тем или другим способом, разрушив одно из соединений, определить оптическую плотность оставшегося соединения, затем по разности можно найти концентрацию разрушенного соединения. Как и в первом случае, наиболее радикальным способом является удаление постороннего вещества.
Постороннее вещество влияет на окраску. Это наиболее сложный случай, так как очень часто неизвестна природа такого влияния. Иногда это влияние связано с. изменением ионной силы раствора или с образованием смешанных комплексов неизвестного и сложного состава. Наиболее радикальным выходом в данном случае является удаление мешающего вещества.
- Образование окрашенного соединения и интенсивность его окраски очень часто зависят от таких условий, как количество прибавляемого реактива, порядок добавления, концентрация реагента и др.
На рис. II-11 приведена зависимость оптической плотности раствора родаиидного комплекса молибдена от количества прибавленного роданида калия. С увеличением количества роданида. калия оптическая плотность возрастает до некоторого предела, после которого избыток реагента больше не влияет на окраску. Другие реагенты могут вести себя иначе, например, добавление избытка их может приводить к уменьшению оптической плотности. Следовательно, количество добавляемых реактивов необходимо строго дозировать, иначе, возможно неучитываемое отклонение от основного закона фотометрии.
Субъективные ошибки при колориметрировании. При визуальном колориметрировании могут быть ошибки, связанные с недостатками зрения наблюдателя. Даже нормально развитое зрение человека неодинаково чувствительно к различным цветам. На рис. II-12 приведена кривая изменения чувствительности человеческого глазе к свету разной длины волны. За 100% условно принята чувствительность к зеленой линии спектра X — 553 нм. Как видно, глаз наиболее чувствителен к лучам желтого и зеленого цвета.
Длительное наблюдение окрасок, сравнение их между собой вызывает ослабление чувствительности глаза, и при этом возникают ошибки колориметрировании. Для того чтобы возможно меньше утомлялась глаза наблюдателя, рекомендуется принимать ряд предосторожностей:
- периоды наблюдения окрасок должны быть, возможно, более кратковременными и чередоваться с отдыхом глаз;
- наблюдения следует вести в затемненной комнате;
- при длительной работе рекомендуется периодически промывать глаза водой.
Визуальные методы колориметрии являются субъективными методами, т. е. они зависят от чувствительности человеческого глаза. Эти методы очень утомительны при массовой работе; пользуясь ими, нельзя автоматизировать анализ.
1.2 Фотоэффект
В основе фотоэлектрического метода анализа лежит явление фотоэлектрического эффекта (фотоэффекта).
Фотоэффектом называется явление отрыва электронов от атомов веществ под действием светового потока. Если электроны отрываются от поверхности тела, то фотоэффект называется внешним. Если же электроны отрываются от внутренних атомов тела, то фотоэффект называется внутренним, или объемным.
Прибор, в котором световая энергия преобразуется в электрическую, называется фотоэлементом. Фототок (I) при определенных условиях, которые соблюдаются при фотометрическом анализе, пропорционален интенсивности светового потока (I):
= К1 (II-14)
По принципу устройства фотоэлементы делятся на:
- фотоэлементы с внешним фотоэффектом;
- фотоэлементы с внутренним фотоэффектом;
- фотоэлементы с запирающим слоем. Каждый фотоэлемент характеризуется:
- спектральной характеристикой, представляющей собой кривую зависимости силы фототока от длины волны света, падающего на фотоэлемент.
Максимальная длина волны, при увеличении которой фотоэлемент перестает реагировать на освещение, называется порогом фотоэффекта, или его красной границей;
- чувствительностью, которая выражается силой тока в микроамперах (10-6 А), возникающей в фотоэлементе при падении на него светового потока в 1 люмен.
Фотоэлемент с внешним фотоэффектом. Катод и анод фотоэлементов помещают в стеклянную колбу, из которой выкачан воздух. Если к электродам приложена достаточная разность потенциалов (100-^200 В), то при освещении в цепи возникает ток, сила которого пропорциональна силе светового потока.
Для повышения чувствительности фотоэлементы наполняют каким-либо инертным газом. При этом спектральная характеристика фотоэлементов не изменяется, а чувствительность их повышается от 20 мкА/лм до 500 мкА/лм.
Основным недостатком фотоэлемента с внешним фотоэффектом является необходимость наложения определенной, разности потенциалов между анодом и катодом, а также хрупкость этих приборов.
Основное достоинство фотоэлементов с внешним фотоэффектом в том, что у них сила фототока пропорциональна интенсивности светового потока на сравнительно большом интервале интенсивности светового потока, и они не имеют инерционного эффекта, т. е. быстро реагируют на изменение света.
После длительной работы у фотоэлементов замечается явление усталости, выражаемое в уменьшении силы фототока при -той же интенсивности светового потока.
Фотоэлементы с внутренним фотоэффектом, или фотосопротивления. Эти приборы основаны на уменьшении сопротивления некоторых полупроводников под влиянием света. 3 качестве полупроводников, применяют обычно селен или сульфид таллия.
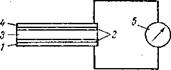
Рис. 5 — Схема вентильного фотоэлемента: 1 -металлическая подложка; 2 -запирающий слой; 3-полупроводник; 4-полупрозрачный слой металла; 5- гальванометр
Для фотоэлементов с внутренним фотоэффектом общая сила фото тока не пропорциональна интенсивности светового потока; их спектральная характеристика сильно сдвинута в инфракрасную область спектра. Фотоэлементы с внутренним фотоэффектом обладают значительной инерцией и большим температурным коэффициентом. Вследствие этих недостатков фотосопротивления не получили широкого применения в фото колориметрии.
Фотоэлементы с запирающигл слоем (рис. 11-13).
Эти приборы основаны на использовании так называемого «вентильного» фотоэффекта.
Сущность «вентильного» фотоэффекта заключается в следующем. Вероятность вырывания электронов из полупроводника больше, чем из проводника, особенно такого, как золото и платина. На границе соприкосновения полупроводника с металлом образуется тонкий слой, обладающий односторонней проводимостью, так называемый «вентильный» или «запирающий» слой. Этот слой свободно пропускает электроны от полупроводника к металлу, но через него не проходят электроны в обратном направлении. В результате этого на границе полупроводника с проводником-металлом возникает некоторая разность потенциалов и во внешней цепи возникает электрический ток, обнаруживаемый гальванометром, включенным последовательно с фотоэлементом. Если наружный слой металла прозрачен для света, а через слой полупроводника свет не проходит, то фотоэффект возникает на запирающем слое между полупроводником и наружным слоем металла. Такой фотоэлемент называется фронтовым. Если полупроводниковый слой тонок и прозрачен для света, а наружный металлический слой только частично закрывает поверхность полупроводника, то свет проходит через полупроводник и фотоэффект возникает на внутренней границе полупроводника и подложки. Такой фотоэлемент называется тыловым.
Фотоэлементы с запирающим слоем не требуют наложения дополнительного напряжения.
При фотоколориметрировании должен быть выбран такой фотоэлемент, у которого максимум спектральной чувствительности находится в области лучей, задерживаемых раствором (в области максимума на его спектре).
Все остальные лучи, не задерживаемые раствором и попадающие на фотоэлемент, искажают его работу. Для того чтобы из светового потока выделить лучи с определенной областью длин волн, применяют различные светофильтры. Следовательно, для получения наилучших результатов при фотоколориметрировании спектральные характеристики применяемого фотоэлемента и светофильтра должны быть согласованы со спектральной характеристикой исследуемого раствора. Спектральная характеристика фотоэлемента по максимуму должна совпадать с максимумом на спектре исследуемого раствора, а спектральная характеристика светофильтра в этой области должна проходить через минимум, т.е. поглощение лучей должно быть минимальным (рис. II-14).
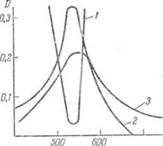
Рис. 6 — Спектральные характеристики светофильтра (I) фотоэлемента (2) и исследуемого раствора (3) Спектрофотометрический анализ
Использование спектрофотометров — приборов, в которых можно определять поглощения света при разных длинах волн, значительно расширяет возможности фотометрического анализа.
Если вещества обладают разными спектрофотометрическими характеристиками или максимумами поглощения при разных длинах волн, то возникает возможность совместного определения их в растворе.
Если окраска раствора подчиняется закону Бера и поглощение света является аддитивной функцией концентрации обоих компонентов, то молярный коэффициент поглощения е этой смеси при данной длине волны равен
ε = εАCA + εвCв
•где εА и εв — молярные коэффициенты поглощения растворов компонентов А и В;
- С а и Св — концентрации этих компонентов, моль/л.
Проводя измерения при двух различных длинах волн, чаще всего при таких, для которых каждый из компонентов обладает максимумом поглощения, можем получить систему уравнений:
- Для λi ε’ = εАСA + ε’вСв; Для λ2 ε» = ε»А СА + ε»вСв
Значения молярных коэффициентов поглощения первого компонента ε’А, ε»А и второго компонента ε’в, ε»в при выбранных длинах волн находят
по таблицам или определяют предварительно экспериментальным путем. Коэффициенты поглощения растворов е’ и е» при тех же длинах волн определяют экспериментально; Решая указанную систему уравнений с двумя неизвестными СА и СВ, вычисляют концентрацию обоих компонентов смеси. Если подобные измерения проводить при трех длинах волн, можно определить концентрацию трех компонентов в смеси.
2. Метод колориметрического титрования или дублирования
Определенный объем анализируемого окрашенного раствора неизвестной концентрации сравнивают с таким же объемом воды, к которой добавляют смесь стандартного раствора с реагентами. Добавление раствора из бюретки-титрование, ведут до уравнивания окрасок исследуемого и титруемого растворов.
Для сохранения равенства объемов в процессе титрования к анализируемому раствору добавляют столько же воды, сколько израсходовано стандартного раствора на титрование. Если количество израсходованного стандартного раствора не превышает 2-3% общего объема, то уравнивание объемов можно не проводить. В некоторых случаях, для того чтобы создать полностью одинаковые условия определения в одном и другом растворе, к титруемой воде добавляют все те посторонние вещества, которые содержатся в анализируемом растворе. Иногда в бюретку помещают стандартный раствор анализируемого вещества определенной концентрации, а к воде добавляют реагент, дающий с определяемым ионом окрашенное соединение.
Обозначим объем исследуемого раствора через V, объем стандартного раствора, добавленный до уравнивания окраски через W, титр стандартного раствора через Т.В этом случае концентрацию неизвестного раствора Сх определяют по формуле:
Т
Сх = ——(II — 19)
В этом методе могут быть применены лишь те цветные реакции, при которых окраска возникает сразу при добавлении исследуемого вещества и образование ее не связано с дополнительными химическими процессами, например образование красной окраски при взаимодействии железа(III) с роданидом. Колориметрические определения, связанные с достаточно сложными химическими реакциями, как, например, определение кремния в виде комплекса с молибдатом аммония, не могут быть выполнены этим методом.
Пределы концентраций, для определения которых может быть применен этот метод, достаточно широки и определяются способностью глаза улавливать различия в интенсивности окрасок.
При колориметрическом титровании: 1) не требуется соблюдения основного закона фотометрии; 2) определение может быть проведено быстро.
Во время титрования строят калибровочный график, откладывая по одной оси оптическую плотность, а по другой — объем израсходованного рабочего раствора в миллилитрах, до наступления точки эквивалентности поглощение будет оставаться неизменным. За точкой эквивалентности поглощение будет увеличиваться пропорционально избытку рабочего раствора. Соединяя нанесенные точки, получаем две прямые, на пересечении которых лежит точка эквивалентности (рис. II-19).
Определение точки эквивалентности при титровании фотоэлектрическим путем значительно точнее, чем определение колориметрическим методом. Особенно удобен этот способ в случае не очень четких, трудно уловимых окрасок.
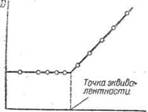
Рис. 7 — График фотоэлектрического титрования
В фотометрических определениях применяются и длинные инфракрасные волны. Как уже указывалось, образование спектров в видимой и ультрафиолетовой областях спектра обусловлено состоянием энергетических уровней электронов в атомах и молекулах поглощающих веществ. Образование инфракрасных спектров связано с энергией колебаний одних атомов относительно других в молекуле и энергией вращения молекул. Спектры, соответствующие колебательной энергии, образуют ближнюю инфракрасную область с длинами волн от 1 мкм до 20 мкм. Спектры, соответствующие вращательной энергии молекул, образуют далекую инфракрасную область с длинами волн от 50 до 100 мкм. Но эта область используется сравнительно редко вследствие сложности наблюдений в ней. Вид кривых поглощения в инфракрасной части спектра сходен с кривыми поглощения в ультрафиолетовой и видимой частях. В качестве
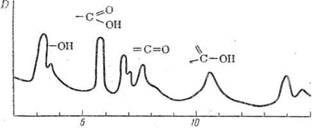
Рис. 8 — Спектрограмма стеариновой кислоты в инфракрасной области спектра.
примера на рис. П-20 показан спектр стеариновой кислоты СНз- (СН2)16-СООН.
На этом спектре каждая из полос поглощения (пики на спектрограмме) соответствует определенной группе атомов, присутствующей в молекуле. В табл. II-4 приведены полосы поглощения для некоторых наиболее важных функциональных групп органических соединений. Таблицы, подобные приведенной, могут быть использованы для определения функциональных групп, присутствующих в исследуемом веществе, -а также для идентификации анализируемых веществ.
Таблица 1 — Полосы поглощения, характерные для некоторых функциональных групп органических соединений
|
Функциональная группа |
Полоса поглощения, мкм |
Функциональная группа |
Полоса поглощения, мкм |
|
≡СН -СНз =СН2 -SН =C=O в карбоннлах в ангидридах в сложных эфирах |
3,02-3,10 3,37-3,49 3,42-3,52 3,85-4,08 3,37-6,10 5,41-5,71 5,71-5,81 |
=с=N─ -NH2 =С=S -СН=СН2 ≡С─СН3 ≡C─O─ |
6,04-6,21 6,08-6,35 6,45-6,63 7,04-7,16 7,20-7,33 9,05-9,42 |
Инфракрасные спектры изомеров достаточно отличаются друг от друга, и это используется для идентификации их. В качестве примера на рис. II-21 приведены спектрограммы некоторых изомеров октана. В отличие от предыдущей спектрограммы на оси абсцисс отложены не длины волн, а волновые числа ν, которые часто применяют в инфракрасной спектроскопии. Между длиной волны и волновым числом (см‾ ) существует простое соотношение:
1
ν ═ —
λ
Как видно из рис. II-21, по характеру спектрограмм изомеры легко отличимы друг от друга.
Количественный анализ в инфракрасной части спектра имеет небольшое применение. В принципе, он не отличается от анализа в области видимого и ультрафиолетового спектра. Содержание того или другого компонента при количественном анализе определяется значением поглощения в области, характерной для данного компонента.
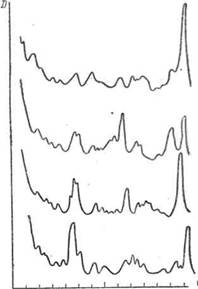
Рис. 9 — Спектрограммы изомеров октана
2.1 Аппаратура
В любой колориметрической или фотометрической аппаратуре различаются следующие основные узлы:
- монохроматизатор света;
- кюветы;
- узел определения интенсивности света.
Узел источника света состоит из собственного источника света, стабилизатора напряжения ив некоторых случаях контрольных приборов — амперметра и вольтметра для контроля постоянства силы тока и напряжения. В некоторых простейших конструкциях колориметров, например КОЛ-52, фотометр ФМ и др., стабилизаторы и контрольные приборы отсутствуют. В качестве источников света в зависимости от используемой области спектра применяют различные приборы. Для получения света далекой ультрафиолетовой области 220-230 им используют водородную лампу или лампу накаливания для области близкого ультрафиолета и видимой части спектра 320-800 нм. В иностранных спектрофотометрах для этой цели применяют вольфрамовые и дейтериевые разрядные лампы.
Для получения света видимой области спектра применяют обычные _лампы накаливания. Для получения света инфракрасной области спектра применяют глобар-стержень из карбида кремния или штифт Нернста — стержень из смеси окислов редкоземельных элементов. Эти стержни при накаливании их электрическим током до 1200-2000 °С испускают интенсивный поток инфракрасных лучей. При всех фотометрических измерениях необходим устойчивый поток световых лучей. Это обеспечивается в первую очередь стабильным режимом накаливания. Поэтому лучшие модели фотометрических приборов обязательно снабжены стабилизаторами напряжения, налагаемого на источник лучистого потока. Контроль за работой стабилизатора, как упоминалось выше, целесообразно вести путем измерения силы тока, проходящего через осветитель, или напряжения, которое на него подается. В некоторых случаях, когда эти приборы отсутствуют в фабричных моделях, их подсоединяют дополнительно. Кроме того, за стабильностью работы осветителя можно наблюдать и при помощи узла определения интенсивности света.
Только самые простые колориметры для видимой части спектра, как колориметр погружения (Дюбоска), не снабжены приспособлением для монохроматизации света. Во всех остальных этот важный узел имеется. Монохроматизация света может быть осуществлена при помощи:
- светофильтров;
- призм;
- дифракционных решеток.
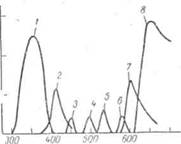 T,%
T,%
Рис. 10 — Спектральные характеристики светофильтров: 1 — максимум при 360 нм; 2 -максимум при 415 нм; 3 — максимум при 455 нм; 4-максимум при 500 нм; 5 — максимум при 540 нм; 6 — максимум при 580 нм; 7 -максимум при 610 нм; 8-максимум при 660. нм
2.2 Светофильтры
Светофильтра ми называются среды, способные пропускать лишь определенные области спектра. Обычно в фотоколориметрах используются в качестве светофильтров стекла.
На рис. П-24 приведены спектральные характеристики светофильтров, которыми снабжают некоторые отечественные фотоколориметры.
Зная максимум поглощения вещества, можно выбрать такой светофильтр, который пропускал бы только лучи, поглощаемые раствором, и задерживал бы все остальные, как это показано на рис. II-14, где максимум пропускания светофильтра совпадает с максимумом поглощения раствора. Чаще всего удается только приблизительно выделить при помощи светофильтра нужную область спектра.
В фотометрическом анализе применяются также интерференционные светофильтры. Они изготовляются из слоя фторида магния, покрытого полупрозрачной серебряной пленкой. Луч света проходя через такой светофильтр, многократно отражается от
Таблица 2 — Таблица дополнительных цветов
|
Окраска исследуемого раствора |
Приблизительная область длины волн, нм |
Окраска подходящего светофильтра |
Приблизительная область длины волн, нм |
|
Фиолетовая Синяя Зелено-синяя Сине-зеленая Зеленая Желто-зеленая Желтая Оранжевая Красная |
400-450 450-480 480-490 490-500 500-560 560-575 575-590 590-625 625-750 |
Желто-зеленая Желтая Оранжевая Красная Пурпурная Фиолетовая Синяя Зелено-синяя Сине-зеленая |
560 — 575 575 — 590 590 — 625 625 — 750 — 400 — 450 450 — 480 480 — 490 490 — 500 |
серебряной пленки и в результате интерференции через светофильтр проходят лучи только узкой полосы спектра. Спектральные характеристики интерференционных светофильтров приведены на рис. II-25. Как видно из рисунка, такие светофильтры
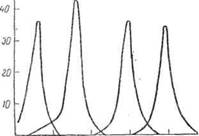
Рис. 11 — Спектральная характеристика интерференционных светофильтров различной толщины
обладают более узкой полосой пропускания и большим пропусканием, чем окрашенные светофильтры (см. рис. 11).
Изменяя толщину интерференционного светофильтра, можно изготовить фильтр с любой спектральной характеристикой.
Повышение чувствительности фотоколориметрического анализа в результате применения светофильтров характеризуют калибровочные кривые для определения содержания ТiO2. Как видно из рисунка, применение синего светофильтра значительно повышает чувствительность определения.
Для более тонкого выделения необходимого участка спектра служат призмы или дифракционные решетки. В этом случае, поворачивая призму или решетку соответствующей, установкой диафрагмы, выделяют пучок лучей с нужной длиной волны, который и направляется на кювету.
Большое значение имеет материал, из которого изготовлены призмы и вся оптика прибора, он должен хорошо пропускать соответствующую область спектра. Кварцевыми призмами и оптикой для работы в ультрафиолетовых и видимой областях спектра снабжены отечественные приборы: СФ-4, СФ-44, СФ-9 и другие, иностранные приборы: VSU-2 (Цейсс — ГДР), Unicam SР (Англия) и другие.
Стеклянными призмами и оптикой для работы только в видимой части спектра снабжены отечественные приборы: СФ-5, СФ-10 и другие, иностранные приборы: SpecoI (Цейсc — ГДР).
Для работы в инфракрасной области спектра необходимо’ применять призмы и оптику из материалов, пропускающих инфракрасные лучи. Такими материалами являются соли галогенов: фторид лития — до 6000 нм, фторид кальция — до 10 000 нм, хлорид натрия — до 15 000 нм, бромид калия до 25000 нм, бромид цезия до 40 000 нм. Набором таких призм для более полного охвата всей области инфракрасного излучения снабжены отечественные приборы: ИКС-11, ИКС-14, иностранные приборы: UR-10 (Цейсc -ГДР), S-25 (фирма Нuet Оnora, Франция) и др.
В некоторых конструкциях, например в монохроматоре СФ-9,. применяется двойная монохроматизация. Сначала световой поток мо-нохроматизируется при помощи кварцевой призмы, а затем более тонкая монохроматизация достигается при помощи дифракционной решетки.
В узел монохроматизации входят также ряд линз для усиления пучка света, диафрагмы для выделения узкого пучка монохроматического света, зеркала и призмы для изменения направления светового пучка и другие детали, не имеющие принципиального значения. Сюда же относятся механизмы для поворота призм и решеток. В некоторых конструкциях они связаны с самописцами для записи фототоков, благодаря чему в процессе измерения оптической плотности получают одновременно спектрофотометрическую кривую зависимости оптической плотности от длины волны.
Кюветы. Узел кювет наименее сложный по устройству. Кюветы должны быть изготовлены из материала, хорошо пропускающего лучи света, интенсивность которых измеряется. Для лучей видимой области спектра — это стекло, для ультрафиолетовых лучей — кварц. При работе с инфракрасными лучами применяют кюветы со стенками из оплавленного хлорида серебра, часто вместо растворов исследуемых веществ применяют таблетки из этих веществ с бромидом калия. Кюветы бывают самых разнообразных форм: прямоугольные, цилиндрические, в виде пробирок, кюветы с быстрым удалением исследуемого раствора и другие.
Фотоэлементы. Важной деталью любого спектрофотометрического прибора является узел оценки интенсивности светового потока. Интенсивность светового потока определяется в абсолютных единицах и относительных единицах, когда сравниваются интенсивности двух потоков. Первый метод используется в однолучевых фотометрах, второй — в двулучевых. В соответствии с этим в узел оценки интенсивности входит один или два приемника световых потоков — фотоэлемента. В некоторых промышленных фотометрах световые потоки при помощи специального прибора — обтюратора поочередно попадают на один фотоэлемент и фиксируются им. Очень важно для получения хороших результатов при фотометрическом анализе выбрать наиболее подходящий фотоэлемент. Этот выбор, прежде всего, осуществляется по спектрофотометрической кривой фотоэлемента. Максимум этой спектрофотометрической кривой должен быть или вблизи волны света, проходящего через анализируемый раствор, или совпадать с ней. Спектрофотометрические кривые некоторых фотоэлементов. Второй важной характеристикой фотоэлемента является его чувствительность, измеряемая в микроамперах на люмен. Медно-закисный, цезиевый вакуумный фотоэлементы имеют чувствительность 20-100 мкА/лм, сернистосеребряный 2000 мкА/лм.
Применение фотоэлементов ограничено красной границей, которая лежит примерно около 1200 нм. В инфракрасной области в качестве приемников теплового излучения применяются термоэлементы или термостолбики.
Диафрагмы. В узел оценки интенсивности светового потока входят также различного типа диафрагмы для ослабления светового потока (оптическая компенсация).
В некоторых случаях для постоянного ослабления светового потока применяют постоянные диафрагмы, представляющие собой пластинки с вырезанными в них отверстиями разного диаметра. Чаще применяют диафрагмы с плавным изменением площади отверстия, снабженные соответствующей шкалой, характеризующей размеры отверстия. Отсчет по шкале диафрагм служит аналитическим показателем концентрации определяемого вещества. В некоторых случаях шкала диафрагм делается не равномерной, а пропорциональной оптической плотности, а следовательно, и определяемой концентрации.
В некоторых типах приборов вместо оптической применяют электрическую компенсацию токов гальванометра, которая также пропорциональна оптической плотности и определяемой концентрации.

Автоматические фотоколориметры. Фотометрический метод анализа широко используется в целях автоматического контроля производства. На рис. II-34 приведена схема автоматического фотоколориметра. Работа прибора осуществляется по командам
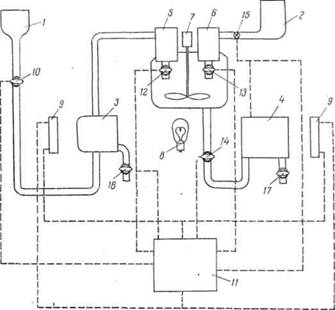
Рис. 13 — Схема автоматического фотоколориметра: 1 — сосуд для реагирующего раствора; 2 -сборник для исследуемого раствора; 3 — кювета сравнения; 4 — измерительная кювета; 5 — сосуд для дозирования реагента; 6- сосуд для дозирования исследуемого раствора; 7 -мотор с мешалкой; 8 — осветитель; 9 — фотоэлементы; 10,12 — 17 — краны; 11- командное устройство
командного устройства 11, действующего во времени по заданной программе. В. определенный момент по сигналу командного устройства открывается кран 10 и реагент из сосуда / заполняет кювету сравнения 3 и сосуд 5. По следующему сигналу открывается кран 15 и исследуемый раствор из сборника 2 заполняет сосуд’ 6. По следующему сигналу открываются краны 12 и 13, реагент и исследуемый раствор сливаются и перемешиваются мешалкой, вращающейся включаемым при этом мотором 7. После времени, достаточного для того, чтобы прошла реакция образования окрашенного соединения, сигналом командного устройства выключается мотор мешалки, открывается кран 14 и окрашенный раствор поступает в измерительную кювету 4.
Луч света от осветительной лампочки 8 проходит с одной стороны через кювету сравнения 3, заполненную реагентом, а с другой стороны — через исследуемый окрашенный раствор в кювете 4 и попадает на два фотоэлемента 9. Фототоки от них поступают в командное устройство, компенсируются и сигнал, характеризующий концентрацию исследуемого раствора, подается на самописец. После этого подается сигнал на краны 16 и 17,

Рис. 14 — Образец записи автоматического фотоколориметрического газоанализатора на содержание N0 и N02
через которые раствор из кювет выливается, и аппарат готов к1 очередному циклу замера.
Другие конструкции автоматических фотоколориметров сложнее, но отличаются они в основном деталями, а не принципом работы.
Для контроля отходящих газов башенного производства серной кислоты предложен автоматический фотоколориметр, в котором один фотоэлемент определяет окраску газа, вызываемую присутствием N02, а второй фотоэлемент определяет окраску газа после окисления N0 до N02. Таким образом, показания первого фотоэлемента соответствуют содержанию N02, а второго- сумме N02 + N0. На рис. II-35 приведена запись автоматического газоанализатора, действующего по этой системе.
3. Практика фотометрических методов
фотометрия хлороформный колориметрический титрование
Фотометрические методы анализа в самых разнообразных вариантах широко применяются как для контроля производства, так и для исследовательских работ.
Сравнительно немногие ионы обладают собственной окраской в видимой области спектра, поэтому широкое применение находят различные органические реактивы, способные давать достаточно интенсивно окрашенные соединения с ионами данного элемента. Не меньшее значение имеет фотометрический анализ и для определения органических веществ (табл. II-6).
Отразить все возможности фотометрического определения органических веществ весьма сложно, поэтому приведенная таблица служит только примером широких возможностей этого метода.
Таблица 2 — Фотометрические методы определения органических соединений
|
Тип реакции |
Реакция образования окрашенных соединений |
Определяемые вещества |
|
Образование азосоединений |
Диазотирование амина и сочетание его с фенолами или другими аминами Гидролитическое расщепление с образованием аминов с последу — ющим их диазотированием и сочетанием Восстановление нитропроизвод-ных до аминов с последующим диазотированием и сочетанием Диазотирование фенолов |
Анилин, толуидин, ами-носоединенип Ацетанилид, фенацетин Нитробензолы,нитротолуолы, нитронафталин, бензойная кислота, кокаин Фенолы, крезолы, нафтолы |
|
Образование хинониминовых соединений Образование полиметиновых соединений Образование ациформ нитросоеди- нений Образование продуктов конденсации с карбонильными соединениями Образование продуктов конденсации с карбонильными соединениями Образование продуктов окисления- восстановления Реакции с неорганическими ионами |
Сочетание с солями диазония Окисление фенолов и аминов с образованием индофенолов Реакция с 2,6-дибромхинонхлор-имином Реакция с 1,2-нафтохинон-4-суль-фокислотой Нитрозирование Образование солей пиридиния и затем производных глутаконового альдегида Образование глутаконового альдегида действием бромистого циана Реакция фурфурола с ароматическими аминами Реакции полиметиновых соединений Действие щелочей Реакция с динитрофенилгидрази- ном Реакция полинитросоединений со щелочью Реакция альдегидов и кетонов с первичными аминами Реакции альдегидов с метилкетонами Реакции альдегидов с нингидрином Реакции альдегидов с антроном и пирролом Реакция альдегидов с фенолами Реакция конденсации альдегида с карбонильными соединениями Реакции восстановления определяемых веществ Реакции восстановления определяемым веществом Реакции окисления определяемых веществ (реагенты-К2СrO4, КМnO4, FеС13, Вr2 и др.) Реакции образования окрашенных соединений с солями А13+, Fе3+, Сu2+ и др. |
Кетоны, ацетон, альдегиды, формальдегид Фенолы, нафтолы, крезолы Крезол, нафтол, фенон Амины, аминокислоты Фенолы, крезолы Хлороформ, четырех- хлористый углерод, лимонная кислота, хлорбензол, никотин Пиридин, никотиновая кислота, хлорпикрин Фурфурол Дихлорэтан Нитрофенолы, пикриновая кислота Фурфурол, ацетон Динитрокислоты,динитротиофен, бензол, вторичные амины Аминоуксусная кислота, ванилин, кетоны, альдегиды Ацетон, фурфурол, ванилин Аминокислоты Крахмал, целлюлоза, индол Формальдегид, ванилин, ментол Высшие спирты, гликоли, резорцин Нитробензол Сахара Анилин, бензидин, оксимы, танины Многие органические соединения |
Большое распространение получил фотометрический метод и в контроле производства. Можно сказать, что среди других физико-химических методов это один из самых распространенных методов. Его распространение связано со сравнительной простотой аппаратуры и самого метода и широкими его возможностями. Следует немного остановиться на общих принципах разработки и проверки отдельных фотометрических методов. Проверка любой реакции, дающей окрашенный продукт с определяемым ионом или соединением, состоит
Построения спектрофотометрической кривой в видимой и ультрафиолетовой областях спектра. Построение спектрофотометрической кривой позволяет исследователю выбрать наиболее подходящую область длин волн, для которых наблюдается наибольшее поглощение и, следовательно, где можно ожидать максимальной чувствительности определения. По спектрофотометрической кривой может быть выбран подходящий светофильтр для видимой области спектра и наиболее подходящий по характеристике фотоэлемент. Спектрофотометрическая кривая дает возможность в ряде случаев выбрать условия для подавления вредного влияния посторонних веществ, которые могут быть в анализируемом растворе. По данным спектрофотометрирования при выбранной оптимальной длине волны, зная толщину фотометрируемого слоя и концентрацию исследуемого раствора, можно определить молярный коэффициент поглощения исследуемого вещества. Обычно желательно это определение делать при нескольких отличающихся концентрациях и определять среднее значение молярного коэффициента поглощения, по величине которого можно судить о чувствительности метода.
Определение оптимальных условий проведения фотометрической реакции. На этом этапе выясняется влияние на фотометрическую реакцию основных факторов: времени, рН раствора, температуры и других условий. Для выяснения влияния времени исследуемый окрашенный раствор выдерживают в кювете фотоколориметра несколько часов, периодически измеряя его оптическую плотность. График изменения оптической плотности во времени позволяет выбрать время получения наиболее стабильных и достаточно высоких значений оптической плотности. Этот период времени является стандартным для проведения данной реакции.
Для исследования зависимости влияния на реакцию и окраску рН проводят, если это возможно, реакцию на фоне различных буферных растворов при разных рН. Однако в ряде случаев проведение реакции на фоне буферных растворов невозможно, так как сами компоненты буферной смеси влияют на окраску. В этом случае рН изменяют, осторожно добавляя разбавленные растворы хлористоводородной кислоты и гидроокиси натрия, с последующим контролем рН потенциометрически или при помощи индикаторных бумажек. Как и в первом случае, за изменением оптической плотности следят по мере изменения рН раствора. Иногда целесообразно исследовать и устойчивость во времени при данном рН. Это связано с тем, что устойчивость окраски при разных рН может сильно меняться. Проведение таких опытов позволяет выбрать оптимальное значение рН, при котором оптическая плотность достигает максимального значения и достаточно устойчива во времени.
Температура сравнительно мало влияет на окраску соединений, особенно в интервале 15-35С, в котором обычно проводятся фотометрические измерения. Однако в некоторых случаях, например при разработке термоспектро-фотометрических методов анализа, эти исследования очень важны. Термометрические исследования необходимо проводить в термостатированных кюветах, в наружную оболочку которых непрерывно поступает из термостата вода с определенной температурой. Следует отметить, что температура в наружной оболочке кюветы будет всегда несколько отличаться от температуры воды термостата, и поэтому ее необходимо измерять непосредственно в оболочке кюветы точным термометром. Измеряя температуру, следят во времени за изменением оптической плотности и по полученным данным строят график зависимости оптической плотности от температуры.
В некоторых случаях целесообразно такие измерения провести при различных концентрациях определяемого иона, при различных рН. На основании полученных данных определяют относительный температурный коэффициент оптической плотности. При этом обычно все измерения относят к оптической плотности при 20 С.
При колориметрических реакциях большое значение имеет концентрация реагентов, и даже порядок их приливания. Однако общие рекомендации по изучению этих факторов дать трудно. Для многих фотометрических реакций эти факторы достаточно хорошо изучены, чего нельзя сказать о новых фотометрических реакциях. Это заставляет при проверке и применении новых фотометрических реакций подходить к ним очень осторожно. Проведение описанных исследований позволяет установить оптимальные условия проведения данной фотометрической реакции, при которых получается устойчивая, достаточно большая оптическая плотность. В дальнейшем все измерения проводят в условиях, найденных в процессе описанных исследований.
Фотоколориметрические определения. При работе на фотоколориметре с одним фотоэлементом заранее приготовляют раствор-фон, содержащий все добавляемые вещества, кроме определяемого, и проведенный через все операции определения.
Подбирают подходящий светофильтр и устанавливают его в гнездо фотоколориметра.
Раствор-фон наливают в кювету и устанавливают ее в фотоэлектрический колориметр. Реостатом осветителя или диафрагмой регулируют интенсивность светового потока так, чтобы стрелка,гальванометра стала на определенное условное деление.
После настройки фотоколориметра приступают к построению калибровочной кривой. Для этого приготовляют ряд растворов с известными концентрациями определяемого вещества. Последовательно наливают в кювету приготовленные растворы и определяют отклонения стрелки гальванометра. После каждого определения рекомендуется проверить постоянство начального отсчета-отклонение стрелки гальванометра для фона. Если обнаружено, что начальный отсчет изменился, следует найти причину этого изменения.
 Δ
Δ
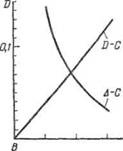
Рис. 15 — Калибровочные кривые для определения марганца: А -показания гальванометра; В-оптическая плотность
Если измерения идут нормально, то по полученным при разных концентрациях показаниям гальванометра строят калибровочный график. Калибровочные графики могут быть построены также по оптическим плотностям. Для построения калибровочного графика по оптической плотности определяют для каждой концентрации D по формуле
= Ig i0 — Ig I
где iо — показание стрелки гальванометра для фона;
- среднее значение отклонения стрелки гальванометра для раствора данной концентрации.
В качестве примера на рис. II-39 приведено два калибровочных графика фотоколориметрического определения марганца в сталях. График в системе координат Δ — С проще, при его помощи непосредственно по показанию Δ гальванометра определяется концентрация марганца. Однако он имеет и некоторые существенные недостатки. Из-за кривизны калибровочного графика точность определения на разных участках концентраций различна; построение такого графика требует нахождения многих точек. График в системе Δ — С требует предварительного логарифмирования отсчетов гальванометра и определения оптической плотности, это несколько усложняет его применение. Все же этому графику следует отдать предпочтение. При использовании его чувствительность определения остается одинаковой на всем протяжении исследуемых концентраций; для построения и проверки такого графика достаточно 3-5 точек.
Пользуясь калибровочным графиком, можно определить содержание того или иного вещества в неизвестном образце. При массовых измерениях необходимо периодически проверять калибровочный график по нескольким пробам с известным содержанием определяемого вещества. Если возникнут расхождения, следует найти причины их; причины расхождений могут быть те же, что и при непостоянстве начального отсчета.
Описанный способ работы на одноплечем фотоколориметре относится к способу пропорциональных отклонений. Если фотоколориметр снабжен калиброванной диафрагмой, то может быть использован способ равных отклонений. В этом случае готовят набор стандартных растворов, заполняют одним из них кювету, полностью раскрывают диафрагму, указатель ставят на деление, соответствующее максимальному значению, помещают кювету в гнездо фотоколориметра. При этом гальванометр отклонится до определенного деления, которое отмечают. Убрав затем кювету при помощи диафрагмы, доводят стрелку гальванометра до того же деления и отмечают показания шкалы диафрагмы. Измеряют поглощение остальных растворов и по полученным данным строят калибровочный график в системе концентрация — деления шкалы диафрагмы.
Одноплечие фотоколориметры находят небольшое применение в практике фотометрического анализа; значительно более распространены двуплечие фотоколориметры.
Работу дифференциальным способом на двуплечих фотоколориметрах типа ФЭК можно проводить в том случае, если в приборе имеются вывода для внешнего гальванометра, так как гальванометр, вмонтированный в прибор, является не измерительным, а нулевым прибором. При работе этим способом в правый и левый поток устанавливают кюветы, заполненные растворителем, и при помощи регулировочных’ клиньев измерительный гальванометр устанавливают на нуль. Затем правую кювету заменяют кюветой с одним из приготовленных стандартных растворов и отмечают отклонение стрелки гальванометра. Повторяют отсчет несколько раз и берут среднее значение отклонения. Затем повторяют эту операцию со следующим стандартным раствором. По значениям концентраций и отклонению гальванометра строят калибровочный график в системе концентрация- показания гальванометра.
В этом способе гальванометр играет роль измерительного прибора, и он должен быть особенно чувствительный.
Перед определением нулевым способом включают осветитель фотоколориметра, устанавливают светофильтр и через 10- 15 минут начинают измерения. В правый и левый световой поток устанавливают кюветы с фоном, при помощи регулировочных клиньев устанавливают стрелку гальванометра на нуль, переключают чувствительность гальванометра и проверяют установку при большей чувствительности. Затем заменяют кювету в правом световом потоке кюветой со стандартным раствором и при помощи измерительного барабана приводят стрелку гальванометра снова в нулевое положение, отсчитывают показания по шкале диафрагмы. Отсчет производят по оптической плотности или коэффициенту светопропускания. Способы отсчета описываются в инструкциях к приборам.
При работе дифференциальным способом может быть использован гальванометр или специальный индикатор, вмонтированный непосредственно в фотоколориметр.
К косвенному методу фотометрического определения относится метод фотометрического титрования. Он проводится в приборе типа ФЭТ-УНИИЗ — это простейший одноплечий фотоколориметр, в котором в качестве кювет служит стакан, снабженный магнитной мешалкой и бюреткой для титрования. Луч света от осветителя проходит через боковую стенку стакана и попадает на фотоэлемент, фототок которого регистрируется измерительным гальванометром. Процесс фотометрического титрования прост и достаточно подробно описан выше. В некоторых случаях можно не строить графика титрования, а визуально отмечать момент скачка стрелки гальванометра. При достаточном навыке точка эквивалентности определяется весьма точно.
Применение фотометрического метода ограничено определенным интервалом концентраций, в области которого обычно не наблюдается сильных отклонений от закона Бугера — Ламберта- Бера. Повышение определяемых концентраций может быть достигнуто использованием дифференциального спектрофотометрического метода. В этом методе окраска исследуемого раствора сравнивается не с окраской фона, а с окраской стандартного раствора, концентрация которого близка к концентрации определяемого раствора. Можно легко показать, что в этом случае калибровочный график не начинается от начала координат, а отсекает’ некоторые отрезки на оси концентраций. На рис. П-40 приведены калибровочные графики для определения железа в виде сульфосалицилатного комплекса. Кривая 1 снята с фоном в качестве раствора сравнения, кривая 2 с раствором сравнения концентрацией 0,115 мг/50 мл и кривая 3 с раствором сравнения концентрацией 0,231 мг/50 мл. Как видно из рисунка, применение метода дифференциальной спектрофотометрии значительно расширяет предел определяемых концентраций.
В дифференциальном спектрофотометрическом методе можно использовать и метод добавок. В этом случае помещают в колбы, содержащие V известного раствора анализируемого вещества, в первую-Vа неизвестного раствора, в другую -Vь неизвестного раствора и в третью- Vст известного стандартного раствора концентрации Сст. Последний раствор служит раствором сравнения, относительно которого измеряют оптические плотности первого D1 и второго D2 растворов. Для этих растворов составляют соответствующие уравнения:х Vcт Cст
D1 = εb ( — — — )VCх Vcт Cст
D2 = εb ( — — —)
решая которые, получаем:т Cст (D2 — D1)х = εb ——-(II — 22)Va — D1 Vb

Рис. 16 — Калибровочные графики для определения железа в виде сульфосалицилатного комплекса дифференциальным спектрофотометрическим методом
Как будет показано ниже, дифференциальный спектрофотометрический метод обладает повышенной точностью по сравнению с обычным фотометрическим методом.
В практике фотометрического метода применяется также термоспектрофотометрический метод анализа. В этом методе используется изменение оптической плотности раствора окрашенного вещества под действием температуры и рН (рис. II-41).
В зависимости от природы фотометрируемого вещества кривая зависимости оптической плотности от рН с изменением температуры может оставаться неизменной (кривая а), может сдвигаться в область повышенных рН (кривая б) или в область пониженных рН (кривая в).
Это может быть использовано для разделения веществ, обладающих максимумом поглощения при близких длинах волн и почти одинаковым рН. На рис. П-42 в качестве примера приведены кривые оптической плотности растворов окрашенных соединений алюминия и галлия с алюминоном в зависимости от рН при разных температурах. При 20 °С максимум поглощения обоих растворов возникает при близком значении рН и поэтому раздельное определение этих веществ невозможно. При повышении температуры максимум поглощения соединения алюминия сдвигается очень немного в сторону
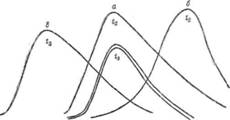
Рис17 — Кривые зависимости оптической плотности растворов от рН при разных температурах
меньших значений рН, а максимум соединения галлия сдвигается очень сильно. Определяя теперь разность оптических.
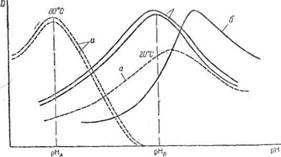
Рис. 18 — Кривые зависимости оптической плотности растворов от рН при разных температурах: а — соединений галлия; б-соединений алюминия
плотностей в точках рНА и рНв при 80 и 20 СС, можно составить, два уравнения, решая которые можно определить концентрации алюминия и галлия в исследуемом растворе. Этот метод требует строгого термостатирования исследуемых растворов и строгого соблюдения их рН
Одной из важных областей применения фотометрического анализа является определение концентрации водородных ионов, или определение рН растворов.
При определении рН пользуются методами с применением следующих реагентов:
- двухцветный индикатор и буферный раствор;
- двухцветный индикатор без буферного раствора;
- одноцветный индикатор без буферного раствора.
Все эти методы могут быть использованы в визуальной колориметрии и в фотометрическом анализе. Первые два метода чаще применяют в визуальной колориметрии, а последний в фотометрическом анализе.
Таблица 3 — Двухцветные индикаторы
|
Название |
Интервал перехода рН |
Изменение окраски индикатора |
|
Тимоловый синий Бромфеноловый синий Метиловый красный Бромтимоловый синий Крезолопый красный Крезолфталеин |
1,2-2,8 3,0-4,6 4,4-6,2 6,0-7,6 7,2-8,8 8,2-9,8 |
Красная — желтая Желтая — синяя Красная — желтая Желтая — синяя Желтая — красная Бесцветная — красная |
Испытывая последовательно каждым из этих индикаторов исследуемый раствор, определяют ориентировочно концентрацию ионов водорода в нем. Для этой же цели можно с успехом использовать специальные индикаторные бумажки, ‘ меняющие свою окраску в широком интервале рН. Затем уже точно определяют рН следующим образом: выбирают соответствующий ряд буферных растворов и добавляют одинаковые количества индикаторов в буферные и в исследуемый растворы. Сравнивая интенсивности окраски, находят, с окраской какого буферного раствора совпадает окраска исследуемого раствора. Растворы с одинаковой интенсивностью окраски имеют одинаковые значения рН.
По второму методу определения рН с этими же индикаторами, но без буферных растворов, используют свойство индикаторов в определенном интервале рН изменять окраску так, что каждому оттенку окраски соответствует определенный рН.
Для определения оттенков в две пробирки с кислой и основной средами добавляют различные количества индикатора и наблюдают свет, проходящий через обе пробирки. Окраска проходящего света зависит от соотношения концентраций индикаторов в кислой и щелочной средах. Меняя ее, можно получить оттенки, соответствующие разным значениям рН.
Например, для метилового красного можно составить следующую шкалу:
Объем раствора индикатора, мл
в кислой среде . . . 9 8,5 8 7 6 5 4 3 2 1
в щелочной среде 1 1,5 2 3 4 5 6 7 8 9
рН . . . . . . . . . . 4,05 4,25 4,4 4,6 4,8 5,0 5,2 5,4 5,6 5,9
Для определения концентрации ионов водорода по третьему методу применяют одноцветные индикаторы. Эти индикаторы бесцветны в кислой среде и окрашены в щелочной среде. Ряд одноцветных индикаторов приведен в табл. II-9.
У этих индикаторов в соответствующих интервалах рН изменяется оптическая плотность. На рис. II-43 представлена кривая изменения окраски для n-нитрофенола в зависимости от концентрации ионов водорода. При составлении графика поглощение щелочного, наиболее интенсивно окрашенного раствора принято равным единице. Как видно из рис. II-43, относительное поглощение зависит, от концентрации ионов водорода. Если приготовить растворы, содержащие разные количества индикаторов, то интенсивность окраски таких растворов будет различна, что соответствует различным значениям рН.
Таблица 4 — Одноцветные индикаторы
|
Название |
Интервал перехода рН |
Окраска в щелочной среде |
|
a-Динитрофенол y-Динитрофенол n-Нитрофенол M-Нитрофенол Фенолфталеин |
2,8-4,4 4,0-5,4 5,6-6,7 6,8-8,4 8,2-10,0 |
Желтая » » » Красная |
Ниже приведены значения рН растворов, содержащих различные объемы 0,1 н. раствора карбоната натрия, и n-нитрофенола:
Объем раствора индикатора, мл . . . . 4,05 3,0 2,0 1,4 0,94 0,63 0,40 0,25
Объем раствора Na2CO3,мл . . . . . . 2,95 4,0 5,0 5,6 6,06 6,27 6,60 6,75
РН . . . . . . . . . . . . . . . . . . . . 7,0 6,8 6,6 6,4 6,2 6,0 5,8 5.6
Добавляя к исследуемым растворам по 1 мл раствора индикатора, сравнивают полученную окраску с окраской данного ряда и по совпадающим окраскам находят значение рН исследуемых растворов.
Особо точные результаты определения рН могут быть получены с применением спектрофотометра.
Фотометрические реакции описаны почти для всех катионов и анионов, в подавляющем большинстве эти реакции обладают высокой чувствительностью. Многие реагенты дают фотометрические реакции с рядом ионов. В качестве примера в табл. П-10 приведены данные для реакций алюминона с различными ионами.
Таблица 5 — Условия реакции алюминона с разными ионами
|
Ион |
Интервал рН взаимо- действия |
Окраска аналитиче- ской формы — |
Чувстви- тельность, м к г/мл |
Ион |
Интервал рН взаимо- действия |
Окраска аналитиче- ской формы |
Чувстви- тельность. мкг/мл |
|
M0O42- Сr3+ ТhIV Sn2+ V02+ UO2²+ АI3+ Fе3+ Се3+ ТiIV |
1-4 2-5,5 2-7 2-7 2-7 2-7 2-9 2-9 2-9 2-11 |
Малиовая Красная Розовая » Малиовая То же » Фиоле-товая Красная» |
25 25 2 ─ 0,1 2,5 0,05 0,5 ─ 1,25 |
Сu2+ Ве2+ РЬ2+ Со2+ Zn2+ Мn2+ Cd2+ Ni2+ Мg2+ |
4 — 9 4 — 9 6 — 9 7 — 9 7 — 9 7 — 9 7 — 9 9 — 11 9 — 11 |
Малиовая Красная » » » » » » » |
0,5 0,25 ─ 50 ─ ─ ─ 0,5 0,5 |
Как видно из табл. II-10, алюминон способен давать окрашенные соединения с большим числом ионов, но регулируя рН среды, можно определять одни ионы в присутствии других. Например, молибден и хром могут быть определены в кислой среде в присутствии кобальта, цинка, никеля и некоторых других ионов. Помимо регулирования рН для фотометрического определения одного иона в присутствии других широко применяют реакции маскировки.
Определению ванадия при помощи алюминона мешают железо и хром, обычные спутники ванадия в сталях. Для определения ванадия в присутствии больших количеств железа и хрома последние связывают тиогликолевой кислотой в комплекс бледно-зеленого цвета и на этом фоне определяют ванадий по малиновой окраске с алюминоном. В литературе описано большое число реактивов, в основном органических, на отдельные ионы. Так, описано 16 различных азокрасителей, дающих реакцию с палладием.
Ошибки. Анализируя ошибки, возникающие при использовании визуальных колориметрических методов, можно сказать следующее. Применение метода стандартных серий, связанного с чувствительностью человеческого глаза к близким окраскам, дает ошибки порядка 15-20%. При применении метода дублирования ошибка связана с точностью отсчета по бюретке (1-3%)и той же величиной ошибки сравнения окрасок (15-20%).
В методе уравнивания сравнение окрасок значительно облегчается, и ошибка составляет около 4-8%.
ΔD,%
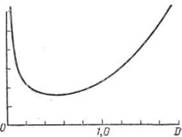
Рис. 19 — Зависимость относительной ошибки фотометрического анализа от оптической плотности
Таким образом, во всех колориметрических методах одним из основных источников ошибок является ошибка, возникающая при уравнивании окрасок. Поэтому особое внимание следует уделить условиям работы и предупреждению утомляемости глаза. Как упоминалось выше, значительные ошибки может дать неправильная подготовка проб к колориметрическому анализу. Отступления от метода подготовки пробы могут вызвать изменения окраски и, следовательно, ошибку определения. Эта категория ошибок одинаково влияет на определение при всех колориметрических методах. В большинстве случаев ошибка при отборе проб и взятии навесок меньше ошибок при всех последующих операциях и ею можно пренебрегать.
При фотометрическом анализе ошибка отсчета по шкале фотоколориметра сильно зависит от предела измеряемой оптической плотности. На рис. П-44 приведен график зависимости относительной ошибки в процентах от значения оптической плотности. .Как видно из графика, наименьшая ошибка наблюдается при оптической плотности в пределах 0,2-1,2. В этих пределах и рекомендуется строить калибровочный график и вести определения. Подбор указанного интервала оптических плотностей можно осуществить подбором кюветы для измерения и подбором раствора сравнения. Поэтому ошибка в методе дифференциальной фотометрии значительно меньше, чем в обычном фотометрическом анализе.
В подавляющем большинстве главным источником ошибок при фотоколориметрических определениях являются операции подготовки раствора к фотометрированию. Поэтому можно рекомендовать после отбора и растворения пробы делить раствор на 3 части, с каждой из которых проводить всё операции, предшествующие фотометрированию, и само фотометрирование.
Вывод
Фотометрические и спектрометрические методы анализа применяются для определения многих (более 50) элементов периодической системы, главным образом металлов. Методами абсорбционной спектрометрии анализируются руды, минералы, объекты окружающей среды, продукты переработки обогатительных и гидрометаллургических предприятий. Эффективно эти методы используется в металлургической, электронной областях промышленности, в медицине, биологии, криминалистике и т.д. Большое значение они имеют в аналитическом контроле окружающей среды и решении экологических проблем. Значительно расширились области практического применения методов абсорбционной спектроскопии благодаря более широкому использованию инфракрасной области спектра и приборов на базе ЭВМ. Это позволило разработать методы анализа сложных многокомпонентных систем без их химического разделения. Простые, быстрые и точные методы анализа имеют огромное значение для исследования различных реакций, установления состава и исследования различных химических соединений. Успехи химии координационных соединений, достижения микроэлектроники, приборостроения дают все основания ожидать дальнейшего повышения точности и чувствительности этих методов.
Литература
[Электронный ресурс]//URL: https://drprom.ru/kursovaya/fotometricheskoe-titrovanie/
1. Сендэл Е.Б. Колориметрическое определение следов металлов. Пер. с англ, под ред. В. Н. Прусакова. М. «Мир», 1964. 902 с.
2. Бабко А.К., Пилипенко А.Т. Фотометрический анализ. Общие сведения и аппаратура. М., «Химия», 1968. 386 с.
— Коренман И.М. Фотометрический анализ. Методы определения органических веществ. М., «Химия», 1970. 342 с.
— Булатов М.И., Калинкин И.П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам. М., «Химия», 1968. 378 с.
— Кеслер И. Методы инфракрасной спектроскопии в химическом анализе. Пер. с нем. под ред. М.М. Кусанова. М., «Мир», 1964. 286 с.
