Реакция Фриделя – Крафтса представляет собой типичное электрофильное замещение в ароматическом ядре, роль катализатора сводиться к генерации атакующей частицы алкилкатиона. ./ 1 , стр.352 /.
В общем виде для реагента Х схема будет выглядеть так:
Н
С 6 Н6 +Х+ С6 Н5 (медленно)
Х
Н
С 6 Н5 = С6 Н5 Х + Н+ (быстро)
Х /9,
Электрофильное замещение по своему механизму является полярным ступенчатым процессом. Реакции предшествует быстрое образование ?-комплекса, но стадией ,определяющей скорость реакции, является образование промежуточного карбениевого иона при ароматическом замещении ? -комплекса.
Электрофильное замещение (первая и вторая стадии):
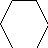
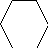
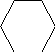
X

+ X
H
X
первая стадия вторая стадия
?-комплекс ?-комплекс
?-Комплекс – это катион, лишенный ароматической — электронами, делокализованными в сфере воздействия ядер пяти углеродных атомов. Шестой углеродный атом при образовании ? — комплекса переходит виз состояния sp в состояние sp , приобретая таким образом тетраэдрическую симметрию. Оба заместителя Х и Н лежат в плоскости, перпендикулярной к плоскости кольца.
+?
+ ?
+ ?
Образование ? — комплекса не требует большой затраты энергии, так как энергия сопряжения этой системы не очень сильно отличается от энергии сопряжения в бензольном кольце. ? — Комплекс- это не переходное, а настоящее промежуточное соединение, образование которого в некоторых случаях может быть доказано.
Классификация реакций алкилирования
... алкилированию. Этим реакция алкилирования значительно отличается от других процессов замещения в ароматическое ядро, например от хлорирования исульфирования. Правила ориентации при алкилировании в общем подобны другим реакциям электрофильного замещения ... активный каталитический комплекс целесообразно готовить предварительно и потом подавать на реакцию. Кроме НСl его образованию способствуют небольшие ...
При ароматическом замещении лабильный ? — комплекс превращается в стабильный замещенный бензол с потерей протона.
Электрофильное замещение (третья стадия):
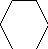
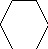
Х
Н Х + Н +
В каждом случае существует так же предварительная кислотно-основная реакция, генерирующая атакующую частицу. /9, стр. 342/
-
2.2.Побочные реакции
В ходе реакции могут образовываться полиалкильные продукты. Чтобы предотвратить полиалкилирование, обычно используют избыток алкилируемого ароматического соединения. /4, стр.247/
-
2.3.Влияние различных факторов на химический процесс:
2.3.1Влияние растворителей:
Чаще всего в качестве растворителя применяют сероуглерод, петролейный эфир и нитробензол для реакций, в которых в качестве катализатора используют кислоты Льюиса./6.стр.298/
В реакциях, в которых катализатором берут протонные кислоты, в качестве растворителя используют избыток ароматического углеводорода.
/5,
2.3.2.Влияние температуры:
Обычно реакцию проводят при комнатной температуре, а в случае сильного разогревания реакционную смесь охлаждают льдом. При повышении температуры увеличивается вероятность образования полиалкильных соединений. /4, стр.248/
При температуре 25 0 выход вещества составляет 70%, при повышении температуры на 300 выход продукта реакции падает до 10%.Это объясняется увеличением скорости побочных реакций и образованием полиалкильных продуктов./9,стр.37/
2.3.3Влияние алкилирующего агента.
Чаще всего в реакциях Фриделя-Крафтса в качестве алкилирующего агента используются галогензамещённые углеводороды, реже алкены, и ещё реже спирты. Реакция с галогензамещёнными углеводородами происходит быстрее всех.
2.3.4.Влияние катализатора
В реакции алкилирования применяют протонные кислоты, взаимодействуя с которыми олефины образуют карбокатионы.
Для реакции алкилирования олефинами бензола используют в качестве катализатора HF, фосфорную и 96%-ую серную кислоты.
Эффективным катализатором реакции Фриделя-Крафтса является полифосфорная кислота. /5,
Очень часто в реакциях алкилирования в качестве катализатора используют AlCl 3 .
Помимо AlCl 3 применяют галогениды других элементов, являющиеся кислотами Льюиса. Считают, что кислоты Льюиса — очень эффективные катализаторы реакций алкилирования.
Согласно Льюису, основание – это вещество, которое может представить свободную электронную пару для образования ковалентной связи, а кислота – это вещество, которое может принять электронную пару с образованием ковалентной связи./ 2,стр.34/.
Существует ряд кислот, которые применяют для алкилирования бензола, они расположены по порядку убывания силы:
AlCl 3 ›FeCl3 ›SnCl4 ›BF3 ›ZnCl2 ›SbF3 ›TiCl4 ›HgCl2 .
Ещё в данных реакциях применяют кислотные окислы и сульфиды, а так же катионнообменные смолы. /2,стр179/
В данной учебно-исследовательской работе было решено исследовать влияние катализатора на ход реакции, поэтому было решено проводить синтез с серной кислотой как классический опыт, с полифосфорной кислотой, которая упоминается, но не изучена и не указано никаких стандартов, что и явилось источником для изучения. Так же интересно посмотреть, как эти катализаторы повлияют на реакцию, если их использовать вместе. Кроме того, была сделана попытка исследовать влияние галогена (брома) в боковой цепи алкилирующего продукта на выход конечного продукта.
-
2.4.Анализ методик, описанных в литературе:
Найденные нами в литературе методики не отличаются особой сложностью в их проведении. Общим фактором всех методик является то, что все вещества, вступающие в реакцию должны быть сухими.
Ещё во всех методиках общим является то, что все авторы предупреждают о том, что данная реакция идёт с выделением тепла и алкилирующее средство нужно прикапывать при постоянном перемешивании и почти во всех методиках при охлаждении.
В данных методиках очень часто применяют такой катализатор, как AlCl 3 ,это методики №1 и№3. Из анализа этих методик можно сделать вывод, что при температуре, равной 250 ,в конечном итоге будет хороший предположительный выход вещества, а если повысить температуру примерно в 2 раза, выход вещества падает до 10%.
Так же в методиках в качестве катализаторов используют такие кислоты, как серная и плавиковая. Это методики №2 и №6.Из анализа методик видно, что при одинаковом процентном выходе продукта реакции, HF нужно взять в 2 раза меньше по сравнению с H 2 SO4 . Это говорит о том, что плавиковая кислота более эффективный катализатор.
2.5. Методики, описанные в литературе. Табл.1
|
№ п/п |
Реагент 1 |
Реагент 2 |
Ката-лиз-р |
t , 0 С |
Вре-мя (час) |
Выход |
Лит-ра |
|
1 |
Бензол 4 моль |
Циклогек-сен 1 моль |
AlCl 3 0,4 моль |
25-55 |
— |
10% |
9 Стр. 37 |
|
2 |
Бензол (избы-ток) |
Циклогек-сен 1 моль |
H 2 SO4 1 моль |
— |
0,5 |
70% |
|
|
3 |
Бензол 4,5 моль |
Циклогек-сен 1,5 моль |
AlCl 3 0,45 моль |
25 |
3 |
70% |
|
|
4 |
Бензол 4,5 моль |
Циклогек-сен 1,5 моль |
HF 0,45 моль |
0 |
— |
62% |
|
|
5 |
Бензол 3 моль |
Циклогек-сен 1 моль |
H 2 SO4 1 моль |
— |
2 |
62,5% |
7 Стр. 647 |
|
6 |
Бензол 1 моль |
3Br-цикло- гексен-1 1 моль |
H 2 SO4 1 моль |
Не выше 20 |
12 |
— |
8 Стр. 304 |
2.5.1.Вывод: выбор оптимальных условий.
На основе анализа найденных методик было решено положить в основу данной учебно-исследовательской работы методику №5, так как она предполагает хороший процентный выход исходного продукта и время реакции сравнительно небольшое, поэтому расход вещества на побочные реакции будет минимальный. Так же было решено поддерживать температуру реакции не выше 20 0 .В оригинале нас предупреждают о возможном образовании полиалкильных продуктов. Это происходит из-за недостатка ароматического углеводорода. В более поздней литературе был найден способ, как это предотвратить: нужно использовать избыток бензола /4, стр.247/. Поэтому было решено использовать в данном синтезе не 3 моля, а 6 молей бензола.
Так как данные загрузки предполагают большой расход вещество, то было решено уменьшить загрузки веществ в 10 раз.
-
3.ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
-
3.1.Схема установки синтеза.
-
Рис.1
1-реакционная колба; 2-кристаллизатор со снегом; 3-термометр;
4-капельная воронка; 5-мешалка.
-
3.2.Расчёт загрузок на одну установку.
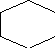
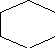
+ С 6 Н6 С6 Н5
0,1 0,1 0,1
3.2.1.циклогексен:
- М=82;
m=0,1*82=8,2гр,
V=m/?=8,2/0,81=10,2мл,
3.2.2. 3-бромциклогексен:
М=161,
m=0,1*161=16,1гр,
3.2.3.Бензол:
Берём шестикратный избыток.
М=78,
m=0,6*78=46,8гр.
V=46,8/0,88=53,2мл
3.2.4.Катализаторы:
3.2.4.1Серная кислота:
М=98,
m=0,1*98=9,8гр,
При анализе кислоты было установлено, что она имеет 95%-ую концентрацию.
В расчёте на 95%-ую кислоту:
Х — 100%
9,8 — 95%;
Х=10,31гр
3.2.4.2.Полифосфорная кислота:
М=176,
М(P 2 O5 )=142,
m=0,1*142=14,2гр.
При анализе ПФК было установлено, что она содержит 70% P 2 O5 ,было решено рассчитать, сколько её потребуется.
В расчёте на 70%-ую кислоту:
Х — 100%
14,2 -70%,
Х=20,28р)
Полученные расчёты оформляем в таблицу.
3.3.Количество исходных веществ на каждую установку. Табл.2
|
Установка №1 3Br-цикло-гексен, H 2 SO4 |
Установка №2 Циклогексен H 2 SO4 |
Установка №3 Циклогексен H 2 SO4 ПФК |
Установка №4 Циклогексен ПФК |
|
|
Бензол (гр) |
46,8 |
46,8 |
46,8 |
46,8 |
|
3Br-циклогексен (гр) |
16,1 |
— |
— |
— |
|
Циклогексен (гр) |
— |
8,2 |
8,2 |
8,2 |
|
Серная кислота (гр) |
10,31 |
10,31 |
5,16 |
— |
|
ПФК (гр) |
— |
— |
10,14 |
20,28 |
-
3.4.Ход работы
Описание операций и наблюдений. Табл.3
|
время |
Установка №1 (3Br-цикло-гексен, H 2 SO4) |
Установка №2 (Циклогексен, H 2 SO4 ) |
Установка №3 (Циклогексен H 2 SO4 ПФК) |
Установка №4 (Циклогексен ПФК) |
|
Сборка установок согласно рис.1 |
||||
|
11.00 |
Вносим в колбу бензол и катализаторы согласно табл.2. |
|||
|
11.15 |
Подключаем к установке капельную воронку с алкилирующим средством. |
|||
|
11.25 |
Включаем мешалку, открываем кран капельной воронки. |
|||
|
11.37 |
Бромциклогексен продолжает капать |
Циклогексен в воронке закончился |
Циклогексен продолжает капать |
Циклогексен продолжает капать |
|
11.42 |
Температура в колбе 16 0 С |
Температура поднялась до 40 0 С. Охлаждаем колбу. |
Температура в колбе 15 0 С |
Температура в колбе 15 0 С |
|
11.58 |
Бромциклогексен в воронке закончился. Температура 13 0 С |
Температура в колбе опустилась до 14 0 С |
Циклогексен в воронке закончился. Температура 13 0 С |
Циклогексен в воронке закончился. Температура 13 0 С |
|
11.58-13.25 |
Продолжаем перемешивать содержимое реакционной колбы. Температура во всех колбах понизилась до 5 0 С |
|||
|
13.25 |
Окончание синтеза. |
3.5.Выделение продукта.
Содержимое реакционной колбы переносим в делительную воронку, наливаем в неё 3%-ный раствор соды. Встряхиваем, даём смеси отстояться до чёткой границы разделения. Отделяем нижний неорганический слой от верхнего органического. Затем органическую фазу промываем водой до нейтральной среды (проверяем универсальным индикатором).
Далее в органическую фазу насыпаем прокалённый сульфат магния, чтобы удалить следы влаги.
После этого помещаем органическую фазу в перегонную колбу и освобождаемся от растворителя (бензола) простой перегонкой(см.3.6.).
3.6 Удаление растворителя.
Операции и наблюдения перегонки. Табл.4
|
время |
Установка №1 (3Br-цикло-гексен, H 2 SO4 ) |
Установка №2 (Циклогексен, H 2 SO4 ) |
Установка №3 (Циклогексен H 2 SO4 ПФК) |
Установка№4 (Циклогексен ПФК) |
|
Собираем установку согласно рис.2. |
||||
|
12.00 |
Включаем плитки. |
|||
|
12.40 |
Температура 80 0 С. Первая капля. |
|||
|
12.46 |
Температура 80 0 С. Первая капля. |
|||
|
12.51 |
Температура 80 0 С. Первая капля. |
|||
|
12.57 |
Температура 80 0 С. Первая капля. |
|||
|
Отгоняем растворитель до тех пор, пока температура в перегонной колбе не начнёт резко падать, после этого отключаем плитку и разбираем установку. |
||||
|
Масса вещества после перегонки растворителя (в гр ) |
||||
|
10,81 |
6,98 |
6,69 |
Перегонка прошла досуха |
-
3.7. Выход неочищенного продукта в процентах:
Установка №1:
Х — 239
16,1 – 161,
Х=23,9 гр-100%-ный выход с первой установки.
У% — 10,81
100% -23,9,
У=45,8%
Установка №2:
Х – 160%
8,2 – 82,
Х=16гр-100%-ный выход со второй установки;
У% -6,98
100% — 16;
У=43,6%
Установка №3
У%-6,69
100%-16;
У=41,8%
Установка №4:
Так как перегонка прошла досуха, то можно сделать вывод о том, что реакция не произошла, и конечных продуктов не образовалось. Это говорит о том, что данный катализатор не работает при данных условиях реакции.
-
3.8.Очистка конечного продукта.
Циклогексилбензол и 3-бромциклогексилбензол имеют очень высокие температуры кипения, поэтому в данных условиях очень трудно перегнать эти вещества без больших потерь, и выход очищенного вещества будет очень низкий.
3.8.1.Перегонка циклогексилбензола.
Собираем установку для быстрой перегонки согласно рис.3, зажигаем спиртовку, и, равномерно прогревая перегонную колбу, доводим до кипения, собираем фракцию (237-239 0 С).
Выход вещества составил
Со второй установки — 8,6% от теоретического.
С третьей установки — 7,8%
Показатель преломления полученного вещества:
Со второй установки 1,5248.
С третьей установки 1,5247
Литературные данные 1,5260
[Электронный ресурс]//URL: https://drprom.ru/kursovaya/proizvodnyie-benzola/
3.8.2.Перегонка 3-бромциклогексилбензола.
Собираем аналогичную установку, прогреваем колбу, доводим жидкость до кипения и собираем фракцию(210-212 0 С).
Выход вещества с первой установки составил 11,1%
Показатель преломления полученного вещества: 1,5164.
3.8.3.Техника безопасности с полученными веществами:
Полученные вещества относятся к классу ароматических соединений. Они представляют собой жидкости с характерным ароматическим запахом. При попадании на кожу раздражают её, пары в высоких концентрациях обладают более или менее выраженным наркотическим действием. Вызывают изменения в крови и кроветворных органах.
При работе с данными веществами применяют такие индивидуальные меры защиты, как халат, перчатки, маску./12,стр.64/
-
4.Обсуждение полученных результатов.
Исходя из результатов синтеза, можно сделать вывод о том, что:
- серная кислота является хорошим катализатором для данной реакции;
- поддерживаемая температура оказалась благоприятной для проведения реакции с катализатором-серной кислотой.
- взятого времени достаточно для проведения реакции.
-заместитель, т.е. бром в циклогексене благоприятно повлиял на выход исходного вещества. Это объясняется тем, что бром в боковой цепи вызвал повышенную активность двойной связи алкилирующего агента. Образующийся в ходе реакции комплекс стабилизирован бромом, так как при разрыве двойной связи образующийся заряд + компенсируется парными электронами брома. Комплекс более устойчив, это и увеличило выход вещества.
Br Br
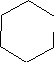
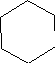
+ H +
- полифосфорная кислота в одиночку не катализирует данную реакцию при данных условиях.
- возможно, что полифосфорную кислоту можно применять в качестве катализатора для данной реакции, но в этом случае мы бы предложили поддерживать более высокую температуру в реакционной колбе.
-
5.2.Бензол
-
5.2.1.Физические свойства
-
Бензол — бесцветная жидкость с неприятным запахом, отрицательно влияет на человеческий организм: действует на нервную систему, кровеносную систему, слизистые оболочки, кожу. Особенно вредно работать с ним женщинам. Относят к ЛВЖ.
5.2.2Очистка (простая перегонка).
Для нашей реакции все вещества нужны сухие, поэтому мы проводили их перегонку над металлическим натрием.
Собираем установку согласно рис. 2..
Простая перегонка проводится на установке, в которую входят:
1)перегонная колба. В нашем случае это одногорлая круглодонная колба с насадкой Вюрца.
2)песочная баня
3)термометр, контролирующий температуру перегонки, его располагают на 0,5см ниже отростка насадки.
4)холодильник. В нашем случае используется холодильник с водяным охлаждением, так как температура перегоняемой жидкости ниже 140 0 С
5)аллонж, соединяющий холодильник с приёмником
6)приёмник, роль которого в простой перегонке может выполнить колба Эрленмейера, круглая плоскодонная колба.
В перегонную колбу нарезаем металлический натрий, затем наливаем в неё неочищенный бензол, включаем плитку и следим за термометром. В первый приёмник собираем дистиллят до тех пор, пока термометр не покажет температуру, равную 79-80градусов. В этом случае меняем грязный приёмник на чистый и начинаем собирать сухой бензол. Перегонку досуха не проводят. Когда в колбе останется небольшое количество вещества, перегонку прекращают. Плитку отключают и разбирают установку.
5.2.3.Расчёт выхода бензола.
230- 100%
211 – Х
Х=91,7%
5.2.4.Характеристика полученного продукта.
Сравнение показателей преломления. Табл.6
|
Показатель преломления отогнанного вещества |
Литературные данные [Электронный ресурс]//URL: https://drprom.ru/kursovaya/proizvodnyie-benzola/ |
|
1,5583 |
1,5588 |
Табл.
5.2.5.Техника безопасности.
При работе с ним используют такие индивидуальные средства защиты, как халат, перчатки, маску на лицо, при работе с большими количествами используют противогаз.
-
5.3.Циклогексен
-
5.3.1.Физические свойства.
-
Циклогексен — прозрачная жидкость, с водой образует азеотроп с температурой кипения 690С. При попадании на кожу вызывает зуд, изменения в крови, его воздействие на организм схоже с ароматикой.
5.3.2.Очистка (простая перегонка)
Очищают так же, как и бензол – перегонкой над металлическим натрием. Установка собирается такая же, как и для бензола согласно рис.2..
Ход работы для перегонки циклогексена аналогичен ходу работы для перегонки бензола.
5.3.3.Расчет выхода циклогексена
50гр – 100%
46гл – Х%
Х=92%
5.3.4.Характеристика полученного продукта
Сравнение показателей преломления. Табл. 7
|
Показатель преломления отогнанного вещества |
Литературные данные [Электронный ресурс]//URL: https://drprom.ru/kursovaya/proizvodnyie-benzola/ |
|
1,4450 |
1,4456 |
5.3.5.Меры по технике безопасности.
При работе с циклогексеном применяют такие индивидуальные средства, как халат, перчатки, маску.
Установка для простой перегонки.
Рис.2
1.плитка 2.песочная баня 3.перегонная колба 4.насадка Вюрца 5.водяной холодильник 6.аллонж с хлоркальциевой трубкой 7.приёмник
Установка для быстрой перегонки.
Рис.3
-
1.спиртовка 2.перегонная колба 3.насадка Вюрца
-
4.термометр 5.аллонж 6.приёмник
-
7.Список используемой литературы.
[Электронный ресурс]//URL: https://drprom.ru/kursovaya/proizvodnyie-benzola/
-
“Краткая химическая энциклопедия” Издательство иностранной литературы ,1961г.
-
Моррисон Р., Бойд Р. “ Органическая химия” Восток 1970г.
-
Петров А.А., Бальян Х.В. “Органическая химия”
-
Буянов В.Н. ,Жигачев В.Е. , Яресько Н.С. , Лаврищева Л.Н. Лабораторные работы по органической химии “Реакции галогенирования, Фриделя – Крафтса и нитрования” Москва 1977г.
-
“Препаративная органическая химия ” под ред. Вильямсона Н.С. Химия 1964г.
-
К.Ингольд “ Теоретические основы органической химии” Мир, 1973
-
Artur B. Lamb “Journal of the American chemical society.” “Influence of Cyclohexene concentration in the Alkylation of Benzene by Cyclohexene.” Выпуск 59, стр. 645-647 ,1937г
-
“Общий практикум по органической химии” под ред. Коста. Москва 1965г
-
“Органические реакции” сборник 3, под ред. Кочешкова, издательство иностранной литературы 1951г.
-
М.В.Горелик “ Основы химии и технологии ароматических соединений” Химия.1992г
-
Справочник “Свойства органических веществ” Химия 1984г
-
“Вредные вещества в промышленности” под ред. Н.З.Лазарева, Госхимиздат 1963г
