Газ всегда заполняет объём, ограниченный непроницаемыми для него стенками. Так, например, газовый баллон или камера автомобильной шины практически равномерно заполнены газом.
Стремясь расшириться, газ оказывает давление на стенки баллона, камеры шины или любого другого тела, твёрдого или жидкого, с которым он соприкасается. Если не принимать во внимание действия поля тяготения Земли, которое при обычных размерах сосудов лишь ничтожно меняет давление, то при равновесии давления газа в сосуде представляется нам совершенно равномерным. Это замечание относится к макромиру. Если же представить себе, что происходит в микромире молекул, составляющих газ в сосуде, то ни о каком равномерном распределении давления не может быть и речи. В одних местах поверхности стенки молекулы газа ударяют в стенки, в то время как в других местах удары отсутствуют. Эта картина всё время беспорядочным образом меняется. Молекулы газа ударяют о стенки сосудов, а затем отлетают со скоростью почти что равной скорости молекулы до удара. При ударе молекула передает стенке количество движения, равное mv, где m – масса молекулы и v — её скорость. Отражаясь от стенки, молекула сообщает ей ещё такое же количество движения mv. Таким образом, при каждом ударе (перпендикулярно стенке) молекула передаёт ей количество движения равное 2mv. Если за 1 секунду на 1 см 2 стенки приходится N ударов, то полное количество движения, переданное этому участку стенки, равно 2Nmv. В силу второго закона Ньютона это кол-во движения равно произведению силы F, действующей на этот участок стенки, на время t в течение которого она действует. В нашем случае t=1сек. Итак F=2Nmv, есть сила, действующая на 1см2 стенки, т.е. давление, которое принято обозначать р (причём р численно равно F).
Итак имеем
р=2Nmv
Ежу понятно, что число ударов за 1 сек зависит от скорости молекул, и числа молекул n в единице объёма. При не очень сжатом газе можно считать, что N пропорционально n и v, т.е. р пропорционально nmv2.
Итак, для того чтобы рассчитать с помощью молекулярной теории давление газа, мы должны знать следующие характеристики микромира молекул: массу m, скорость v и число молекул n в единице объёма. Для того чтобы найти эти микро характеристики молекул, мы должны установить, от каких характеристик макромира зависит давление газа, т.е. установить на опыте законы газового давления. Сравнив эти опытные законы с законами, рассчитанными при помощи молекулярной теории, мы получим возможность определить характеристики микромира, например скорости газовых молекул.
Законы идеальных газов
... молекулы, можно по третьему закону Ньютона ввести равные молекулы пристеночного слоя. Пусть P- средняя сила давления газа на стенку, а средняя сила, с которой молекулы пристеночного слоя втягиваются внутрь газа. Тогда идеальный газ ... стенками находятся две одинаковые молекулы 1 и 2, совершающие тепловое движение. Величина давления на стенки определяется суммарной кинетической энергией молекул ...
Итак , установим, от чего зависит давление газа?
Во-первых, от степени сжатия газа, т.е. от того от того, сколько молекул газа находится в определённом объёме. Например, накачивая шину или сжимая её, мы заставляем газ сильнее давить на стенки камеры.
Во-вторых, от того, какова температура газа.
Обычно изменение давления вызывается обеими причинами сразу: и изменением объёма, и изменением температуры. Но можно осуществить явление так, что при изменении объёма температура будет меняться ничтожно мало или при изменении температуры объём практически останется неизменным. Этими случаями мы сперва и займёмся, сделав предварительно ещё следующее замечание.
в состоянии равновесия.
Механическое равновесие означает, что не происходит движения отдельных частей газа. Для этого необходимо, чтобы давление газа было во всех его частях одинаково, если пренебречь незначительной разницей давления в верхних и нижних слоях газа, возникающей под действием силы тяжести.
Тепловое равновесие означает, что не происходит передачи теплоты от одного участка газа к другому. Для этого необходимо, чтобы температура во всем объеме газа была одинакова.
Зависимость давления газа от температуры
Начнем с выяснения зависимости давления газа от температуры при условии неизменного объема определенной массы газа. Эти исследования были впервые произведены в 1787 г. Шарлем. Можно воспроизвести эти опыты в Упрощенном виде, нагревая газ в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки.
0°С
Опыты подобного рода показали следующее:
1. Приращение давления некоторой массы газа при нагревании на 1° составляет определенную часть a того давления, которое имела данная масса газа при температуре 0°С. Если давление при 0°С обозначить через Р, то.приращение давления газа при нагревании на 1°С есть aР.
пропорционально приращению температуры.
2. Величина a, показывающая, на какую часть давления при 0°С увеличивается давление газа при нагревании на 1°, имеет одно и то же значение(точнее, почти одно и то же) для всех газов,, а именно(1/273)град -1 . Величину a называют термическим, коэффициентом давления. Таким образом, термический коэффициент давления для всех газов имеет одно и то же значение, равное (1/273)град-1 .
Давление некоторой массы газа при нагревании на
Следует иметь, однако, в виду, что температурный коэффициент давления газа, полученный при измерении температуры по ртутному термометру, не в точности одинаков для разных температур: закон Шарля выполняется только приближенно, хотя и с очень большой степенью точности.
Формула, выражающая закон Шарля.
Закон Шарля позволяет рассчитать давление газа при любой температуре, если известно его давление при 0°С. Пусть давление при 0°С данной массы газа в данном объеме есть p 0 , а давление того же газа при температуре t есть p . Приращение температуры есть t, следовательно, приращение давления равно ap0 t и искомое давление равно
P =p 0 +ap 0 t= p0 (1+at )= p0 (1+t/273) (1)
Универсальная газовая постоянная. Основные законы идеального газа (2)
... газа: pV = RT (для 1 моль газа) где R — универсальная газовая постоянная = pV/T Расчет показывает, что при атмосферном давлении 1 атм. = 101,3 кПа., объеме 1 моль газа = 22,4 л и абсолютной температуре ... 2 Учитывая, что средняя энергия молекул всех газов при нормальных условиях одинакова (давление газов одинаково), следовательно средняя скорость молекул газа увеличивается с его алсблютной температурй ...
Этой формулой можно пользоваться также и в том случае, если газ охлажден ниже 0°С; при этом t будет иметь отрицательные значения. При очень низких температурах, когда газ приближается к состоянию сжижения, а также в случае сильно сжатых газов закон Шарля неприложим и формула (1) перестает быть годной.
Закон Шарля с точки зрения молекулярной теории
Что происходит в микромире молекул, когда температура газа меняется, например когда температура газа повышается и давление его увеличивается? С точки зрения молекулярной теории возможны две причины увеличения давления, данного газа: во-первых, могло увеличиться число ударов молекул на 1 см 2 в течение 1 сек; во-вторых, могло увеличиться количество движения, передаваемое при ударе в стенку одной молекулой. И та и другая причина требует увеличения скорости молекул. Отсюда становится ясным, что повышение температуры газа (в макромире) есть увеличение средней скорости беспорядочного движения молекул (в микромире).
Опыты по определению скоростей газовых молекул, о которых буду говорить немного далее, подтверждают этот вывод.
Когда мы имеем дело не с газом, а с твердым иди жидким телом, в нашем распоряжении нет таких непосредственных методов определения скорости молекул тела. Однако и в этих случаях несомненно, что с повышением температуры скорость движения молекул возрастает.
Изменение температуры газа при изменении его объема. Адиабатические и изотермические процессы.
Мы установили, как зависит давление газа от температуры, если объем остается неизменным. Теперь посмотрим, как меняется давление некоторой массы газа в зависимости от занимаемого ею объема, если температура остается неизменной. Однако, прежде чем перейти к этому вопросу, надо выяснить, как поддерживать температуру газа неизменной. Для этого надо изучить, что происходит, с температурой газа, если объем его меняется настолько быстро, что теплообмен газа с окружающими телами практически отсутствует.
Произведем такой опыт. В закрытую с одного конца толстостенную трубку из прозрачного материала поместим ватку, слегка смоченную эфиром, и этим создадим внутри трубки смесь паров эфира с воздухом, взрывающуюся при нагревании. Затем быстро вдвинем в трубку плотно входящий поршень. Мы увидим, что внутри трубки произойдет маленький взрыв. Это значит, что при сжатии смеси паров эфира с воздухом температура смеси резко повысилась. Это явление вполне понятно. Сжимая газ внешней силой, мы производим работу, в результате которой внутренняя энергия газа должна была увеличиться; это и произошло—газ нагрелся.
Теперь предоставим газу расширяться и производить при этом работу против сил внешнего давления. Это можно осуществить. Пусть в большой бутыли находится сжатый воздух, имеющий комнатную температуру. Сообщив бутыль с внешним воздухом, дадим воздуху в бутыли возможность расширяться, выходя из небольшого. отверстия наружу, и поместим в струе расширяющегося воздуха термометр или колбу с трубкой. Термометр покажет температуру, заметно более низкую, чем комнатная, а капля в трубке, присоединенной к колбе, побежит в сторону колбы, что также будет указывать на понижение температуры воздуха в струе. Значит, когда газ расширяется и при этом совершает работу, он охлаждается и внутренняя энергия его убывает. Ясно, что нагревание газа при сжатии и охлаждение при расширении являются выражением закона сохранения энергии.
Скорость полета самолета и трубка Пито
... правильное название: приемники воздушного давления (ПВД). Они дают первичные данные в сложный комплекс системы воздушных сигналов. Трубки Пито в ... Она рассчитывается с использованием приборной скорости, давления воздуха и его температуры. При этом учитываются погрешности указателя приборной ... газов, то есть для воздуха. Его мы в дальнейшем и будем иметь ввиду. Схема классической трубки Пито Трубка ...
Если мы обратимся к микромиру, то явления нагревания газа при сжатии и охлаждения при расширении станут вполне ясными. Когда молекула ударяется о неподвижную стенку и отскакивает от нее, скорость, а следовательно, и кинетическая энергия молекулы, в среднем такова же, как и до удара о стенку. Но если молекула ударяется и отскакивает от надвигающегося на нее поршня, ее скорость и кинетическая энергия больше, чем до удара о поршень (подобно тому как скорость теннисного мяча увеличивается, если его ударить во встречном направлении ракеткой).
Надвигающийся поршень передает отражающейся от него молекуле дополнительную энергию. Поэтому внутренняя энергий газа при сжатии возрастает. При отскакивании от удаляющегося поршня скорость молекулы уменьшается, ибо молекула совершает работу, толкая отходящий поршень. Поэтому расширение газа, связанное с отодвиганием поршня или слоев окружающего газа, сопровождается совершением работы и приводит к уменьшению внутренней энергии газа.
Итак, сжатие газа внешней силой вызывает его нагревание, а расширение газа сопровождается его охлаждением. Это явление в некоторой мере имеет место всегда, но особенно резко заметаю тогда, когда обмен теплотой с окружающими телами сведен к минимуму, ибо такой обмен может в большей или меньшей степени компенсировать изменение температуры.
адиабатическими.
Возвратимся к вопросу, поставленному в начале главы. Как обеспечить постоянство температуры газа, несмотря на изменения его объема? Очевидно, для этого надо непрерывно передавать газу теплоту извне, если он расширяется, и непрерывно отбирать от него теплоту, передавая ее окружающим телам, если газ сжимается. В частности, температура газа остается достаточно постоянной, если расширение или сжатие газа производится очень медленно, а передача теплоты извне или вовне может происходить с достаточной быстротой. При медленном расширении теплота от окружающих тел передается газу и его температура снижается так мало, что этим снижением можно пренебречь. При медленном сжатии теплота, наоборот, передается от газа к окружающим телам, и вследствие этого температура его повышается лишь ничтожно мало.
изотермическими.
Закон Бойля — Мариотта
изотермический
Мы ставим, таким образом, вопрос: как связаны между собой объем и давление при изотермическом изменении состояния газа? Ежедневный опыт учит нас, что при уменьшении объема некоторой массы газа давление его увеличивается. В качестве примера можно указать повышение упругости при накачивании футбольного мяча, велосипедной или автомобильной шины. Возникает вопрос: как именно увеличивается давление газа при уменьшении объема, если температура газа остается неизменной?
Ответ на этот вопрос дали исследования, произведенные в XVII столетии английским физиком и химиком Робертом Бойлем (1627—1691) и французским физиком Эдемом Мариоттом (1620—1684).
Опыты, устанавливающие зависимость между объемом и давлением газа, можно воспроизвести: на вертикальной стойке , снабжённой делениями, находятся стеклянные трубки А и В, соединенные резиновой трубкой С. В трубки налита ртуть. Трубка В сверху открыта, на трубке А имеется кран. Закроем этот кран, заперев таким образом некоторую массу воздуха в трубке А. Пока мы не сдвигаем трубок, уровень ртути в обеих трубках одинаков. Это значит, что давление воздуха, запертого в трубке А, такое же, как и давление окружающего воздуха.
Рудничный воздух
... рудничного воздуха. Энергосберегающие системы кондиционирования воздуха шахт. Климаторегулирующие системы вентиляции на рудных шахтах в зоне многолетней мерзлоты. 2 2 Рудничная аэромеханика. Основные законы, понятия и определения. Основные физические характеристики воздуха (давление, ...
Будем теперь медленно поднимать трубку В . Мы увидим, что ртуть в обеих трубках будет подниматься, но не одинаково: в трубке В уровень ртути будет все время выше, чем в А. Если же опустить трубку В, то уровень ртути в обоих коленах понижается, но в трубке В понижение больше, чем в А.
Объем воздуха, запертого в трубке А, можно отсчитать по делениям трубки А. Давление этого воздуха будет отличаться от атмосферного на величину давления столба ртути, высота которого равна разности уровней ртути в трубках А и В. При. поднятии трубки В давление столба ртути прибавляется к атмосферному давлению. Объем воздуха в А при этом уменьшается. При опускании трубки В уровень ртути в ней оказывается ниже, чем в А, и давление столба ртути вычитается из атмосферного давления; объем воздуха в А соответственно увеличивается.
Сопоставляя полученные таким образом значения давления и объема воздуха, запертого в трубке А, убедимся, что при увеличении объема некоторой массы воздуха в определенное число раз давление его во столько же раз уменьшается, и наоборот. Температуру воздуха в трубке при наших опытах можно считать неизменной.
Подобные же опыты можно» произвести и с другими газами. Результаты получаются такие же.
Итак, давление некоторой массы газа при неизменной температуре обратно пропорционально объему газа (закон Бойля—Мариотта).
Для разреженных газов закон Бойля — Мариотта выполняется с высокой степенью точности. Для газов же сильно сжатых или охлажденных обнаруживаются заметные отступления от этого закона.
Формула, выражающая закон Бойля — Мариотта.
![]()
График, выражающий закон Бойля — Мариотта.
В физике и в технике часто пользуются графиками, показывающими зависимость давления газа от его объема. Начертим такой график для изотермического процесса. Будем по оси абсцисс откладывать объем газа, а по оси ординат—его давление.
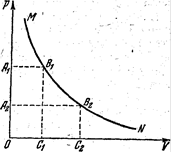
та.
кг/см 2 .
м 3 )
P (в кг1см 2 ) 3,6 1,8 1,2 0,9 0,72 0,6
Нанося эти данные на чертеж в виде точек, абсциссами которых являются значения V, а ординатами — соответствующие значения Р, получим кривую линию— график изотермического процесса в газе (рисунок выше).
Зависимость между плотностью газа и его давлением.
при изотермическом процессе давление газа изменяется прямо пропорционально его плотности.
Обозначив плотности газа при давлениях P1 и P2 буквами d1 иd2, можем написать:
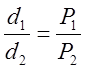
Механика жидкости и газа (2)
... свойствами воздуха и воды. Гидроаэромеханика работает фактически во всех отраслях деятельности человека. Законы механики сплошной среды. Механика ... примером поверхностной силы является давление – нормальное напряжение. Давление p в газе и жидкости создаётся за ... способного совершать работу, превосходящую необходимые для его функционирования затраты энергии). В основе закона сохранения энергии ...
Этот важный результат можно считать другим и более существенным выражением закона Бойля — Мариотта. Дело в том, что вместо объема газа, который зависит от случайного обстоятельства — оттого, какая выбрана масса газа,— в формулу (3) входит плотность газа, которая, также как и давление, характеризует состояние газа и вовсе не зависит от случайного выбора его массы.
Молекулярное толкование закона Бойля — Мариотта.
В предыдущей главе мы выяснили на основании закона Бойля — Мариотта, что при неизменной температуре давление газа пропорционально его плотности. Если плотность газа меняется, то во столько же раз меняется и число молекул в 1 см 3 . Если газ не слишком сжат и движение газовых молекул можно считать совершенно независимым друг от друга, то число ударов за 1 сек на 1 см2 стенки сосуда пропорционально числу молекул в 1 см3 . Следовательно, если средняя скорость молекул не меняется с течением времени (мы уже видели, что в макромире это означает постоянство температуры), то давление газа должно быть пропорционально числу молекул в 1 см3 , т.е. плотности газа. Таким образом, закон Бойля — Мариотта является прекрасным подтверждением наших представлений о строении газа.
Однако, закон Бойля — Мариотта перестает оправдываться, если перейти к большим давлениям. И это обстоятельство может быть прояснено, как считал еще М. В. Ломоносов, на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объем газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря ему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки.
С другой стороны в сильно сжатом и, следовательно, более плотном газе молекулы заметно притягиваются к другим молекулам гораздо большую часть времени, чем молекулы в разреженном газе. Это, наоборот, уменьшает число ударов молекул в стенку, так как при наличии притяжения к другим молекулам молекулы газа движутся по направлению к стенке с меньшей скоростью, чем при отсутствии притяжения. При не слишком больших давлениях. более существенным является второе обстоятельство и произведение PV немного уменьшается. При очень высоких давлениях большую роль играет первое обстоятельство и произведение PV увеличивается.
Итак, и сам закон Бойля — Мариотта и отступления от него подтверждают молекулярную теорию.
Изменение объема газа при изменении температуры
Мы изучали, как зависит давление некоторой массы газа от температуры, если объём остается неизменным, и от объема , занимаемого газом, если температура остается неизменной. Теперь установим, как ведет себя газ, если меняются его температура и объем, а давление остается постоянным.
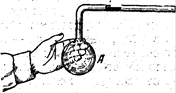
Рассмотрим такой опыт. Коснемся Ладонью сосуда, изображенного на рис., в котором горизонтальный столбик ртути запирает некоторую массу воздуха. Газ в сосуде нагреется, его давление повысится, и ртутный столбик начнет перемещаться вправо. Движение столбика прекратится, когда благодаря увеличению объема воздуха в сосуде давление его сделается равным наружному. Таким образом, в конечном результате этого опыта объем воздуха при нагревании увеличился, а давление осталось неизменным.
Измерение теплоты и температуры
... разных газов, завершившемся получением жидкого кислорода при температуре -140 градусов по Цельсию и давление 320 ... были придуманы в 18 веке, измерение температуры сводилось к измерению длины столбика воды, спирта или ... сравнительная и притом довольная точная шкала теплоты тела. Они очень давно заметили, что ... этом естествоиспытатели давно видели проявление великих законов природы. Античные учёные и ...
Если бы мы знали, как изменилась в нашем опыте температура воздуха в сосуде, и точно измерили, как меняется объем Газа, мы могли бы изучить это явление с количественной стороны. Очевидно, что для этого надо заключить сосуд в оболочку, заботясь о том, чтобы все части прибора имели одну и ту же температуру, точно измерить объем запертой массы газа, затем изменить эту температуру и измерить приращение объема газа.
Закон Гей-Люссака.
Количественное Исследование зависимости объема газа от температуры при неизменном давлении было произведено французским физиком и химиком Гей-Люссаком (1778—1850) в 1802 г.
Опыты показали, что увеличение объема газа пропорционально приращению температуры. Поэтому тепловое расширение газа можно, так же, как и для других тел, охарактеризовать при помощи коэффициента объемного расширения b. Оказалось, что для газов этот закон соблюдается гораздо лучше, чем для твердых и жидких тел, так что коэффициент объемного расширения газов есть величина, практически постоянная даже при очень значительных повышениях Температуры, тогда как для жидких и твердых тел это; постоянство соблюдается лишь приблизительно.
Отсюда найдем:
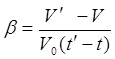 (4)
(4)
град -1
Как видно, коэффициент расширения газов совпадает с их термическим коэффициентом давления.
Следует отметить, что тепловое расширение газов весьма значительно, так что объем газа V 0 при 0°С заметно отличается от объема при иной, например при комнатной, температуре. Поэтому, как уже упоминалось, в случае газов нельзя без заметной ошибки заменить в формуле (4) объем V 0 объемом V. В соответствии с этим формуле расширения для газов удобно придать следующий вид. За начальный объем примем объем V 0 при температуре 0°С. В таком случае приращение температуры газа t равно температуре, отсчитанной по шкале Цельсия t . Следовательно, коэффициент объемного расширения
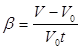 откуда
откуда ![]() (5)
(5)
Так как ![]()
То ![]() (6)
(6)
Формула (6) может служить для вычисления объема как при температуре выше0 0 C , так и при температуре ниже 0°С. В этом последнем случае I отрицательно. Следует, однако, иметь ввиду, что закон Гей-Люссака не оправдывается, когда газ сильно сжат или настолько охлажден, что он приближается к состоянию сжижения. В этом случае пользоваться формулой (6) нельзя.
Мокрая очистка газов
... давления на трубе является движущей силой процесса перемещения газа, поэтому его стабилизация обеспечивает не только качественную дисперсность распыла, но и постоянство расхода газа - второго режимного параметра процесса мокрой очистки, ... качестве контролируемых величин следует принимать расходы газа и жидкости, их конечные и начальные температуры, давления. Знание текущих значений этих параметров ...
Графики, выражающие законы Шарля и Гей-Люссака
кг/см 2 .
0° 100° 200° 300° 400° 500°
Давление ( в кг1см2 ) 1 1,37 1,73 2,10 2,47 2,83
Нанесем эти данные на график. Мы получим наклонную прямую линию. Мы можем продолжить этот график и в сторону отрицательных температур. Однако, как уже было указано, закон Шарля применим только до температур не очень низких. Поэтому продолжение графика до пересечения с осью абсцисс, т. е. до точки, где давление равно нулю, не будет соответствовать поведению реального газа.
Абсолютная температура
кг1см 2 ,
шкалой абсолютных температур.
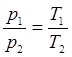 (7)
(7)
Полученный результат можно выразить словами: давление данной массы газа, заключенной в постоянный объем, прямо пропорционально абсолютной температуре. Это — новое выражение закона Шарля.
Формулой (6) удобно пользоваться и в том случае, когда давление при 0°С неизвестно.
Объем газа и абсолютная температура
Из формулы (6), можно получить следующую формулу:
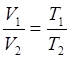
- объем некоторой массы газа при постоянном давлении прямо пропорционален абсолютной температуре.
Зависимость плотности газа от температуры
Что происходит с плотностью некоторой массы газа, если температура повышается, а давление остается неизменным?
Вспомним, что плотность равна массе тела, деленной на объем. Так как масса газа постоянна, то при нагревании плотность газа уменьшается вот столько раз, во сколько увеличился объем.
плотность газа при неизменном давлении обратно пропорциональна абсолютной температуре.
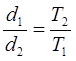 (9)
(9)
Объединенный закон газового состояния
изменяются все три эти величины.
Пусть начальные объем, давление и абсолютная температура некоторой массы газа равны V 1 , P1 и Т1, конечные — V2 , P2 и T2 — Можно представить себе, что переход от начального к конечному состоянию произошел в два этапа. Пусть, например, сначала изменился объем газа от V1 до V2, причем температура Т1, осталась без изменения. Получившееся при этом давление газа обозначим Pср.. Затем изменилась температура от Т1 до T2 при постоянном объеме, причем давление изменилось от Pср. до P. Составим таблицу:
Закон Бойля — Мариотта
Р 1 V1 t1
PcpV 2 T1
Закон Шарля
PcpV 2 T1
P 2 V2 T2
Пименяя, к первому переходу закон Бойля-Мариотта запишем
Растворимость газов в нефти
... называют парциальным мольным объемом. Зависимость коэффициента растворимости от давления и температуры определяется соотношением (3) растворимость газ нефть т.е., с увеличением давления уменьшается. Здесь - мольная концентрация газа в растворе при давлении летучесть газа при давлении, равном упругости ...
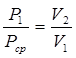 или
или 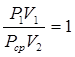
Применяя ко второму переходу закон Шарля, можно написать
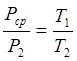
Перемножив эти равенства почленно и сокращая на Pcp получим:
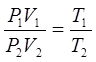 (10)
(10)
Итак, произведение объема некоторой массы, газа на его давление пропорционально абсолютной температуре газа. Это и есть объединенный закон газового состояния или уравнение состояния газа.
Закон Дальтона
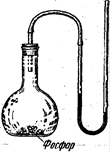
До сих пор мы говорили о давлении какого-нибудь одного газа — кислорода, водорода и т. п. Но в природе и в технике мы очень часто имеем дело со смесью нескольких газов. Самый важный пример этого — воздух, являющийся смесью азота, кислорода, аргона, углекислого газа и других газов. От чего зависит давление смеси газов?
Поместим в колбу кусок вещества, химически связывающего кислород из воздуха (например, фосфор), и быстро закроем колбу пробкой с трубкой. присоединенной к ртутному манометру. Через некоторое время весь кислород воздуха соединится с фосфором. Мы увидим, что манометр покажет меньшее давление, чем до удаления кислорода. Значит, присутствие кислорода в воздухе увеличивает его давление.
(закон Дальтона).
Как истолковать закон Дальтона с точки зрения молекулярной теории, скажу немного далее.
Плотности газов
при нормальных условиях
Плотности некоторых газов
Газ Плотность при нормальных условиях в г/л или в кг/м3 Отношение к плотности воздуха Отношение к плотности водорода Молекулярный или атомный вес
Воздух 1,293
0,0899 1,25 1,43 1,977 0,179 1
0,0695 0,967 1.11 1,53 0,139 14,5
1 14 16 22 2 29 (средний)
Водород (Н 2 ) 0,0899 0,0695 1 2
Азот (N 2 ) 1,25 0,967 14 28
Кислород (О 2 ) 1,43 1,11 16 32
Углекислый газ (СО 2 ) 1,977 1,53 22 44
Гелий (Не) 0,179 0,139 2 4
Определение плотности газа можно осуществить так. Взвесим колбу с краном дважды: один раз откачав из нее по возможности полностью воздух, другой раз наполнив колбу исследуемым газом до давления, которое должно быть известно. Разделив разность весов на объем колбы, который надо определить предварительно, найдем плотность газа при данных условиях. Затем, пользуясь уравнением состояния газов, легко найдем плотность газа при нормальных условиях dн. Действительно, положим в формуле (10) Р 2 =Рн, V2 =Vн, Т2 =Тн и, умножив числитель и знаменатель
формулы на массу газа m, получим: