Законы идеальных газов — приближенные законы. Отступления от них носят как количественный, так и качественный характер. Количественные отступления проявляются в том, что уравнение Менделеева-Клапейрона соблюдается для реальных газов лишь приближенно. Реальные газы могут быть переведены в жидкое и твердое состояние.
Отступления от законов идеальных газов связаны с тем, что между молекулами газа действуют силы, которые в теории идеальных газов во внимание не принимаются.
Это силы:
1) Химические — приводят к образованию химических соединений.
2) Молекулярные — силы взаимодействия между атомами и молекулами, если новые соединения не образуются.
3) Силы кулоновского притяжения и отталкивания между ионами, если газ ионизован.
1. Уравнение Ван-дер-Ваальса
Будем рассматривать газы, где химические превращения не происходят или закончились, молекулы газа электронейтральны.
Принимать во внимание будем только молекулярные силы. Пусть молекулы имеют вид твердых упругих шаров. Начнем сначала с влияния сил отталкивания или, что то же самое, с влияния конечных размеров молекул. Будем предполагать, что силы притяжения между молекулами не действуют. Влияние конечных размеров молекул качественно понять легко. При одних и тех же температурах и концентрациях число ударов о стенку больше в случае молекул конечного размера, чем в случае точечных молекул. Это объясняется тем, что передача импульса в газе по пространству, не занятому молекулами, происходит с тепловыми скоростями, а по пространству, заполненному абсолютно твердыми молекулами, — с бесконечной скоростью. В результате давление газа возрастает.
Исследуем теперь вопрос количественно. Будем предполагать, что плотность газа не очень велика. Тогда случаи, когда одновременно сталкиваются три молекулы и более будут относительно редки. Много чаще будут встречаться такие случаи, когда сталкиваются между собой только две молекулы, а остальные молекулы в момент столкновения на них не действуют. Такие столкновения называются парными. Будем учитывать только их. Ясно что таким путем нельзя получить уравнение состояния газы, пригодное при больших плотностях. Можно рассчитывать лишь на получение поправок к уравнению Клайперона.
Допустим, что в сосуде объема V с гладкими стенками находятся две одинаковые молекулы 1 и 2, совершающие тепловое движение. Величина давления на стенки определяется суммарной кинетической энергией молекул и не зависит от того, как это энергия распределена между молекулами. Будем считать, что одна молекула остается неподвижной, а другая движется с удвоенной кинетической энергией. Результат расчета от этого не изменится. Центры молекул не могут сблизиться на расстояние, меньшее d (диаметр молекулы).
По химии «Инертные газы»
... обнаруженному им газу своё название. Э.Дорн, занимавшийся радием, открыл наиболее долгоживущий изотоп газа Строение атомов и молекул. Благородные газы заканчивают собой ... Инертные газы имеют более низкие точки сжижения и замерзания, по сравнению с другими газами с тем же молекулярным весом. Это происходит из-за насыщенного характера атомных молекул инертных газов. Химические свойства. Инертные газы ...
Окружим молекулу 2 сферой ограждения радиуса d. Движущуюся молекулу 1 можно считать точечной. Очевидно, она не может проникнуть внутрь сферы ограждения неподвижной молекулы. Это значит, что объем, доступный молекуле 1 уменьшается на объем сферы ограждения, т.е. на величину ![]() . Эта величина равна учетверенной сумме объемов обеих молекул.
. Эта величина равна учетверенной сумме объемов обеих молекул.
Пусть теперь в сосуде имеется N одинаковых молекул. При вычислении давления на стенку сосуда можно рассуждать так, как если бы половина из них 1/2N покоилась и была заменена соответствующими сферами ограждения, а молекулы другой половины были точечными и двигались бы с удвоенной кинетической энергией. Тогда бы мы имели идеальный газ из N’=N/2 точечных молекул с температурой Т’=2Т. Этим молекулам был бы доступен объем сосуда V за исключением объема, занимаемого N/2 сферами ограждения других молекул. Обозначим этот последний объем b. Тогда объем, доступный движущимся молекулам будет равен V-b. Давление, оказываемое этими молекулами на стенки сосуда, равно
![]()
Если в сосуде находится моль газа, то ![]() и тогда
и тогда
(1)
Рассмотрим теперь влияние сил молекулярного притяжения. Предполагая, что сил отталкивания нет, изменим модель газа. Молекулы будем считать точками, между которыми действуют силы притяжения. В отличие от сил отталкивания, действующих на близких расстояниях, силы молекулярного притяжения являются силами дальнодействующими. Во взаимодействии участвует сразу много молекул, и схема парных столкновений становится непригодной. Окружим каждую молекулу сферой молекулярного действия. Если эта сфера целиком находится внутри газа, то силы, действующие на рассматриваемую молекулу со стороны окружающих молекул, в среднем уравновешиваются. Но этого не будет, когда молекула находится вблизи границы газа со стенкой. Здесь сфера молекулярного действия лишь частично проходит в газе. Появляется избыток молекул, тянущих рассматриваемую молекулу внутрь газа, над молекулами, тянущими ее наружу. Таким образом, вблизи стенки возникает пристеночный слой газа, толщина которого равна радиусу сферы молекулярного действия. Каждая молекула этого слоя в среднем подвергается действию силы f, направленной в сторону газа. Величина силы f максимальна, когда молекула находится у самой стенки, и убывает при удалении от нее.
Когда молекула летит к стенке, а затем отражается от нее, то меняется ее импульс. Ежесекундное изменение импульса всех молекул, падающих на единицу площади стенки и отражающих от нее, равно ![]() . Однако, в отличие от идеальных газов, импульс налетающих молекул изменяется не только под действием сил давления со стороны стенки, но под действием сил, с которыми их тянут внутрь газа молекулы пристеночного слоя. В частности, под действием этих последних сил молекула может отразиться внутри пристеночного слоя, не долетев до стенки. Вместо сил, действующих на налетающие молекулы, можно по третьему закону Ньютона ввести равные молекулы пристеночного слоя. Пусть P- средняя сила давления газа на стенку, а средняя сила, с которой молекулы пристеночного слоя втягиваются внутрь газа. Тогда
. Однако, в отличие от идеальных газов, импульс налетающих молекул изменяется не только под действием сил давления со стороны стенки, но под действием сил, с которыми их тянут внутрь газа молекулы пристеночного слоя. В частности, под действием этих последних сил молекула может отразиться внутри пристеночного слоя, не долетев до стенки. Вместо сил, действующих на налетающие молекулы, можно по третьему закону Ньютона ввести равные молекулы пристеночного слоя. Пусть P- средняя сила давления газа на стенку, а средняя сила, с которой молекулы пристеночного слоя втягиваются внутрь газа. Тогда
» Свойства газов
... поверхности стенки молекулы газа ударяют в стенки, в то время как в других местах удары отсутствуют. Эта картина всё время беспорядочным образом меняется. Молекулы газа ударяют о стенки сосудов, ... газа, возникающей под действием силы тяжести. Тепловое равновесие означает, что не происходит передачи теплоты от одного участка газа к другому. Для этого необходимо, чтобы температура во всем объеме газа ...
идеальный газ уравнение
![]() , или
, или
![]() (3)
(3)
Видно, что давление на стенку P не зависит от материала стенки. Роль стенки может выполнять сам газ. Проведем мысленно произвольное сечение, разделяющее газ на две части. Давление одной части на другую будет таким же, как если бы это другая часть была твердой стенкой. Оно равно P, а не P+Pi или какой либо другой комбинации этих величин.
Сила Pi называется внутренним, или молекулярным давлением. Ее можно представить в виде Pi =<Nслf> где f — сила, действующая на молекулу пристеночного слоя, а Nсл — число молекул в нем, отнесенное к единице площади. Можно также написать Pi ~ <Nсл><f>. Обе величины <Nсл> и <f> пропорциональны плотности или обратно пропорциональны объему газа. Предполагая опять, что газ взят в количестве одного моля, можно положить
![]() , (4)
, (4)
где а- постоянная характерная для рассматриваемого газа. Тогда (3) переходит в
![]()
Теперь надо учесть совместное действие сил притяжения и отталкивания. Для неплотных газов, к которым относятся наши рассуждения, поправки на силы притяжения и отталкивания можно вводить независимо. Тогда в результате комбинации формул (1) и (5) получится
![]() (6)
(6)
уравнением Ван-дер-Ваальса.
Кроме того вывод предполагает, что молекулы газа сферически симметричны, поскольку он относится к модели твердых упругих шаров. С этим связано то обстоятельство, что в действительности даже для неплотных газов величины а и b зависят от температуры.
Для плотных газов уравнением Ван-дер-Ваальса не годится, как количественное соотношение. Однако качественно оно правильно передает поведение и таких газов. Газы, подчиняющиеся уравнению Ван-дер-Ваальса называют газами Ван-дер-Ваальса. Ясно, что и они являются идеализациями.
Нетрудно записать уравнение Ван-дер-Ваальса для произвольного числа молей газа. Если газ занимает объем V, то молярный объем будет . Этой величиной надо заменить V в уравнении (6).
В результате получится
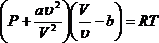 (8) или
(8) или
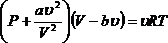 (9)
(9)
2. Изотермы газа Ван-дер-Ваальса
Для исследования изотерм при любых значениях Т умножим уравнение (6) на V2
Понятие реального газа
... Вводя эти поправки - получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния идеальных газов): (p+a/V2m) (Vm-b)=RT 4. Изотермы Ван-дер-Ваальса Для исследования поведения реального газа рассмотрим изотермы Ван-дер-Ваальса - кривые зависимости p ...
P
V
Так будет при любых давлениях, если температура достаточно высока. Изотерма имеет вид монотонно опускающейся кривой MN. При более низких температурах и надлежащих значениях давления P уравнение (2.1) имеет 3 корня ![]() . В таких случаях изобара пересекает изотерму в трех точках L, C, G. Изотерма содержит волнообразный участок LBCAG. Она сначала монотонно опускается вниз (участок DB), затем на участке BA монотонно поднимается вверх, а за точкой A снова монотонно опускается. При некоторой промежуточной температуре три корня
. В таких случаях изобара пересекает изотерму в трех точках L, C, G. Изотерма содержит волнообразный участок LBCAG. Она сначала монотонно опускается вниз (участок DB), затем на участке BA монотонно поднимается вверх, а за точкой A снова монотонно опускается. При некоторой промежуточной температуре три корня ![]() становятся равными. Такая температура называется и соответствующая ей изотерма называются критическими. Критическая изотерма FKH всюду монотонно опускается вниз, за исключением одной точки K, являющейся точкой перегиба изотермы. В ней касательная к изотерме горизонтальна. Точка К называется критической точкой. Соответствующие ей давление Pк, объем Vк, температура Тк, называются также критическими.
становятся равными. Такая температура называется и соответствующая ей изотерма называются критическими. Критическая изотерма FKH всюду монотонно опускается вниз, за исключением одной точки K, являющейся точкой перегиба изотермы. В ней касательная к изотерме горизонтальна. Точка К называется критической точкой. Соответствующие ей давление Pк, объем Vк, температура Тк, называются также критическими.
Для нахождения критических параметров Pк, Vк, Тк учтем, что в критической точке уравнение (2.1) переходит в
![]()
Поскольку в этом случае все три корня совпадают и равны Vк, уравнение должно приводиться к виду
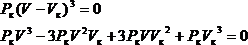
Сравнивая коэффициенты имеем
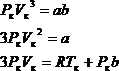
Делим (1) на (2) получаем ![]()
![]()
![]()
. Правило фаз Максвелла
Не все состояния вещества, совместимые с уравнением Ван-дер-Ваальса, могут быть реализованы в действительности. Для этого необходимо еще, чтобы они были термодинамически устойчивы. Одно из необходимых условиях термодинамической устойчивости физически однородного вещества состоит в выполнении неравенства
![]()
Физически оно означает, что при изотермическом уменьшении давления объем тела должен уменьшаться. Иными словами, при возрастании V все изотермы должны монотонно опускаться. Между тем, ниже критической температуры на изотермах Ван-дер-Ваальса имеются поднимающиеся участки типа BCA. Точки, лежащие на таких участках, соответствуют неустойчивым состояниям вещества, которые практически реализованы быть не могут. При переходе к практическим изотермам эти участки должны быть выброшены, как это и сделано на рис.2.
Таким образом, реальная изотерма распадается на две ветви EGA и BLD, отделенные друг от друга. Естественно предположить, что этим двум ветвям соответствуют различные агрегатные состояния вещества. Ветвь EA характеризуется относительно большими значениями объема или малыми значениями плотности; она соответствует газообразному состоянию вещества. Напротив, ветвь BD характеризуется относительно малыми объемами, а следовательно, большими плотностями; она соответствует жидкому состоянию вещества.
Свойства и законы идеального газа
... закон Шарля, закон Гей-Люссака, закон Бойля-Мариотта, а также закон Авогадро, закон Дальтона. Закон Бойля-Мариотта. Изотерма ЗАКОН БОЙЛЯ -- МАРИОТТА, один из основных газовых законов, который описывает изотермические процессы в идеальных газах. ... количество вещества, а , где m -- масса, м -- молярная масса, уравнение состояния можно записать: идеальный газ аэрогазодинамика шарль уравнения (закона) ...
Мы распространяем, следовательно, уравнение Ван-дер-Ваальса и на область жидкого состояния. Таким путем удается получить удовлетворительное качественное описание явления перехода газа в жидкость и обратно.
Возьмем достаточно разреженный газ при температуре ниже критической. Исходное состояние его на диаграмме VP изображается точкой Е . Будем сжимать газ, поддерживая температуру Т по изотерме вверх. Можно было бы думать, что она достигает крайнего положения А, где изотерма обрывается. В действительности, однако, начиная с некоторой точки G, давление в системе перестает повышаться, и она распадается на две физически однородные части, или фазы газообразную и жидкую.
Процесс изотермического сжатия такой двухфазной системы изображается участком GL горизонтальной прямой. При этом во время сжатия плотности жидкости и газа остаются неизменными и равными их значениям в точках L и G соответственно. По мере сжатия количества вещества в газообразной фазе непрерывно уменьшается, а в жидкой фазе увеличивается, пока не будет достигнута точка L, а в которой все вещество перейдет в жидкое состояние.
Положение горизонтального участка изотермы GL легко определить, пользуясь термодинамическим равенством Клаузиуса
Для этого заметим, что из состояния G вещество можно перевести в состояние L двумя изотермическими процессами: по изотерме GCL двухфазного состояния вещества и по теоретической изотерме физически однородного вещества GACBL, содержащей неустойчивый участок АСВ. Применим равенство Клаузиуса к квазистатическому круговому процессу GCLBCAG. Это — изотермический процесс, а потому равенство Клаузиуса принимает вид.
![]() . Кроме того
. Кроме того
![]() , т.к.
, т.к. ![]()
![]() , или
, или
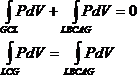
Отсюда следует, что площадь прямоугольника QLGR должна быть равна площади криволинейной фигуры QLBCAGR. Значит, прямую GCL надо провести так, чтобы равнялись площади GACG и СВLС, заштрихованные на рис.1. Это правило называется правилом Максвелла.
Если за исходное состояние вещества Взять жидкое (точка D на изотерме), то при изотермическом расширении точка, изображающая его состояние, будет перемещаться вниз по изотерме, пока она не достигнет положения L, начиная с которого появится новая — газообразная фаза.
Дальнейший изотермический процесс расширения двухфазной системы пойдет вдоль горизонтального участка изотермы LCG. В точке G все вещество перейдет в газообразное состояние. Затем изотермическое расширение идет по участку изотермы GE, причем вещества все время остается в газообразном состоянии.
Мокрая очистка газов
... взрыво- и пожароопасностью перерабатываемых веществ. 1. Общие сведения о процессе Мокрую очистку применяют для очистки газов от пыли и тумана. В качестве промывной жидкости обычно используют воду, реже - ... водные растворы соды, серной кислоты и других веществ. ...
метастабильными
Жирная кривая ALKG, соединяющая концы горизонтальных участков изотерм, делит плоскость VP на две области. Область между кривой ALKG и изобарой P=0 соответствует двухфазным состояниям вещества. Это значит, что каждая точка этой области изображает такое состояние вещества, в котором оно не является физически однородным, а состоит из жидкости и ее насыщенного пара. Ниже изобары P=0 двухфазное состояние невозможно, так как давление пара не может быть меньше нуля. Область над кривой ALKG и ниже изобары P=0 , напротив, соответствует однофазным состояниям. Каждая точка этой области изображает состояние физически однородного вещества. Впрочем, точки под граничной кривой ALKG наряду с двухфазными состояниями вещества, могут изображать и однофазные состояния, которым соответствуют теоретические изотермы, имеющие волнообразный характер. Это во-первых, метастабильные состояния- перегретая жидкость и пересыщенный пар. Во-вторых, это абсолютно неустойчивые состояния, которым соответствуют поднимающиеся участки теоретических изотерм. Такие состояния могут играть роль только в теоретический рассуждениях, подобных тем, которые применялись при доказательстве правила Максвелла.
Возьмем в двухфазной области какую-либо точку M(рис.3) Вещество, состояние которого изображается этой точкой, состоит из жидкости и газа. Для простоты будем предполагать, что масса взятого вещества равна единице. Тогда удельные объемы жидкости и газа изобразятся длинами отрезков NL и NG соответственно, а объем всего вещества Vм- длиной отрезка Если масса газа равна mг, а жидкости — mж, то
![]()
Так как ![]() , то это соотношение можно переписать виде
, то это соотношение можно переписать виде
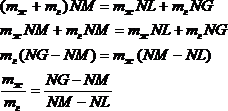
или
![]()
Таким образом, точка М делит отрезок LG на части LM и MG, обратно пропорциональные массам жидкости и газа. Этот результат называется правилом рычага.
Рассматривая рис.3 можно прийти к важному принципиальному заключению. Пусть начальное состояние газа изображается точкой 1 при температуре ниже критической. Будем изотермически сжимать газ. В точке G начнется превращение его в жидкость. Этот процесс закончится в точке L. При дельнейшем сжатии по изотерме L2 вещество будет оставаться все время жидким. Мы перевели вещество из газообразного состояния 1 в жидкое 2 и имели возможность наблюдать, где начинается и как происходит это превращение. Но можно тот же переход произвести иначе. Нагреем газ при постоянном объеме, чтобы его температура и давление стали выше критических (прямая 13).
Затем, оставляя давление постоянным, охладим газ ниже критической температуры (прямая 32).
Мы придем в то же состояние 2, т.е. сконденсируем газ в жидкость. Однако при этом вещество все время будет оставаться физически однородным, свойства его будут меняться непрерывно, и не имеет смысла говорить, что в какой-то момент произошла конденсация.
Заключение
Теория Ван-дер-Ваальса при всей своей простоте дает стройную, качественно верную картину поведения вещества при его превращениях из жидкого состояния в газообразное и обратно. Она впервые привела в систему запутанные явления, связанные с такими превращениями. Теория Ван-дер-Ваальса может быть охарактеризована на уравнении состояния. Которое является результатом экстраполяции теоретических и экспериментальных данных. Между тем, всякая последовательная молекулярная теория должна без привлечения каких бы то ни было добавочных соображений дать полную картину поведения вещества и, в частности его фазовых превращений. Такой физической теории пока еще нет.
Мокрая очистка газов (2)
... нарушениям режима, вредностью условий работы, взрывои пожароопасностью перерабатываемых веществ. 1. Общие сведения о процессе Мокрую очистку применяют для очистки газов от пыли и тумана. В качестве промывной жидкости обычно используют воду, ...
Литература
[Электронный ресурс]//URL: https://drprom.ru/referat/gazovyie-zakonyi/
1) Сивухин Д.В. “Общий курс физики” -II М. “Наука” 1990
