е дымит, не имеет цвета и запаха, при обычной температуре находится в жидком состоянии, в концентрированном виде не корродирует черные металлы. В то же время серная кислота относится к числу сильных минеральных кислот, образует многочисленные устойчивые соли и дешева.
Серная кислота – один из основных крупнотоннажных продуктов химической промышленности, необходимый для производства минеральных удобрений, диоксида титана, искусственных волокон, взрывчатых веществ, неорганических кислот и множества других химических соединений.
Мировое производство серной кислоты за последние пять лет выросло на 18 % и по итогам 2007 г. должно достигнуть 200 млн. тонн, что в денежном выражении составляет около $9 млрд. При этом основной рост мощностей произошел благодаря увеличению производства серной кислоты из элементарной серы и отходящих газов цветной металлургии.
Россия и другие страны бывшего СССР за последние годы также увеличили выпуск серной кислоты. Это обусловлено как растущим спросом со стороны основных потребителей, так и увеличением мощностей продуцентов. Надо отдельно отметить, что для предприятий цветной металлургии серная кислота является побочным продуктом, и с увеличением выпуска цинка и меди идет увеличение производство кислоты.
1. Производство серной кислоты
В технике под серной кислотой понимают системы, состоящие из оксида серы (VI) и воды различного состава [3]:
![]()
При ![]() →
→![]() →1 – это моногидрат серной кислоты (100%-ная кислота), при
→1 – это моногидрат серной кислоты (100%-ная кислота), при ![]() <
<![]() — водные растворы моногидрата, при
— водные растворы моногидрата, при ![]() >
>![]() — растворы оксида серы (VI) в моногидрате (олеум)
— растворы оксида серы (VI) в моногидрате (олеум)
Технология диоксида серы
... газов позволит нерационально использовать огромные количества серы и оздоровить воздушный бассейн над населенными пунктами. Подготовка сырья к обжигу Для получения сернистого ангидрида, являющегося исходным продуктом в производстве серной кислоты, ... содержание в земной коре составляет 0,1 %. 1. Серный колчедан. Главной составной частью серного колчедана является сульфид железа FeS 2 , содержащий ...
Моногидрат серной кислоты – бесцветная маслянистая жидкость с температурой кристаллизации 10,37ºС, температурой кипения 296,2ºС и плотностью 1850 кг/м3 . С водой и оксидом серы (VI) моногидрат смешивается во всех соотношениях.
Среди минеральных кислот серная кислота по объему производства и потребления занимает первое место. Мировое производство ее за последние 25 лет выросло более чем в 3 раза.
Области применения серной кислоты и олеума весьма разнообразны. Значительная часть ее используется в производстве минеральных удобрений (от 30 до 60%), а также красителей (от 2 до 16%), химических волокон (от 5 до 15%), в металлургии (от 2 до 3%).
Она применяется для различных технологических целей в текстильной пищевой и других отраслях промышленности. На рисунке 1 показаны области применения серной кислоты и олеума в различных отраслях промышленности.
Еще в XIII веке серную кислоту получали в незначительных количествах термическим разложением железного купороса FeSO4 , поэтому и сейчас один из сортов серной кислоты называется купоросным маслом, хотя уже давно серная кислота не производится из купороса.
Рис. 1 Схема применения серной кислоты [1]
![]()
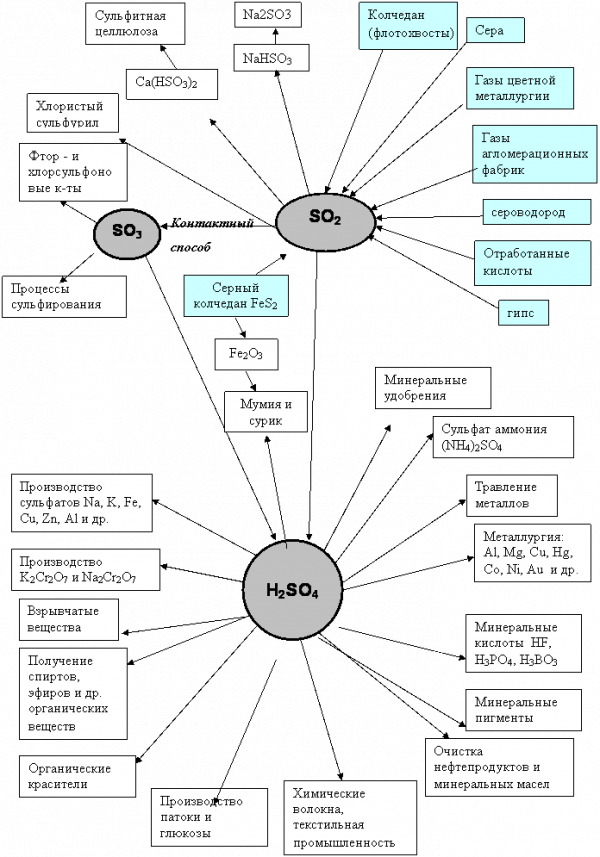
Сырьевая база для производства серной кислоты
Сырьем в производстве серной кислоты могут быть элементарная сера, и различные серосодержащие соединения, из которых можно получать серу или непосредственно оксид серы (IV).
Природные залежи самородной серы невелики. Чаще всего сера находится в природе в форме сульфидов и сульфатов металлов, а также входит в состав компонентов нефти, каменного угля, природного и попутного газов. Значительные количества серы выделяются в виде оксида серы в топочных газах и газах цветной металлургии, а также в виде сероводорода, образующегося в разнообразных химических производствах и при очистке газов [2, 3].
Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный колчедан. Ограниченное использование таких видов сырья, как топочные газы тепловых электростанций и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (IV ).
При этом следует отметить, что доля колчедана в балансе сырья уменьшается, а доля серы возрастает и уже превышает 60 % общего количества серосодержащего сырья.
Производство уксусной кислоты
... 1 м3 древесины. Биохимический метод производства уксусной кислоты используют только для производства натурального пищевого уксуса. Появление синтетических методов производства уксусной кислоты связано с разработкой и ... некоторые неорганические и органические вещества, например, серу, фосфор, ацетаты целлюлозы. С воздухом уксусная кислота образует взрывчатые смеси с пределами воспламенения ...
В общей схеме сернокислотного производства существенное значение имеют две первые стадии — подготовка сырья и его сжигание, или обжиг. Их структура и аппаратурное оформление производства существенно зависят от природы сырья, которая в значительной степени определяет сложность технологического производства серной кислоты.
Рассмотрим основные виды сырья для производства серной кислоты:
1) Железный колчедан . Природный железный колчедан представляет собой сложную породу, состоящую из сульфида железа FeS 2 , сульфидов других металлов (меди, цинка, свинца, никеля, кобальта и др.), карбонатов металлов и пустой породы. На территории РФ существуют залежи колчедана на Урале и Кавказе, где его добывают в рудниках в виде рядового колчедана;
2) Сера . Элементарная сера может быть получена из серных руд или из газов, содержащих сероводород или оксид серы (IV ).
В соответствии с этим различают серу самородную и серу газовую (комовую).
На территории РФ залежей самородной серы практически нет. Источниками газовой серы являются Астраханское газокон-денсатное месторождение, Оренбургское и Самарское месторождения попутного газа.
Из самородных руд серу выплавляют в печах, автоклавах или непосредственно в подземных залежах (метод Фраша).
В последнем случае серу расплавляют под землей, нагнетая в скважину перегретую воду, и выдавливают расплавленную серу на поверхность сжатым воздухом.
Получение газовой серы из сероводорода, извлекаемого при очистке горючих и технологических газов, основано на неполном окислении его над твердым катализатором. При этом протекают реакции:
H
H
2H
3)Сероводород
4) Газы цветной металлургии . В этих газах содержится от 4 до 10 % оксида серы (IV ) и они могут непосредственно использоваться для производства серной кислоты.
Доля сырья в себестоимости продукции сернокислотного производства достаточно велика. Поэтому технико-экономические показатели этого производства существенно зависят от вида используемого сырья. В таблице 1 приведены основные технико-экономические показатели (ТЭП) производства серной кислоты из различных видов сырья.
Замена железного колчедана серой приводит к снижению капитальных затрат на строительство, улучшению экологической обстановки в результате ликвидации отвалов огарка и уменьшению выбросов токсичных веществ в атмосферу.
Таблица 1 [3]
Технико-экономические показатели производства серной кислоты, % от производства на основе серного колчедана
Показатель
Сырье
Производство аммиака и азотной кислоты
... и полупродуктов неорганической и органической технологии. Рисунок 1. Использование аммиака Аммиак NH3 - бесцветный газ с резким запахом и температурой кипения - 33,35?С и температурой плавления 77,75?С. Сырьем в производстве аммиака ... промышленности и сельского хозяйства. Их потребляют производства азотной кислоты, разнообразных минеральных удобрений, полимерных материалов, взрывчатых веществ и ...
Самородная сера
Газовая сера
Сероводород
Удельные капиталовложения
в производство
57
57
63
Себестоимость кислоты
125
67
80
Приведенные затраты
118
75
72
Вследствие сложностей с транспортировкой серной кислоты сернокислотные заводы располагают преимущественно в районах ее потребления. Поэтому производство серной кислоты развито во всех экономических районах РФ. Важнейшими центрами его являются Щелково, Новомосковск, Воскресенск, Дзержинск, Березняки, Пермь.
Общая схема сернокислотного производства
Общая схема сернокислотного производства включает в себя несколько химических процессов, в которых происходит изменение степени окисления сырья и промежуточных продуктов [2, 3]:
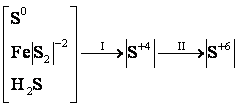
где I
В реальном производстве к этим химическим процессам добавляются процессы подготовки сырья, очистки печного газа, а также механические и физико-химические операции. В общем случае последовательность стадий производства серной кислоты может быть выражена так:
Сырье → Подготовка сырья → Сжигание (обжиг) сырья → Очистка печного газа → Контактирование → Абсорбция контактного газа → Серная кислота.
Конкретная технологическая схема производства зависит от вида сырья, особенностей каталитического окисления оксида серы (IV ), наличия или отсутствия стадии абсорбции оксида серы (VI ).
В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце ХIХ начале ХХ века. Контактный способ вытесняет нитрозный (башенный).
Первой стадией сернокислотного производства по любому методу является получение диоксида серы при сжигании сернистого сырья. После очистки диоксида серы (особенно в контактном методе) ее окисляют до триоксида серы, который соединяют с водой с получением серной кислоты. Окисление SO2 в SO3 в обычных условиях протекает крайне медленно. Для ускорения процесса применяют катализаторы.
В настоящее время контактным методом получают концентрированную серную кислоту, олеум и 100% серный ангидрид.
Реферат по химии воздух смесь газов
... пыли. Кроме перечисленных газов воздух постоянно содержат следы (т.е. ничтожные количества) озона, водорода, метана, аммиака, оксидов азота и угарного газа. По мере совершенствования методов ... газового анализа число таких, практически незаметных составных частей воздуха постепенно возрастает. Атмосферная пыль содержит ...
В контактном методе производства серной кислоты окисление диоксида серы в триоксид осуществляется на твердых контактных массах. Благодаря усовершенствованию контактного способа производства, себестоимость более чистой и высококонцентрированной контактной серной кислоты лишь незначительно выше, чем башенной. В настоящее время свыше 90% всей кислоты производится контактным способом.
Наиболее активным катализатором является платина, однако она вышла из употребления вследствие дороговизны и легкой отравляемости примесями обжигового газа, особенно мышьяком. Окись железа дешевая, но при обычном составе газа — 7% SO2 и 11% О2 она проявляет каталитическую активность только при температурах выше 625º С, т.е. когда хр 70%, и поэтому применялась лишь для начального окисления SO2 до достижения хр 50-60%. Ванадиевый катализатор менее активен, чем платиновый, но дешевле и отравляется соединениями мышьяка в несколько тысяч раз меньше, чем платина; он оказался наиболее рациональным и только он применяется в производстве серной кислоты. Ванадиевая контактная масса содержит в среднем 7% V2 O5 ; активаторами являются окислы щелочных металлов, обычно применяют активатор К2 О; носителем служат пористые алюмосиликаты.
В настоящий момент катализатор применяется в виде соединения SiО2 , К и/или Сs, V в различных пропорциях. Такое соединение оказалось наиболее стабильным и термически стойким с пониженной температурой зажигания. Во всем мире его более корректное название «ванадий-содержащий». Такой катализатор разработан специально для работы с невысокими температурами, что приводит к меньшим выбросам в атмосферу. Кроме того, такой катализ дешевле, нежели калий-ванадиевый. Обычные ванадиевые контактные массы представляют собой пористые гранулы, таблетки или кольца (рис.2).

Рис. 2. Гранулы ванадиево-контактной массы
При условиях катализа окись калия превращается в K2 S2 O7 , а контактная масса в общем представляет собой пористый носитель, поверхность и поры которого смочены пленкой раствора пятиокиси ванадия в жидком пиросульфате калия.
Промотирующая роль щелочных металлов обусловлена образованием низкоплавких пиросульфованадатов (3К2 S2 О7 ·V2 О5 , 2К2 S2 O7 ·V2 O5 и K2 S2 O7 ·V2 O5 , разлагающихся соотв. при 315-330, 365-380 и 400-405°С).
Активный компонент в условиях катализа находится в расплавленном состоянии. Таким образом, ванадиевая контактная масса эксплуатируется при температурах от 400 до 600ºС. При увеличении температуры выше 600ºС начинается необратимое снижение активности катализатора вследствие спекания компонентов с образованием неактивных соединений, не растворимых в пиросульфате калия. При понижении температуры активность катализатора резко снижается вследствие превращения пятивалентного ванадия в четырехвалентный с образованием малоактивного ванадила VOSO4 .
Транспорт и окружающая среда. Методы защиты атмосферного воздуха ...
... серы, попадают в морскую воду из атмосферы. Например, ежегодно в Мировой океан вместе с дождем поступают 50 тыс. т свинца, попадающего в воздух вместе с выхлопными газами ... для объектов газовой промышленности загрязнители: оксиды азота, диоксид серы, оксид углерода, углеводороды. Выбросы подразделяются на ... как диоксид углерода, сероводород и синильная кислота, которые связывают едкий натр в балластные ...
Процесс катализа слагается из стадий:
1) диффузии реагирующих компонентов из ядер газового потока к гранулам, а затем в порах контактной массы;
2) сорбции кислорода катализатором (передача электронов от катализатора к атомам кислорода);
3) сорбции молекул SO2 с образованием комплекса SO2 О катализатор;
4) перегруппировки электронов с образованием комплекса SO2 катализатор;
5) десорбции SO3 из пор контактной массы и от поверхности зерен;
6) диффузии реагирующих компонентов в порах контактной массы и из гранул в ядра газового потока.
При крупных гранулах контактной массы суммарная скорость процесса определяется диффузией реагентов (1-я и 6-я стадии).
Обычно стремятся получить гранулы не более 5 мм в поперечнике; при этом процесс идет на первых стадиях окисления в диффузионной, а на последних (при х 80%) в кинетической области.
Вследствие разрушения и слеживания гранул, загрязнения слоя, отравления катализатора соединениями мышьяка и температурной порчи его при случайных нарушениях режима ванадиевая контактная масса заменяется в среднем через 4 года. Если же нарушена очистка газа, получаемая обжигом колчедана, то работа контактного аппарата нарушается вследствие отравления первого слоя контактной массы через несколько суток. Для сохранения активности катализатора применяется тонкая очистка газа мокрым способом.
Важным усовершенствованием является двойное контактирование, при котором обеспечивается высокая степень окисления SO 2 на катализаторе (до 99,8%) и потому исключается необходимость в дополнительной санитарной очистке отходящих газов.
Химическая схема получения серной кислоты из железного колчедана включает три последовательные стадии:
1) окисление дисульфида железа пиритного концентрата кислородом воздуха:
4FeS
2) каталитическое окисление оксида серы (IV
2 SO 2 + O 2 → 2 S О 3
3) абсорбция оксида серы (VI
S
По технологическому оформлению производство серной кислоты из железного колчедана является наиболее сложным и состоит из нескольких последовательно проводимых стадий.
Реферат кислоты основания соли оксиды
... оксиды и гидроксиды Основания реагируют с кислотами и наоборот. Всегда получается соль ... серной кислотой. Почему хлороводород на воздухе дымит? Как доказать что выданный вам раствор кислота и это соляная кислота? Надо юзить на ... газ ... темам ( с параграфа 29-38 ) и классификация неорганических веществ и их реакций: Ответы на некоторые вопросы после параграфов: Какие вещества называют оксидами? Оксиды ...
Окислительный обжиг железного колчедана в потоке воздуха представляет собой необратимый некаталитический гетерогенный процесс, протекающий с выделением теплоты через стадии термической диссоциации дисульфида железа [3]:
2FeS
и окисления продуктов диссоциации:
S2 + 202 → 2S02 ;
4FeS + 7O2 → 2Fe2 O3 + 4SO2
что описывается общим уравнением:
4FeS 2 + HO 2 → 2Fe 2 O 3 + 8SO 2 — ΔН
где ΔН =3400 кДж.
Скорость процесса окислительного обжига выражается общим для гетерогенных процессов уравнением [4]
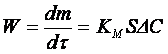
где К М — коэффициент массопередачи; S — площадь поверхности контакта фаз; ΔС— движущая сила процесса.
Таким образом, скорость процесса обжига зависит от температуры (через К М ), дисперсности обжигаемого колчедана (через S ), концентрации дисульфида железа в колчедане и концентрации кислорода в воздухе (через ΔС).
Увеличение движущей силы процесса обжига достигается флотацией колчедана, повышающей содержание дисульфида железа в сырье, обогащением воздуха кислородом и применением избытка воздуха при обжиге до 30 % сверх стехиометрического количества. На практике обжиг ведут при температуре не выше 1000°С, так как за этим пределом начинается спекание частиц обжигаемого сырья, что приводит к уменьшению их поверхности и затрудняет смывание частиц потоком воздуха.
В качестве реакторов для обжига колчедана могут применяться печи различной конструкции: механические, пылевидного обжига, кипящего слоя. Печи кипящего слоя отличаются высокой интенсивностью [до 10000 кг/(м2 -сут)], обеспечивают более полное выгорание дисульфида железа (массовая доля серы в огарке не превышает 0,5 %), позволяют осуществлять контроль температуры, облегчают процесс утилизации теплоты реакции обжига. К недостаткам печей кипящего слоя следует отнести повышенное содержание пыли в газе обжига, что затрудняет его очистку. В настоящее время эти печи полностью вытеснили печи других типов в производстве серной кислоты из колчедана.
Продукты окислительного обжига колчедана — обжиговый (печной) газ и огарок, состоящий из оксида железа (III ), пустой породы и остатка невыгоревшего дисульфида железа.
Состав обжигового газа зависит от природы сырья, состава и избытка воздуха при его обжиге. В него входят оксид серы (IV ), кислород, азот и незначительное количество оксида серы (VI ), образовавшегося в результате каталитического действия оксида железа (III ).
Оксиды. Основные классы неорганических соединений
... в оксиде с.о. металла не максимальная, то в реакциях с кислотой азотной любой концентрации и с концентрированной серной кислотой помимо ... SO2 + 10H2O. Fe3O4 (FeO•Fe2O3) + O2 Fe2O3. 2). Оксид серы (IV), сернистый газ. Получение: В лаборатории. Na2SO3 + 2HCl = 2NaCl + SO2 + ... с основными и амфотерными оксидами (см. пункт 6. в) г) взаимодействие с основаниями. Правило: кислотные оксиды взаимодействуют со ...
На практике при обжиге колчедана печной газ содержит от 13 до 14% оксида серы (IV
При очистке обжигового (печного) газа из него удаляют пыль, сернокислотный туман и вещества, являющиеся каталитическими ядами или представляющие собой ценность как побочные продукты. В обжиговом газе содержится до 300 г/м3 пыли, которая на стадии контактирования засоряет аппаратуру и снижает активность катализатора, а также туман серной кислоты. Кроме того, при обжиге колчедана одновременно с окислением дисульфида железа окисляются содержащиеся в колчедане сульфиды других металлов. При этом мышьяк и селен образуют газообразные оксиды As 2 O 3 и SeO 2 , которые переходят в обжиговый газ и становятся каталитическими ядами для ванадиевых контактных масс. Пыль и сернокислотный туман удаляют из обжигового газа при общей чистке газа, которая включает в себя механическую (грубую) и электрическую (тонкую) очистки. Механическую очистку газа осуществляют пропусканием газа через центробежные пылеуловители (циклоны) и волокнистые фильтры, снижающие содержание пыли в газе до 10…20 г/м3 . Электрическая очистка газа в электрофильтрах снижает содержание пыли и тумана в газе до 0,05…0,1 г/м3 .
После общей очистки обжиговый газ, полученный из колчедана, обязательно подвергается специальной очистке для удаления остатков пыли и тумана и главным образом соединений мышьяка и селена, которые при этом утилизируют. В специальную очистку газа входят операции охлаждения его до температуры ниже температуры плавления оксида мышьяка (315°С) и селена (340°С) в башнях, орошаемых последовательно 50- и 20%-ной серной кислотой, удаления сернокислотного тумана в мокрых электрофильтрах и завершающей осушки газа в скрубберах, орошаемых 95%-ной серной кислотой. Из системы специальной очистки обжиговый газ выходит температурой от 140 до 50°С.
Оксид селена (IV
SeO
Новым прогрессивным методом очистки обжигового газа является адсорбция содержащихся в нем примесей твердыми поглотителями, например силикагелем или цеолитами. При подобной сухой очистке обжиговый газ не охлаждается и поступает на контактирование при температуре около 400°С, вследствие чего истребует последующего дополнительного подогрева.
Реакция окисления оксида серы ( IV
2SO 2 + О2 ↔ 2SO 3 — ΔН
Тепловой эффект реакции зависит от температуры и равен 96 кДж при температуре 25°С и около 93 кДж при температуре контактирования. Система SO 2 — О2 — SO 3 характеризуется равновесием и скоростью окисления оксида серы (IV ), от которых зависит суммарный результат процесса.
Сбор газа. Очистка газа от механических примесей. Абсорбционная ...
... и облегчаются условия труда обслуживающего персонала. Отсутствие в природных газах оксида углерода предотвращает возможность отравления при утечках газа, что особенно важно при газоснабжении коммунальных и бытовых потребителей. ...
В производстве серной кислоты в качестве катализатора применяют контактные массы на основе оксида ванадия (V ) марок БАВ и СВД, названные так по начальным буквам элементов, входящих в их состав [1, 2].
БАВ (барий, алюминий, ванадий) состава
[V
СВД (сульфо-ванадато-диатомовый) состава
[V
катализатор промотор носитель
Предполагается, что процесс окисления оксида серы (IV
V
V
Температура зажигания контактных ванадиевых масс 380… 420 °С и зависит от состава контактируемого газа, повышаясь по мере уменьшения содержания в нем кислорода. Контактные массы для реакторов с неподвижным слоем катализатора формуются в виде гранул, таблеток или колец средним диаметром около 5 мм, а для реакторов кипящего слоя — в виде шариков диаметром около 1 мм.
Реакторы, или контактные аппараты, для каталитического окисления оксида серы (IV
Совокупность контактного аппарата, теплообменников и газопроводов представляет собой контактный узел. На рисунке 3 показаны контактный узел, состоящий из контактного аппарата фильтрующего типа и выносных теплообменников, и контактный аппарат кипящего слоя.
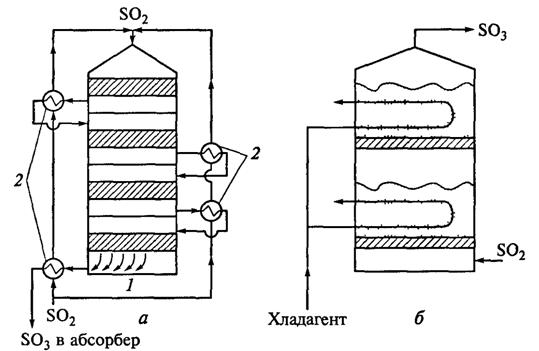
Рис. 3. Контактный узел (а) и контактный аппарат кипящего слоя (б) [3]:
1 — контактный аппарат; 2 — теплообменник
К достоинствам контактных аппаратов кипящего слоя относятся:
высокий коэффициент теплоотдачи от катализатора в состоянии кипящего слоя к поверхности теплообменника (в 10 раз боль ше, чем от газа), что позволяет без перегрева вести контактирование печного газа с высоким содержанием оксида серы ( IV ) и снизить температуру зажигания катализатора;
нечувствительность к пыли, вносимой вместе с печным газом.
Последней стадией в производстве серной кислоты контактным способом являются абсорбция оксида серы ( VI ) из контактного газа и превращение его в серную кислоту или олеум. Абсорбция оксида серы (VI ) представляет собой обратимую экзотермическую реакцию и описывается уравнением
![]() S О3 + H 2 О ↔H 2 S О4 + (
S О3 + H 2 О ↔H 2 S О4 + (![]() —l )S О3 -ΔН
—l )S О3 -ΔН
Тепловой эффект реакции зависит от значения v
Такая схема абсорбции позволяет получать кроме контактной серной кислоты с массовой долей 92…93 % олеум различной концентрации.
В настоящее время в производстве серной кислоты и олеума контактным способом наиболее распространенной является технологическая схема с использованием принципа двойного контактирования ДК—ДА (двойное контактирование — двойная абсорбция).
2. Принципиальная технологическая схема производства серной кислоты контактным способом
Производство серной кислоты из серы
Технологический процесс производства серной кислоты из элементарной серы контактным способом отличается от процесса производства из колчедана рядом особенностей [1]:
особая конструкция печей для получения печного газа;
повышенное содержание оксида серы (IV
отсутствие стадии предварительной очистки печного газа. Производство серной кислоты из серы по методу двойного контактирования и двойной абсорбции (рис. 4) состоит из нескольких стадий:
Воздух после очистки от пыли подается газодувкой в сушильную башню, где он осушается 93-98%-ной серной кислотой до содержания влаги 0,01% по объему; Осушенный воздух поступает в серную печь после предварительного подогрева в одном из теплообменников контактного узла.
Сжигание (горение) серы представляет собой гомогенную экзотермическую реакцию, которой предшествуют переход твердой серы в жидкое состояние и ее последующее испарение:
S
Таким образом, процесс горения протекает в газовой фазе в потоке предварительно высушенного воздуха и описывается уравнением:
S + О2 → SO2 + 297,028 кДж;
Для сжигания серы используют печи форсуночного и циклонного типов. В форсуночных печах расплавленная сера распыляется в камере сгорания сжатым воздухом через форсунки, которые не могут обеспечить достаточно полного перемешивания паров серы с воздухом и необходимой скорости горения. В циклонных печах, работающих по принципу центробежных пылеуловителей (циклонов), достигается значительно лучшее смешивание компонентов и обеспечивается более высокая интенсивность горения серы, чем в форсуночных печах.
Газ, содержащий 10-14% по объему SO2 , охлаждается в котле и после разбавления воздухом до содержания SO2 9-10% по объему при 420°С поступает в контактный аппарат на первую стадию конверсии, которая протекает на трех слоях катализатора (SO2 +V2 O2 →SO3 +96,296 кДж), после чего газ охлаждается в теплообменниках;
Затем газ, содержащий 8,5-9,5% SO3 , при 200°С поступает на первую стадию абсорбции в абсорбер, орошаемый олеумом и 98%-ной серной кислотой: SO3 + Н2 О→Н2 SO4 +130,56 кДж;
Далее газ проходит очистку от брызг серной кислоты, нагревается до 420°С и поступает на вторую стадию конверсии, протекающую на двух слоях катализатора. Перед второй стадией абсорбции газ охлаждается в экономайзере и подается в абсорбер второй ступени, орошаемый 98%-ной серной кислотой, и затем после очистки от брызг выбрасывается в атмосферу.
Печной газ при сжигании серы отличается более высоким содержанием оксида серы (IV
Эта схема отличается простотой и получила название «короткой схемы» (рис. 5).
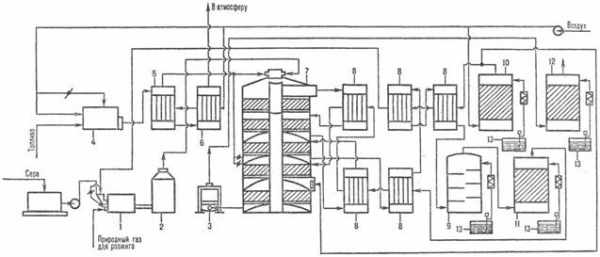
Рис. 4. Схема производства серной кислоты из серы по методу ДК—ДА [3]:
1-серная печь; 2-котел-утилизатор; 3 — экономайзер; 4-пусковая топка; 5, 6-теплообменники пусковой топки; 7-контактный аппарат; 8-теплообменники; 9-олеумный абсорбер; 10-сушильная башня; 11 и 12-соотв. первый и второй моногидратные абсорберы; 13-сборники кислоты.
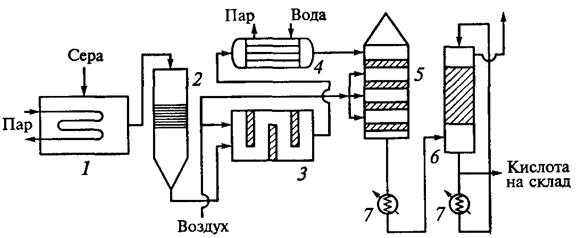
Рис.5. Производство серной кислоты из серы (короткая схема) [2]:
1 — плавильная камера для серы; 2 — фильтр жидкой серы; 3 — печь для сжигания серы; 4 — котел-утилизатор; 5 — контактный аппарат;
6 — система абсорбции оксида-серы ( VI ); 7— холодильники серной кислоты
Существующие установки по производству серной кислоты из серы, снабженные печами циклонного типа, имеют производительность 100 т серы и более в сутки. Разрабатываются новые конструкции производительностью до 500 т/сут.
Расход на 1 т моногидрата: серы 0,34 т, воды 70 м3 , электроэнергии 85 кВт-ч.
Производство серной кислоты из железного колчедана
Производство серной кислоты из сульфидов металлов существенно сложнее.
Технологическая схема производства серной кислоты из железного колчедана с использованием принципа двойного контактирования ДК—ДА показана на рисунке 6. Колчедан через дозатор подают в печь 1 кипящего слоя. Полученный запыленный обжиговый газ, содержащий 13 % SO 2 и имеющий на выходе из печи температуру около 700°С, подают сначала в котел-утилизатор 3, а затем на стадию сухой очистки от огарковой пыли (в циклоны 4 и в сухой электрофильтр 5).
В котле-утилизаторе 3 происходит охлаждение газа с одновременным получением энергетического водяного пара (давление 4 МПа и температура 450 °С), который может быть использован как в самой установке для компенсации затрат энергии на работу компрессоров и насосов, так и в других цехах завода.
В очистном отделении, состоящем из двух промывных башен 6 и 7, двух пар мокрых электрофильтров 8 и 9 и сушильной башни 10, происходит очистка газа от соединений мышьяка, селена, фтора и его осушка.
Первая полая промывная башня 6 работает в испарительном режиме: циркулирующая кислота охлаждает газ, при этом теплота затрачивается на испарение воды из кислоты, поступающей на орошение. Концентрацию орошающей кислоты в первой башне, равную 40… 50%-ной H 2 SO 4 , поддерживают постоянной путем разбавления 10… 15%-ной кислотой из второй промывной башни 7. Кислота из второй башни поступает в сборник 18 и после охлаждения возвращается на орошение.
После второй промывной башни газ проходит последовательно две пары мокрых электрофильтров 8 и 9, затем насадочную сушильную башню 10, орошаемую 93…94%-ной серной кислотой при температуре 28…30°С. Кислота циркулирует между сушильной башней 10 и сборником 18, часть кислоты отводится как готовая продукция на склад. Для поддержания постоянной концентрации H 2 SO 4 в сборник кислоты 18 вводят 98… 99%-ную кислоту из моногидратных абсорберов 17 и 20.Для поддержания постоянной температуры на стадии осушки циркулирующую кислоту охлаждают в холодильнике воздушного охлаждения 22. Перед сушильной башней обжиговый газ разбавляют воздухом для снижения в нем концентрации SO 2 до 9 % и увеличения избытка кислорода в соответствии с оптимальными условиями окисления диоксида серы.
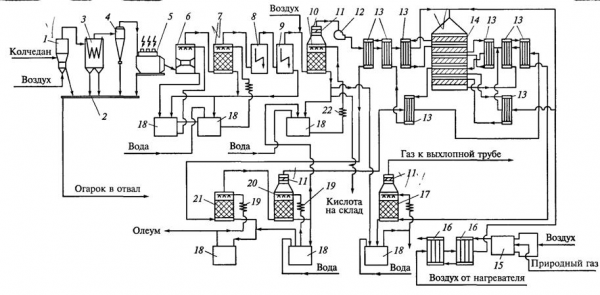
Рис.4 . Технологическая схема производства серной кислоты из колчедана по способу ДК—ДА [3]:
1 — печь; 2 — система гидроудаления огарка; 3 — котел-утилизатор; 4 — циклон с пересыпным устройством; 5 — сухой электрофильтр; 6— полая промывная башня; 7— насадочная промывная башня; 8,9— мокрые электрофильтры; 10— сушильная башня; 11— фильтр-брызгоуловитель; 12 — турбогазодувка; 13 —теплообменники контактного узла; 14 — контактный аппарат; 15 — пусковой подогреватель; 16 — теплообменник; 17 — второй моногидратный абсорбер; 18 —сборник кислоты; 19 — холодильник; 20 — первый моногидратный абсорбер; 21 — олеумный абсорбер; 22 — холодильник воздушного охлаждения кислоты
После сушильной башни обжиговый газ проходит через фильтр-брызгоуловитель 11 и поступает в турбогазодувку 12. В теплообменниках 13 газ нагревается за счет теплоты продуктов реакции до температуры зажигания катализатора (420…440°С) и поступает на первый слой контактного аппарата, где происходит окисление 74 % SO 2 с одновременным повышением температуры до 600°С. После охлаждения до 465°С газ поступает на второй слой контактного аппарата, где степень превращения достигает 86%, а температура газа возрастает до 514ºС. После охлаждения до температуры 450ºС газ поступает на третий слой контактного аппарата, где степень превращения SO 2 увеличивается до 94…94,5 %, а температура повышается до 470°С.
Затем в соответствии с требованиями метода ДК—ДА реакционный газ охлаждают в теплообменниках 13 до 100°С и направляют на абсорбцию первой ступени: сначала в олеумный абсорбер 21, затем в моногидратный абсорбер 20. После моногидратного абсорбера и фильтра-брызгоуловителя газ вновь нагревают до температуры 430°С и подают на четвертый слой катализатора. Концентрация SO 2 в газе составляет теперь 0,75…0,85 %. В четвертом слое происходит окисление остаточного SO 2 с конверсией ≈ 80 %, сопровождающееся повышением температуры до 449°С. Реакционную смесь вновь охлаждают до температуры 409°С и направляют на последний (пятый) слой контактного аппарата. Общая степень превращения после пяти стадий контактирования составляет 99,9%.
Газовую смесь после охлаждения направляют в моногидратный абсорбер второй ступени абсорбции 17. Непоглощенный газ, состоящий в основном из воздуха, пропускают через фильтр 11 для выделения брызг и тумана и выбрасывают в атмосферу через выхлопную трубу.
Производительность установки составляет до 1500 т/сут по моногидрату.
Расход на 1 т моногидрата: колчедана 0,82 т, воды 50 м3 , электроэнергии 82 кВт -ч.
Производство серной кислоты из сероводорода.
Способ получения серной кислоты из сероводорода, так называемый мокрый катализ (разработчики И.А.Ададуров, Д. Гернст, 1931 г.), состоит в том, что смесь оксида серы (IV ) и паров воды, полученная сжиганием сероводорода в потоке воздуха, подается в контактный аппарат без разделения, где оксид серы (IV ) окисляется при твердом ванадиевом катализаторе до оксида серы (VI ).
Затем газовая смесь охлаждается в конденсаторе, где пары образующейся серной кислоты превращаются в жидкий продукт.
Таким образом, в отличие от способов производства серной кислоты из колчедана и серы в процессе мокрого катализа отсутствует специальная стадия абсорбции оксида серы (VI ) и весь процесс включает только три последовательных стадии [3]:
1) сжигание сероводорода с образованием смеси оксида серы (IV
H 2 S + 1,5О2 → SO 2 + Н2 О — ΔН
где ΔН = 519 кДж
2) окисление оксида серы (IV
SO 2 + 0,5О2 ↔ SO 3 — ΔН 2
где ΔН 2 = 96 кДж
3) конденсация паров и образование серной кислоты:
S О3 + Н2 О↔H 2 S О4 — ΔН 3
где ΔН 3 = 92 кДж.
Таким образом, процесс мокрого катализа описывается суммарным уравнением
H 2 S + 2О2 → H 2 SO 4 — ΔН
где ΔН = 707 кДж.
В качестве сырья при производстве серной кислоты по методу мокрого катализа используют высококонцентрированный сероводородный газ (объемная доля сероводорода до 90%), являющийся отходом некоторых производств.
Так как газ при выделении подвергается промывке, то не нуждается в особой стадии очистки, а продукты его сжигания не содержат вредных примесей и также не требуют очистки. Это наряду с отсутствием в технологической схеме стадии абсорбции существенно упрощает процесс производства.
Технологическая схема производства серной кислоты из сероводорода включает в себя следующие операции:
сжигание сероводородного газа при большом избытке воздуха для исключения перегрева вследствие выделения большого количества теплоты;
охлаждение газопаровой смеси от 1000 до 400ºС в котле-утилизаторе;
разбавление газопаровой смеси воздухом до оптимального для контактирования состава;
контактирование в контактных аппаратах, термостатируемых введением воздуха между слоями катализатора;
охлаждение конвертированного газа в башнях, орошаемых сер-. ной кислотой, с образованием продукционной серной кислоты и сернокислотного тумана, улавливаемого в электрофильтрах.
Теоретически, при абсолютно сухих сероводородном газе и воздухе, должна образоваться 100%-ная серная кислота. На практике вследствие присутствия в воздухе паров воды концентрация получаемой кислоты не превышает 96 %, при пересчете на сероводород — 97 %. Производительность существующих установок, работающих по способу мокрого катализа, достигает 300 т/сут по моногидрату серной кислоты.
3. Расчетная часть, Исходные данные
Вариант №2
Объем газа, поступающего на контактирование – 6000 н.м3
В том числе SО2 – 7,1 % об., N2 – 81% об., О2 – 11,9% об.
Степень контактирования – 97,9%
Тепловые потери от приходной части баланса – 10,5%
Требуется рассчитать процесс контактирования
Материальный баланс
Состав газа поступающего на контактирование
компонент
об.%
н·м3
кмоль
кг
SО2
7,1
426
19,02
1217,28
N2
81
4860
216,96
6074,88
О2
11,9
714
31,88
1020,16
Всего
100
6000
267,86
8312,32
Пример расчета первой строки:
6000·7,1%=426 н·м3 ;
1 моль газа при нормальных условиях занимает 22,4 л, следовательно 426/22,4=19,02 кмоль;
Молярная масса SО2 составляет 32+2·16=64 г/моль, соответственно масса 19,02·кмоль SО2 составит 19,02·64=1217,28 кг
Аналогично рассчитываются значения в остальных строках.
Расчет состава газа после контактирования.
Окисление SО2 в SО3 происходит по реакции:
2SО2 +О2 →2 SО3
При степени контактирования 97,9% количество образовавшегося ангидрида составит:
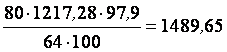 кг
кг
Осталось SО2
1217,28·0,021=25,56 кг
Количество кислорода, вступившее в реакцию окисления:
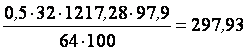 кг
кг
Осталось кислорода:
1020,16 – 297,93=722,23 кг
Состав газа после контактирования
компонент
об.%
н·м3
кмоль
кг
SО2
0,15
8,94
0,399
25,56
N2
83,91
4860
216,96
6074,88
О2
8,73
505,55
22,569
722,23
SО3
7,20
417,11
18,621
1489,65
Всего
100,00
5791,50
258,549
8312,32
Пример расчета первой строки:
Масса оставшегося SО2 составляет 25,56 кг, что составляет 25,56/64=0,399 кмоль;
Объем газа 0,399·22,4=8,94;
Аналогично рассчитываются значения в остальных строках;
После подсчета общего объема вычисляем долю каждого газа;
Для SО2 8,94/5791,50·100%=0,15%
Сведем полученные данные втаблицу:
Материальный баланс контактного узла
Введено
Выведено
компонент
кг
об. %
компонент
кг
об. %
SО2
1217,28
7,1
SО2
25,56
0,15
N2
6074,88
81
N2
6074,88
83,91
О2
1020,16
11,9
О2
722,23
8,73
SО3
1489,65
7,20
Всего
8312,32
100
Всего
8312,32
100,00
Тепловой баланс
Уравнение теплового баланса:
Q1 +Q2 =Q1 ‘+Q2 ‘,
где Q1 – тепло, вносимое газами;
Q2 – тепло экзотермической реакции окисления;
Q1 ‘ – тепло, уносимое газами после контактирования;
Q2 ‘ – тепловые потери.
Расчет введенного тепла:
Q1 =![]() ,
,
Где
Q1 =50·(9,96·19,02+6,81·216,96+7,01·31,88)=94520,8 ккал
Тепло экзотермической реакции окисления Q2
Изменение теплового эффекта реакции
2SО2 +О2 ↔2 SО3
С температурой выражается зависимостью:
Q=24205-2,21·Т ккал/кмоль
Число контактных аппаратов неизвестно, поэтому среднюю температуру контактирования можно принять равной 500ºС
Q=24205-2,21·773=22495 ккал/кмоль
Q 2 =Q· ![]() =22495·18,621=418879,4 ккал
=22495·18,621=418879,4 ккал
Σ Q=Q 1 +Q 2 =94520,8+418879,4=513400,2 ккал
Расчет выведенного тепла
Температуру выходящих из контактного узла газов можно принять ≈250ºС
Q1 =![]()
Q1 =t·(15,33·18,621+10,52·0,399+6,97·216,96+7,22·22,569)=1954,8·t ккал
Тепловые потери в размере 5% от
Q 2 =0,105 ·Σ Q=0,105·513400,2=53907,0 ккал
513400,2=53907,0+1954,8·t
t=235ºС
Тепловой баланс контактного узла
Введено
Выведено
Статья баланса
ккал
%
Статья баланса
ккал
%
Физическое тепло газов
94520,8
18,41
Тепло отходящих газов
459493,2
89,5
Тепло экзотермической реакции
418879,4
81,59
Тепловые потери
53907,0
10,5
513400,2
100
513400,2
100
Выводы
При расчете материального и теплового баланса сумма введенных и выведенных элементов одинакова, из чего следует, что расчеты произведены корректно
Заключение
В курсовом проекте рассмотрены теоретические аспекты производства серной кислоты из различного сырья. Описаны технологические схемы и процессы протекающие на каждой стадии.
Рассчитан процесс контактирования при производстве серной кислоты из серного колчедана для объема газа, поступающего в зону реакции 6000 н.м3 , степени контактирования 97,9% и составе газа SО2 – 7,1 % об., N2 – 81% об., О2 – 11,9% об. Произведен расчет материального и теплового баланса при заданных тепловых потерях.
