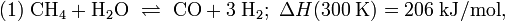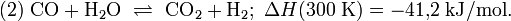(метиловый спирт, древесный спирт[1] , карбинол, метилгидрат, гидроксид метила) — CH3 OH, простейший одноатомный спирт, бесцветная ядовитая жидкость. Метанол — это первый представитель гомологического ряда одноатомных спиртов.
С воздухом в объёмных концентрациях 6,72—36,5% образует взрывоопасные смеси (температура вспышки 15,6 °C).
Метанол смешивается в любых соотношениях с водой и большинством органических растворителей.
1. Получение
До 1960-х годов метанол синтезировали только на цинкхромовом катализаторе при температуре 300—400 °C и давлении 25—40 МПа (= 250—400 Бар = 254,9—407,9 кгс/см²).
Впоследствии распространение получил синтез метанола на медьсодержащих катализаторах (медьцинкалюмохромовом, медь-цинкалюминиевом или др.) при 200—300 °C и давлении 4—15 МПа (= 40—150 Бар = 40,79—153 кгс/см²).
Современный промышленный метод получения — каталитический синтез из оксида углерода(II) (CO) и водорода (2H 2 ) при следующих условиях:
- температура — 250 °C,
- давление — 7МПа (= 70 Бар = 71,38 кгс/см²),
- катализатор — смесь ZnO (оксид цинка) и CuO (оксид меди(II)):
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»).
В данное время этот способ имеет второстепенное значение.
Также известны схемы использования с этой целью отходов нефтепереработки, коксующихся углей.
CO 2 + 3H2 <—> CH3 OH + H2 O + 49.53 кДж/моль
H 2 O + CO <—> CO2 + H2 + 41.2 кДж/моль
Молекулярная формула — CH 4 O или CH3 —OH, а структурная: 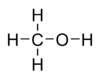 В настоящее время метиловый спирт получают синтетическим способом из монооксида углерода и водорода при температуре 300—400 °C и давления 300—500 атм в присутствии катализатора — смеси оксидов цинка, хрома и др. Сырьем для синтеза метанола служит синтез-газ (CO + H2), обогащенный водородом: :CO + 2 H2 → CH3 OH[2]
В настоящее время метиловый спирт получают синтетическим способом из монооксида углерода и водорода при температуре 300—400 °C и давления 300—500 атм в присутствии катализатора — смеси оксидов цинка, хрома и др. Сырьем для синтеза метанола служит синтез-газ (CO + H2), обогащенный водородом: :CO + 2 H2 → CH3 OH[2]
Производство метанола (в тыс. тон):
Виробництво метилового спирту (метанолу)
... методів його виробництва. Крім описаних вище методів трифазного синтезу до них відносяться: Синтез метанолу прямим окисленням метанолу повітрям на цинк-нікель-кадмієві каталізаторі, що дозволяє ... спирт). У чистому вигляді виділений в 1834 році Ж.Дюма і Е.Пеліго, що встановили його формулу, синтезований омиленням хлористого метилу М.Бертло в 1857 році. Промислове виробництво метанолу синтезом ...
| год | США | Германия | Мир | Продажная цена ($/т) |
|---|---|---|---|---|
| 1928 | 24 | 18 | нет данных | нет данных |
| 1936 | 97 | 93 | нет данных | нет данных |
| 1950 | 360 | 120 | нет данных | нет данных |
| 1960 | 892 | 297 | нет данных | 99,7 |
| 1970 | 2238 | нет данных | 5000 | 89,7 |
| 1980 | 3176 | 870 | 15000 | 236,1 |
| 2004 | 3700 | 2000 | 32000 | 270 |
Крупнейшим производителем метанола в России является губахинский ОАО «Метафракс».
2. Применение
В органической химии метанол используется в качестве растворителя.
Метанол используется в газовой промышленности для борьбы с образованием гидратов (из-за низкой температуры замерзания и хорошей растворимости).
В органическом синтезе метанол применяют для выпуска формальдегида и формалина, уксусной кислоты, ряда эфиров (например, МТБЭ и ДМЭ), изопрена и др.
Наибольшее его количество идёт на производство формальдегида, который используется для производства фенолформальдегидных смол. Значительные количества CH 3 OH используют в лакокрасочной промышленности для изготовления растворителей при производстве лаков. Кроме того, его применяют (ограниченно из-за гигроскопичности и отслаивания) как добавку к жидкому топливу для двигателей внутреннего сгорания. Используется в топливных элементах.
Благодаря высокому октановому числу, что позволяет увеличить степень сжатия до 16 и большей на 20 % энергетической мощностью заряда на основе метанола и воздуха, метанол используется для заправки гоночных мотоциклов и автомобилей. Метанол горит в воздушной среде, и при его окислении образуется двуокись углерода и вода:
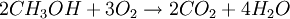
метанолом
Во многих странах метанол применяется в качестве денатурирующей добавки к этанолу при производстве парфюмерии. В России использование метанола в потребительских товарах запрещено.
При добыче газа гидраты могут образовываться в стволах скважин, промысловых коммуникациях и магистральных газопроводах. Отлагаясь на стенках труб, гидраты резко уменьшают их пропускную способность. Для борьбы с образованием гидратов на газовых промыслах вводят в скважины и трубопроводы различные ингибиторы (метиловый спирт, гликоли).
Работа топливных элементов основана на реакции окисления метанола на катализаторе в диоксид углерода. Вода выделяется на катоде. Протоны (H+ ) проходят через протонообменную мембрану к катоду где они реагируют с кислородом и образуют воду. Электроны проходят через внешнюю цепь от анода к катоду снабжая энергией внешнюю нагрузку.
Реакции:
На аноде CH3 OH + H2 O → CO2 + 6H+ + 6e−
На катоде, Общая для топливного элемента:
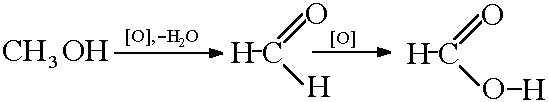
Получение муравьиной кислоты окислением метанола:
Получение диметилового эфира дегидратацией метанола при 300—400 °C и 2-3 МПа в присутствии гетерогенных катализаторов — алюмосиликатов — степень превращения метанола в диметиловый эфир — 60 % или цеолитов — селективность процесса близка к 100 %. Диметиловый эфир (C 2 H6 O) — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38-53.
Метил-трет-бутиловый эфир получается при взаимодействии метанола с изобутиленом в присутствии кислых катализаторов (например, ионообменных смол).
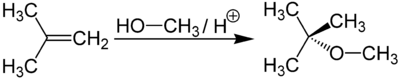
Метил-трет-бутиловый эфир (C 5 H12 O) применяется в качестве добавки к моторным топливам, повышающей октановое число бензинов (антидетонатор).
Максимальное законодательное содержание МТБЭ в бензинах Европейского союза — 15 %, в Польше — 5 %. В России в среднем составе бензинов содержание МТБЭ составляет до 12 % для АИ92 и до 15 % для АИ95, АИ98.
2.1. Гомологизация метанола
Гомологизация, то есть превращение органического соединения в свой гомолог путём внедрения одной или нескольких метиленовых групп, для спиртов была впервые осуществлена в 1940 году — на основе метанола каталитическим путём под воздействием высокого давления был синтезирован этанол[3] :
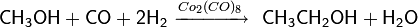
Реакция гомологизации по своему механизму близка реакции гидроформилирования алкенов и в настоящее время с помощью модифицированных катализаторов кобальта и рутения и добавления йодид-ионов в качестве промоторов удаётся добиться 90 % выхода по этанолу [3] .
Исходный метанол также получают из окиси углерода (катализаторы на основе оксидов меди и цинка, давление 5-10 МПа, температура 250 °C)[3] , так что общая схема выглядит следующим образом:
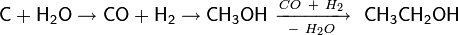
Побочными продуктами реакции в случае синтеза этанола будут ацетальдегид, этилен и диэтиловый эфир.
В 1940 году впервые была осуществлена катализируемая оксидом кобальта при давлении 600 атм реакция метанола с синтез-газом с образованием в качестве основного продукта этанола… Впоследствии эта реакция, названная гомологизацией, вызвала огромный интерес у химиков. Ее привлекательность связана с возможностью получения этилена из угольного сырья Применение в качестве катализаторов карбонила кобальта Со2(СО)8 позволило понизить давление до 250 атм, при этом степень превращения метанола составила 70 %, а основной продукт — этанол образовывался с селективностью 40 %. В дальнейшем были предложены более селективные катализаторы на основе соединений кобальта и рутения с добавками фосфиновых лигандов и было установлено, что реакцию можно ускорить с помощью введения промоторов — иодид-ионов. В настоящее время удалось достичь селективности по этанолу 90 %. Хотя механизм гомологизации до конца не установлен, можно считать, что он близок к механизму карбонилирования метанола.
[4]
2.2. Биометанол
Промышленное культивирование и биотехнологическая конверсия морского фитопланктона рассматривается как одно из наиболее перспективных направлений в области получения биотоплива. [5]
В начале 80-х рядом европейских стран совместно разрабатывался проект, ориентированный на создание промышленных систем с использованием прибрежных пустынных районов. Осуществлению этого проекта помешало общемировое снижение цен на нефть.
Первичное производство биомассы осуществляется путём культивирования фитопланктона в искусственных водоёмах, создаваемых на морском побережье.
Вторичные процессы представляют собой метановое брожение биомассы и последующее гидроксилирование метана с получением метанола .
Основными доводами в пользу использования микроскопических водорослей являются следующие:
- высокая продуктивность фитопланктона (до 100 т/га в год);
- в производстве не используются ни плодородные почвы, ни пресная вода;
- процесс не конкурирует с сельскохозяйственным производством;
- энергоотдача процесса достигает 14 на стадии получения метана и 7 на стадии получения метанола;
С точки зрения получения энергии данная биосистема имеет существенные экономические преимущества по сравнению с другими способами преобразования солнечной энергии.
3. Метанол в качестве топлива
При применении метанола в качестве топлива следует отметить, что объемная и массовая энергоемкость (теплота сгорания) метанола на 40-50 % меньше, чем бензина, однако при этом теплопроизводительность спиртовоздушных и бензиновых топливовоздушных смесей при их сгорании в двигателе различается незначительно по той причине, что высокое значение теплоты испарения метанола способствует улучшению наполнения цилиндров двигателя и снижению его теплонапряженности, что приводит к повышению полноты сгорания спиртовоздушной смеси. В результате этого рост мощности двигателя повышается на 10-15 %. Двигатели гоночных автомобилей работающих на метаноле с более высоким октановым числом чем бензин имеют степень сжатия, превышающую 15:1, в то время как в обычном ДВС с искровым зажиганием степень сжатия для неэтилированного бензина как правило, не превышает 11.5:1. Метанол может использоваться как в классических двигателях внутреннего сгорания, так и в специальных топливных элементах для получения электричества.
| Топливо | Плотность
энергии |
смесь воздуха
с топливом |
Удельная
энергия смеси воздуха с топливом |
Удельная теплота
испарения |
Октановое число (RON) | Октановое число (MON) |
|---|---|---|---|---|---|---|
| бензин | 32 МДж/л | 14.6 | 2.9 МДж/кг воздух | 0.36 МДж/кг | 91-99 | 81-89 |
| Бутиловый спирт | 29.2 МДж/л | 11.1 | 3.2 МДж/кг воздух | 0.43 МДж/кг | 96 | 78 |
| этанол | 19.6 МДж/л | 9.0 | 3.0 МДж/кг воздух | 0.92 МДж/кг | 132 | 89 |
| Метанол | 16 МДж/л | 6.4 | 3.1 МДж/кг воздух | 1.2 МДж/кг | 156 | 92 |
Недостатки
- метанол травит алюминий. Проблемным является использование алюминиевых карбюраторов и инжекторных систем подачи топлива в ДВС.
- гидрофильность. Метанол втягивает воду, что является причиной засорения систем подачи топлива в виде желеобразных ядовитых отложений.
- метанол , как и этанол, повышает пропускную способность пластмассовых испарений для некоторых пластмасс (например плотного полиэтилена).
Эта особенность метанола повышает риск увеличения эмиссии летучих органических веществ, что может привести к уменьшению концентрации озона и усилению солнечной радиации.
- уменьшенная летучесть при холодной погоде: Моторы, работающие на метаноле, могут иметь проблемы с запуском и отличаться повышенным расходом топлива до достижения рабочей температуры.
Низкий уровень примесей метанола может быть использован в топливе существующих транспортных средств с использованием надлежащих ингибиторов коррозии. Т. н. европейская директива качества топлива (European Fuel Quality Directive) позволяет использовать до 3 % метанола с равным количеством присадок в бензине, продаваемoм в Европе. Сегодня в Китае используется более 1000 миллионов галлонов метанола в год в качестве транспортного топлива в смесях низкого уровня, используемых в существующих транспортных средств, а также высоко- уровневые смеси в транспортных средствах, предназначенных для использования метанола в качестве топлива. Помимо применения метанола в качестве альтернативы бензина существует технология применения метанола для создания на его базе угольной суспензии которая в США имеет коммерческое наименование «метакол» (methacoal [7] ).
Такое топливо предлагается как альтернатива мазута, широко используемого для отопления зданий (Топочный мазут).
Такая суспензия в отличие от водоуглеродного топлива не требует специальных котлов и имеет более высокую энергоемкость. С экологической точки зрения такое топливо имеет меньший «углеродный след»[8] , чем традиционные варианты синтетического топлива получаемого из угля с использованием процессов, где часть угля сжигается во время производства жидкого топлива.
4. Свойства метанола и его реакции
При написании этой статьи использовался материал из Энциклопедического словаря Брокгауза и Ефрона (1890—1907).
Метанол — бесцветная жидкость с запахом, напоминающим запах этилового спирта. Температура кипения 66,78° (Renault); 64,8° (Vincent и Delachanal); 65,75-66,25° (Grodzki и Krämer); 65,8-66° (Perkin); 64,96° при 760 мм (Dittmar и Fawsitt); 64,8° при 763 мм (Шифф).
Удельный вес при 0°/0° = 0,8142 (Копп); при 15°/15° = 0,79726; при 25°/25° = 0,78941 (Perkin); при 64,8°/4° = 0,7476 (Шифф); при 0°/4° = 0,81015; при 15,56°/4° = 0,79589 (Dittmar и Fawsitt).
Капиллярная постоянная при температуре кипения a ² =5,107 (Шифф); Критическая температура 241,9° (Шмидт).
Упругость пара при 15° = 72,4 мм; при 29,3° = 153,4 мм; при 43° = 292,4 мм; при 53° = 470,3 мм; при 65,4° = 756,6 мм (Д. Коновалов).
Теплота горения равна 170,6, теплота образования 61,4 (Штоман, Клебер и Лангбейн).
Метанол смешивается во всех отношениях с водой, этиловым спиртом и эфиром; при смешении с водой происходит сжатие и разогревание. Горит синеватым пламенем. Подобно этиловому спирту — сильный растворитель, вследствие чего во многих случаях может заменять этиловый спирт. В крепких водных растворах метанол, принятый внутрь, ядовит. Безводный метанол, растворяя небольшое количество медного купороса, приобретает голубовато-зеленое окрашивание, поэтому безводным медным купоросом нельзя пользоваться для открытия следов воды в метаноле; но он не растворяет CuSO 4 .7H2 O (Клепль).
Метанол дает со многими солями соединения, подобные кристаллогидратам, например: CuSO 4 .2СН 3 ОН; LiCl.3СН 3 ОН; MgCl 2 .6СН 3 ОН; CaCl 2 .4СН 3 ОН представляет собой шестисторонние таблицы, разлагаемые водой, но не разрушаемые нагреванием до 100° (Kane).
Соединение ВаО.2СН 3 ОН.2Н 2 O получается в виде блестящих призм при растворении ВаО в водном Метаноле и испарении на холоде полученной жидкости при комнатной температуре (Форкранд).
С едкими щелочами метанол образует соединения 5NaOH.6СН 3 ОН; 3KOH.5СН 3 OH (Геттиг).
При действии металлических калия и натрия легко дает алкоголяты, присоединяющие к себе кристаллизационный метанол и иногда воду. При пропускании паров метанола через докрасна накаленную трубку получается C 2 H2 и др. продукты (Бертло).
При пропускании паров метанола над накаленным цинком получается окись углерода, водород и небольшие количества болотного газа (Jahn).
Медленное окисление паров метанола при помощи раскаленной платиновой или медной проволоки представляет лучшее средство для получения больших количеств формальдегида: 2СН 3 ОН+О 2 =2НСНО+2Н 2 О. При действии хлористого цинка и высокой температуры метанол дает воду и углеводороды формулы С n Н 2n+2 , а также небольшие количества гексаметилбензола (Лебедь и Грин).
Метанол, нагретый с нашатырем в запаянной трубке до 300°, дает моно-, ди- и триметиламины (Бертло).
С белильной известью не дает хлороформа (Гольдберг).
При пропускании паров метанола над едким кали при высокой температуре выделяется водород и образуются последовательно муравьинокислый, щавелевокислый и, наконец, углекислый калий; концентрированная серная кислота дает метилсерную кислоту CH 3 HSO4 , которая при дальнейшем нагревании с Метанолом дает метиловый эфир (см.).
При перегонке метанола с избытком серной кислоты в отгон переходит диметилсерная кислота (CH 3 )2 SO4 . При действии серного ангидрида SO 3 получается CH(OH)(SO 3 H)2 и CH 2 (SO3 H)2 (см. Метилен).
Метанол при действии соляной кислоты, пятихлористого фосфора и хлористой серы дает хлористый метил СН3 Cl. Действием HBr и H 2 SO4 получают бромистый метил. Подкисленный 5%-й серной кислотой и подвергнутый электролизу, метанол дает СО 2 , СО, муравьинометиловый эфир, метилсерную кислоту и метилаль СН 2 (ОСН 3 )2 (Ренар).
При нагревании метанола с хлористо-водородными солями ароматических оснований (анилином, ксилидином, пиперидином) легко происходит замещение водорода в бензольном ядре метилом (Гофман, Ладенбург); реакция имеет большое техническое значение при приготовлении метилрозанилина и других искусственных пигментов.
5. Нахождение в природе
В свободном состоянии [9] метиловый спирт встречается в природе лишь изредка и в очень небольших количествах (например в эфирных маслах), но производные его распространены довольно широко. Так, например, многие растительные масла содержат сложные эфиры метилового спирта: масла гаултерии — метиловый эфир салициловой кислоты С6 H4 (OH)COOCH3 , масло жасмина — метиловый эфир антраниловой кислоты С6 H4 (NH2 )COOCH3 . Простые эфиры метилового спирта чрезвычайно часто встречаются среди природных веществ, например природных красителей, алкалоидов и т. п.
В промышленности метиловый спирт раньше получали исключительно путём сухой перегонки дерева. В жидких погонах, так называемом «древесном уксусе», наряду с уксусной кислотой (10 %), ацетоном (до 0,5 %), ацетальдегидом, аллиловым спиртом, метилацетатом, аммиаком и аминами содержится также 1,5-3 % метилового спирта. Для отделения уксусной кислоты продукты сухой перегонки пропускают через горячий раствор известкового молока, задерживающий её в виде уксуснокислого кальция. Значительно труднее отделить метиловый спирт от ацетона, так как температуры кипения их очень близки (ацетон, т.кип.56,5°; метиловый спирт, т.кип. 64,7°).
Все же путём тщательной ректификации на соответствующих колоннах в технике удается почти полностью отделить метиловый спирт от сопутствующего ему ацетона. Неочищенный метиловый спирт называется также «древесным спиртом».
6. Здравоохранение
Метанол — яд, действующий на нервную и сосудистую системы. Токсическое действие метанола обусловлено так называемым «летальным синтезом» — метаболическим окислением в организме до очень ядовитого формальдегида. Кроме того, метанол обладает кумулятивными свойствами, то есть накапливается в организме.
Приём внутрь 5—10 мл метанола приводит к тяжёлому отравлению (одно из последствий — слепота), а 30 мл и более — к смерти. Предельно допустимая концентрация метанола в воздухе равна 5 мг/м³ (вдвое ниже, чем у этанола и изопропилового спирта)[ [10] .
Наиболее легкая форма отравления характеризуется наличием головной боли, общей слабостью, недомоганием, ознобом, тошнотой, рвотой. Поэтому опасен для жизни не только метанол, но и жидкости, содержащие этот яд даже в сравнительно небольшом количестве.
Особая опасность метанола связана с тем, что по запаху и вкусу он неотличим от этилового спирта, из-за чего и происходят случаи его употребления внутрь. В домашних условиях метанол можно отличить следующим способом: свернуть из толстой медной проволоки спираль и накалить ее на огне до красного свечения; при опускании спирали в метанол происходит его каталитическое окисление с выделением формальдегида, обладающего весьма резким запахом; этанол же такого эффекта не дает (будет напоминать запах прелых яблок).
Второй способ — йодоформная реакция: с этиловым спиртом выпадет йодоформ желтого цвета, а с метанолом ничего не выпадает (реакция не подходит для определения содержания метанола в растворе этанола) [11] .
Как указано в руководстве для врача скорой медицинской помощи, при отравлении метанолом антидотом является этанол, который вводится внутривенно в форме 10 % раствора капельно или 30—40 % раствора перорально из расчёта 1—2 грамма раствора на 1 кг веса в сутки. [12] Полезный эффект в этом случае обеспечивается отвлечением АДГ I на окисление экзогенного этанола.[13]
Следует учесть, что при недостаточно точном диагнозе за отравление метанолом можно принять алкогольную интоксикацию, отравление дихлорэтаном или четырёххлористым углеродом — в этом случае введение дополнительного количества этилового спирта опасно. [12]
7. Интересные факты
- Сорт винограда Изабелла в последнее время был запрещён к использованию в коммерческом виноделии в США и странах Евросоюза по причине повышенного содержания метанола в винах, получаемых из данного сорта. Вероятная причина запрета — очень дешевые в производстве вина по сравнению с винами из винограда столовых сортов.
- 9-10 сентября 2001 года на западе Эстонии, в городе Пярну произошло массовое отравление метиловым спиртом. В результате отравления 68 человек погибли, 40 человек стали инвалидами II степени (в связи с потерей зрения и/или острого поражения мозга и нервной системы) и 3 человека получили инвалидность I степени.
- В настоящее время (2010 год) в России участились случаи продажи фальсифицированной незамерзающей жидкости для омывателей стёкол автомобилей: она содержит метиловый спирт и может негативно влиять на здоровье водителей, вызывая хроническое отравление парами метанола (при попадании жидкости на кожу при заливке жидкости в бачок, а также за счёт проникновения паров в салон автомобиля)[14] . В Европейском Союзе ограничения на использование метанола в незамерзающей жидкости нет.
- В мае-июле 2011 года 5 российских туристов скончались от отравления метанолом в Турции. Закончившийся трагедией яхт-тур был организован компанией в Бодруме 26-27 мая. С 28 мая в больницы начали поступать российские туристы с жалобами на симптомы острого отравления. Выяснилось, что в напитках, в частности, в коктейле «виски с колой», который употребляли туристы, содержался технический спирт — метанол. Кроме того, прогулочная яхта не имела лицензии на выход в море.
Примечания
- Древесный спирт — slovari.yandex.ru/dict/bse/article/00024/76100.htm — статья из Большой советской энциклопедии
- Рябчиков (1953 г.), «Общая химия», стр.253
- ↑ 1 2 3 Караханов Э.А. Синтез-газ как альтернатива нефти. II. Метанол и синтезы на его основе — window.edu.ru/window_catalog/files/r21356/9712_065.pdf // Соросовский образовательный журнал . — 1997. — № 12. — С. 68.
- Синтез-Газ Как Альтернатива Нефти. Часть Ii. Метанол И Синтезы На Его Основе — Караханов Э.А — www.pereplet.ru/obrazovanie/stsoros/454.html
- Waganer K. Mariculture on land . — Biomass, 1981
- Internal Combustion Engines, Edward F. Obert, 1973
- Energy Citations Database (ECD) — — Document #6329346 — www.osti.gov/energycitations/product.biblio.jsp?osti_id=6329346
- en:Carbon footprint
- П.КАРРЕР (1960 г.), «Курс органической химии», стр.117
- http://slovari.yandex.ru/~книги/Охрана%20труда/Спирты/ — slovari.yandex.ru/~книги/Охрана труда/Спирты/]
- http://forum.xumuk.ru/index.php?showtopic=48206 — forum.xumuk.ru/index.php?showtopic=48206
- ↑ 1 2 Острые отравления — www.med2000.ru/cito/otravl2.htm — Электронное справочное руководство для врача скорой медицинской помощи. Глава 15
- 3-pdf-prin_ash-2.pmd — www.inbi.ras.ru/ubkh/43/ashmarin.pdf
- Чем «незамерзайка» опасна для здоровья водителей — www.badshops.ru/art_auto/art_auto14.shtml
Данный реферат составлен на основе .