Арены или ароматические углеводороды – это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с особым характером химических связей.
 |
Общая формула класса: C n H2n-6 .
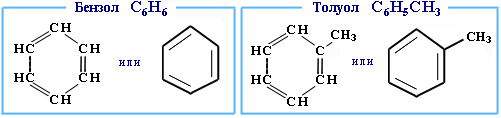
Простейшими представителями класса являются бензол и толуол:
 |
С 10 Н8
Термин «ароматические соединения» возник давно в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах. Однако в настоящее время в понятие «ароматичность» вкладывается совершенно иной смысл.
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией p-электронов в циклической системе.
Критерии ароматичности аренов:
1. Атомы углерода в sp 2 -гибридизованном состоянии образуют циклическую систему.
2. Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение).
3. Замкнутая система сопряженных связей содержит
4n+2 p-электронов (n – целое число).
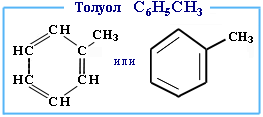 |
2. Толуол – формула, строение.
Толуол по своему строению подобен бензолу, отличием является лишь замещение одного атома водорода на группу (CH 3 ).
Рассмотрим строение бензола.
В 1825 году английский исследователь Майкл Фарадей при термическом разложении ворвани выделил пахучее вещество, которое имело молекулярную формулу C 6 Н6 . Это соединение, называемое теперь бензолом, является простейшим ароматическим углеводородом.
 |
Распространенная структурная формула бензола, предложенная в 1865 году немецким ученым Кекуле, представляет собой цикл с чередующимися двойными и одинарными связями между углеродными атомами:
 Однако физическими, химическими, а также квантово-механическими исследованиями установлено, что в молекуле бензола нет обычных двойных и одинарных углерод–углеродных связей. Все эти связи в нем равноценны, эквивалентны, т.е. являются как бы промежуточными «полуторными » связями, характерными только для бензольного ароматического ядра. Оказалось, кроме того, что в молекуле бензола все атомы углерода и водорода лежат в одной плоскости, причем атомы углерода находятся в вершинах правильного шестиугольника с одинаковой длиной связи между ними, равной 0,139 нм, и все валентные углы равны 120°. Такое расположение углеродного скелета связано с тем, что все атомы углерода в бензольном кольце имеют одинаковую электронную плотность и находятся в состоянии sp2 — гибридизации. Это означает, что у каждого атома углерода одна s- и две p- орбитали гибридизованы, а одна p- орбиталь негибридная. Три гибридных орбитали перекрываются: две из них с такими же орбиталями двух смежных углеродных атомов, а третья – с s- орбиталью атома водорода. Подобные перекрывания соответствующих орбиталей наблюдаются у всех атомов углерода бензольного кольца, в результате чего образуются двенадцать s- связей, расположенных в одной плоскости.
Однако физическими, химическими, а также квантово-механическими исследованиями установлено, что в молекуле бензола нет обычных двойных и одинарных углерод–углеродных связей. Все эти связи в нем равноценны, эквивалентны, т.е. являются как бы промежуточными «полуторными » связями, характерными только для бензольного ароматического ядра. Оказалось, кроме того, что в молекуле бензола все атомы углерода и водорода лежат в одной плоскости, причем атомы углерода находятся в вершинах правильного шестиугольника с одинаковой длиной связи между ними, равной 0,139 нм, и все валентные углы равны 120°. Такое расположение углеродного скелета связано с тем, что все атомы углерода в бензольном кольце имеют одинаковую электронную плотность и находятся в состоянии sp2 — гибридизации. Это означает, что у каждого атома углерода одна s- и две p- орбитали гибридизованы, а одна p- орбиталь негибридная. Три гибридных орбитали перекрываются: две из них с такими же орбиталями двух смежных углеродных атомов, а третья – с s- орбиталью атома водорода. Подобные перекрывания соответствующих орбиталей наблюдаются у всех атомов углерода бензольного кольца, в результате чего образуются двенадцать s- связей, расположенных в одной плоскости.
Четвертая негибридная гантелеобразная p- орбиталь атомов углерода расположена перпендикулярно плоскости направления s- связей. Она состоит из двух одинаковых долей, одна из которых лежит выше, а другая — ниже упомянутой плоскости. Каждая p- орбиталь занята одним электроном. р- Орбиталь одного атома углерода перекрывается с p- орбиталью соседнего атома углерода, что приводит, как и в случае этилена, к спариванию электронов и образованию дополнительной p- связи. Однако в случае бензола перекрывание не ограничивается только двумя орбиталями, как в этилене: р- орбиталь каждого атома углерода одинаково перекрывается с p- орбиталями двух смежных углеродных атомов. В результате образуются два непрерывных электронных облака в виде торов, одно из которых лежит выше, а другое – ниже плоскости атомов (тор – это пространственная фигура, имеющая форму бублика или спасательного круга).
Иными словами, шесть р- электронов, взаимодействуя между собой, образуют единое p- электронное облако, которое изображается кружочком внутри шестичленного цикла:
 |
правила Хюккеля
3. Физические свойства.
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Физические свойства некоторых аренов представлены в таблице.
| Название | Формула | t°.пл.,
°C |
t°.кип.,
°C |
d 4 20 |
| Бензол | C 6 H6 | +5,5 | 80,1 | 0,8790 |
| Толуол (метилбензол) | С 6 Н5 СH3 | -95,0 | 110,6 | 0,8669 |
| Этилбензол | С 6 Н5 С2 H5 | -95,0 | 136,2 | 0,8670 |
| Ксилол (диметилбензол) | С 6 Н4 (СH3 )2 | |||
| орто- | -25,18 | 144,41 | 0,8802 | |
| мета- | -47,87 | 139,10 | 0,8642 | |
| пара- | 13,26 | 138,35 | 0,8611 | |
| Пропилбензол | С 6 Н5 (CH2 )2 CH3 | -99,0 | 159,20 | 0,8610 |
| Кумол (изопропилбензол) | C 6 H5 CH(CH3 )2 | -96,0 | 152,39 | 0,8618 |
| Стирол (винилбензол) | С 6 Н5 CH=СН2 | -30,6 | 145,2 | 0,9060 |
4. Химические свойства.
Все свойства толуола можно разделить на 2 типа:
А) реакции, затрагивающие бензольное кольцо,
Б) реакции, затрагивающие метильную группу.
Реакции в ароматическом кольце.
1) Нитрирование:
1-Метил-2-нитробензол 1-Метил-4-нитробензол
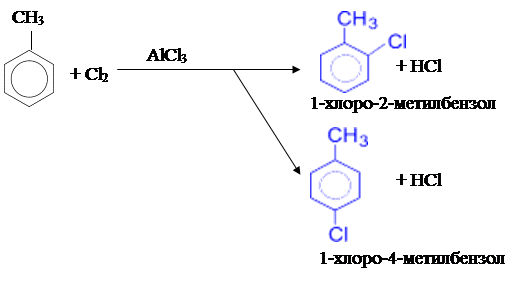
2) Хлорирование толуола может производиться путём пропускания через толуол газообразного хлора в присутствии хлорида алюминия (реакция проводится в темноте).
Хлорид алюминия играет при этом роль катализатора. В этом случае образуется 2- и 4-замещённый изомеры:
 |
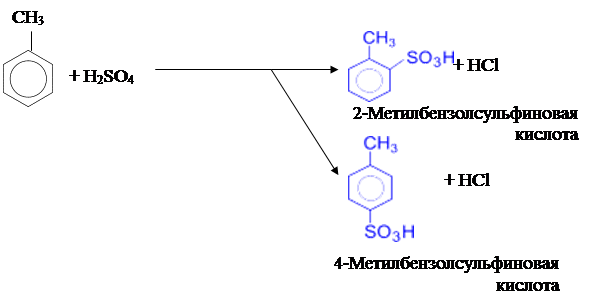
3) Сульфирование метилбензола концентрированой серной кислотой тоже приводит к образованию смеси 2- и 4-замещённого изомеров:
 |
Механизм всех реакций электрофильного замещения подобен механизму сообветствующих реакций бензола. В этих реакциях 3-замещённые изомеры образуются в незначительных количествах и ими можно пренебречь.
Реакции в боковой цепи.
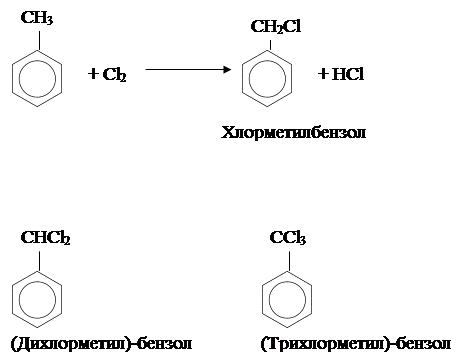 Подобно алканам, метильная группа может галогенироваться по радикальному механизму. Для осуществления этой реакции хлор продувают через кипящий метилбензол в присутствии солнечного света или источника ультрафиолетового излучения.
Подобно алканам, метильная группа может галогенироваться по радикальному механизму. Для осуществления этой реакции хлор продувают через кипящий метилбензол в присутствии солнечного света или источника ультрафиолетового излучения.
Обратим внимание, что эта реакция представляет собой замещение. Дальнейшее галогенирование приводит к образованию следующих соединений:
Бромирование метилбензола осуществляется при аналогичных условиях и приводит к образованию соответствующих бромозамещающенных соединений.
Метильная боковая цепь в толуоле подвергается окислению даже такими сравнительно мягкими окислителями, как оксид марганца (IV):
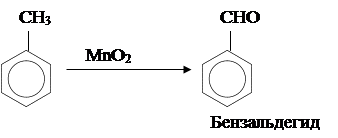 |
Более сильные окислители, например перманганат калия, вызывают дальнейшее окисление:
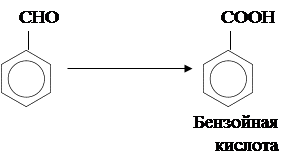
5. Получение.
Известны следующие способы получения ароматических углеводородов.
|
 |
 |
1) Каталитическая дегидроциклизация алканов, т.е. отщепление водорода с одновременной циклизацией (способ Б.А.Казанского и А.Ф.Платэ).
Реакция осуществляется при повышенной температуре с использованием катализатора, например оксида хрома.
|
|
|
 |
|
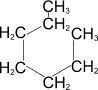
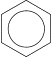
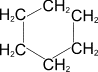
2) Каталитическое дегидрирование циклогексана и его производных (Н.Д.Зелинский).
В качестве катализатора используется палладиевая чернь или платина при 300°C.
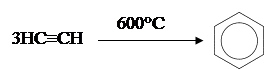 3) Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600°C (Н.Д.Зелинский).
3) Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600°C (Н.Д.Зелинский).
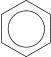 4) Сплавление солей ароматических кислот со щелочью или натронной известью.
4) Сплавление солей ароматических кислот со щелочью или натронной известью.
|
| |
6. Применение.
Ароматические углеводороды являются важным сырьем для производства различных синтетических материалов, красителей, физиологически активных веществ. Так, бензол – продукт для получения красителей, медикаментов, средств защиты растений и др. Толуол используется как сырье в производстве взрывчатых веществ, фармацевтических препаратов, а также в качестве растворителя. Винилбензол (стирол) применяется для получения полимерного материала – полистирола.
Список литературы:
[Электронный ресурс]//URL: https://drprom.ru/referat/toluol/
1. М. Фримантл – «Химия в действии»
2. CD-Informatica – «Химия для всех»
3. О.С. Габриелян – «Химия 10 класс»
4. Infinity – «Органическая химия: арены»
