| Диоксид углерода | |
|---|---|
 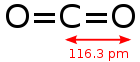  |
|
| Другие названия | углекислый газ, двуокись углерода,
сухой лёд(твердый) |
| Формула | CO 2 |
| Молярная масса | 44,0095(14) г/моль |
| В твердом виде | сухой лёд |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Свойства | |
| Плотность и фазовое состояние | 1,9769 кг/м³, при н.у.;
771 кг/м³, жидкий; 1512 кг/м³, твёрдый |
| Растворимость в воде | 1,45 кг/м³ |
| Удельная теплоемкость | 0,846 кДж/(кг*С) при 27 °C |
| Удельная теплота плавления | 25,13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (p K a ) | 6,35 и 10,33 |
| Вязкость | 0,07 пз при −78 °C |
| Строение | |
| Форма молекулы | линейная |
| Кристаллическая решётка | молекулярная |
| Дипольный момент | ноль |
| Техника безопасности | |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 | |
| R-phrases | R: As, Fb |
| S-phrases | S9, S23, S36 (ж) ] |
| RTECS number | FF6400000 |
| Страница дополнительных сведений | |
| n , εr , и т. д. | |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Родственные соединения | |
| Оксиды | CO
C 3 O2 C 2 O CO 3 |
| Если не указано иное, данные даны для
материалов при стандартных условиях (25 °C, 100 кПа) Infobox disclaimer and references |
|
Оксид углерода(IV)
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,038 %. [1]
Не следует путать с Диоксином.
1. Свойства
1.1. Физические
Плотность при нормальных условиях 1,97 кг/м³. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
1.2. Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
1.3. Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния).
Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
2. Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит).
Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В пищевых целях используется газ, образующийся при спиртовом брожении. После предварительной обработки газ закачивается в баллоны.
Также углекислый газ получают на установках разделения воздуха, как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой. Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
3. Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290 , а также в качестве разрыхлителя. Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (~ 65-70 Атм).
Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада.
Углекислый газ используется в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его диссоциация с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в аргоне или гелии.
Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в ледниках.
Твёрдая углекислота используется в качестве хладагента и рабочего тела в теплоэнергетических установках (в холодильниках, морозильниках, солнечных электрогенераторах и т. д.).
4. Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO 2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
5. Углекислый газ в атмосфере
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) дает малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).
Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО 2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемых топлив (угля, нефти, газа), заметно увеличивающееся в зимний сезон[2] .
6. Устойчивость организмов к углекислому газу
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[3]
Примечания
Данный реферат составлен на основе .
