Вода (оксид водорода) — бинарное неорганическое соединение, химическая формула Н2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью.
Вода, не является питательным веществом, но она жизненно необходима, как стабилизатор температуры тела, переносчик питательных веществ и пищеварительных отходов, реагент и реакционная среда в ряде химических превращений. Кроме того, вода формирует органолептические показатели продукта.
Общий запас воды на Земле составляет 1359000 м 3 . Около 70% поверхности планеты покрыто морями и океанами, но эта вода — соленая. На долю пресной воды приходится 2,8%, причем 2,2% из них недоступно людям, так как это ледники северного Ледовитого океана, Гренландии, Антарктиды.
На Земле происходит непрерывный круговорот воды, включающий использование воды на бытовые и производственные нужды человека, использование воды растениями и животными, испарение воды и фильтрацию ее через почву многое другое. Характер процессов, протекающих с участием воды, во многом определяется ее свойствами как индивидуального вещества.
Вода — самое удивительное соединение на Земле.

1. Строение молекулы воды
Вода (оксид водорода) Н2О — простейшее устойчивое соединение. Молекула воды (H2O) состоит из двух атомов водорода (H1) и одного атома кислорода (O16).
Молекулярная масса воды 18,0160, на водород приходится 11,19% по массе, а на кислород — 88,81%.
Три ядра в молекуле воды образуют равнобедренный треугольник с двумя протонами водорода в основании и кислородом в вершине.
Модель молекулы воды, предложенная Нильсом Бором:
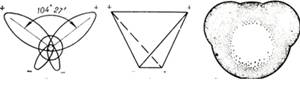
Свойства воды в основном зависят от величины водородных связей.
Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода.
По этой причине, а также из-за того, что ион водорода не имеет внутренних электронных слоев и обладает малыми размерами, он может проникать в электронную оболочку отрицательно поляризованного атома соседней молекулы.
Благодаря чему, каждый атом кислорода притягивается к атомам водорода других молекул и наоборот.
Реферат кислород озон воздух
... Озон возникает, когда ультрафиолетовые лучи расщепляют молекулы кислорода. Отдельный атом кислорода(3)присоединяется к молекуле кислорода (4), в результате чего получается озон ... воздух, содержащий пар перекиси водорода и озона, над хромовым ангидридом, то протекший воздух делается свободным от перекиси водорода, а озон ... очень сильно взрывается. Озон значительно более кислорода растворим в воде, в 15 ...
Каждая молекула воды может участвовать максимум в четырёх водородных связях: два атома водорода — каждый в одной, а атом кислорода — в двух; в таком состоянии молекулы находятся в кристалле льда.
При таянии льда часть связей рвётся, что позволяет уложить молекулы воды плотнее; при нагревании воды связи продолжают рваться, и плотность её растёт, но при температуре выше 4°С этот эффект становится слабее, чем тепловое расширение.
В молекуле воды имеются две полярные ковалентные связи Н-О.
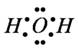
Они образованы за счёт перекрывания двух одноэлектронных р — облаков атома кислорода и одноэлектронных S — облаков двух атомов водорода.
В молекуле воды атом кислорода имеет четыре электронных пары. Две из них участвуют в образовании ковалентных связей, т.е. являются связывающими. Две другие электронные пары являются не связывающими.
В молекуле имеются четыре полюс зарядов: два — положительные и два — отрицательные. Положительные заряды сосредоточены у атомов водорода, так как кислород электроотрицательнее водорода. Два отрицательных полюса приходятся на две не связывающие электронные пары кислорода.
Подобное представление о строении молекулы позволяет объяснить многие свойства воды, в частности структуру льда. В кристаллической решётке льда каждая из молекул окружена четырьмя другими. В плоскостном изображении это можно представить так:
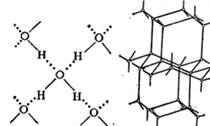
На схеме видно, что связь между молекулами осуществляется посредством атома водорода: положительно заряженный атом водорода одной молекулы воды притягивается к отрицательно заряженному атому кислорода другой молекулы воды. Такая связь получила название водородной (её обозначают точками).
По прочности водородная связь примерно в 15-20 раз слабее ковалентной связи. Поэтому водородная связь легко разрывается, что наблюдается, например, при испарении воды.
Структура жидкой воды напоминает структуру льда. В жидкой воде молекулы также связаны друг с другом посредством водородных связей, однако, структура воды менее «жёсткая», чем у льда. Вследствие теплового движения молекул в воде одни водородные связи разрываются, другие образуются.
Физические свойства H2O
Вода, H2O, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая); плотность 1 г/см 3 (при 3,98 градусах), tпл=0 градусов, tкип=100 градусов.
Вода — это единственное вещество в природе, которое в земных условиях существует во всех трёх агрегатных состояниях:
жидком — вода
твёрдом — лёд
газообразном — пар
Советский учёный В.И. Вернадский писал: «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могли бы сравниться с ней по влиянию на ход основных, самых грандиозных геологических процессов. Нет земного вещества — минерала горной породы, живого тела, которое её бы не заключало. Всё земное вещество ею проникнуто и охвачено».
T плавления льда. Плавление тел
... удельную теплоту плавления на опыте. Так, было установлено, что удельная теплота плавления льда равна 3,4 10 5 - . Это означает, что для превращения куска льда массой 1 кг, взятого при 0 °С, в воду ... могут удерживать медленно движущиеся молекулы друг около друга. ... тем, мы знаем, что внутренняя энергия тела может характеризоваться таким понятием, как температура. Как нам уже известно, при плавлении ...

Химические свойства H2O
1) Вода реагирует со многими металлами с выделением водорода:
2Na + 2H2O = H2 + 2NaOH (бурно)
K + 2H2O = H2 + 2KOH (бурно)
3Fe + 4H2O = 4H2 + Fe3O4 (только при нагревании)
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
2) Вода реагирует с неметаллами, например, углерод и его водородное соединение (метан).
Эти вещества гораздо менее активны, чем металлы, но всё же способны реагировать с водой при высокой температуре:
+ H2O = H2 + CO (при сильном нагревании)+ 2H2O = 4H2 + CO2 (при сильном нагревании)
3) Вода реагирует со многими оксидами неметаллов:
+ H2O = H2SO3
Вода реагирует с оксидами металлов:
+ H2O = Ca(OH)2 гидроксид кальция (гашеная известь)
Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
+ 5H2O = CuSO4∙5H2O вещество белого цвета кристаллогидрат (медный купорос) (безводный сульфат меди) синие кристаллыSO4 + H2O = H2SO4.H2O (гидрат серной кислоты)+ H2O = NaOH.H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха.
Особая реакция воды — синтез растениями крахмала (С6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
n CO2 + 5n H2O = (C6H10O5)n + 6n O2 (при действии света)
4. Виды воды
Бромная вода — насыщенный раствор Br2 в воде (3,5% по массе Br2).
Бромовая вода — окислитель, бромирующий агент в аналитической химии.
Аммиачная вода — образуется при контакте сырого коксового газа с водой, который концентрируется вследствие охлаждения газа или специально впрыскивается в него для вымывания NH3. В обоих случаях получают так называемую слабую, или скрубберную, аммиачную воду. Дистилляцией этой аммиачной воды с водяным паром и последующей дефлегмацией и конденсацией получают концентрированную аммиачную воду (18-20% NH3 по массе), которую используют в производстве соды, как жидкое удобрение и др.
Подсмольная вода — образуется при полукоксовании и газификации твёрдых, горючих ископаемых. Наиболее характерные компоненты: NH3, фенолы, карбоновые кислоты. Одни из наиболее вредных видов сточных вод. Обезвреживание заключается в выделении из подсмольных вод указанных компонентов и последующей биохимической очистке.
Дистиллированная вода — очищенная вода, практически не содержащая примесей и посторонних включений.

Почему не кончается вода на Земле?
Вода на Земле находится в постоянном круговороте, и убыль её в одном звене сразу же восполняется за счёт поступления из другого. Движущей силой круговорота воды является солнечная энергия и сила тяжести. За счёт круговорота воды все части гидросферы тесно объединены и связывают между собой другие компоненты природы. В самом общем виде круговорот воды на нашей планете выглядит следующим образом. Под действием солнечных лучей вода испаряется с поверхности океана и суши и поступает в атмосферу, причём испарение с поверхности суши осуществляется, как реками и водоёмами, так почвой, растениями. Часть воды сразу возвращается с дождями обратно в океан, а часть переносится ветрами на сушу, где выпадают в виде дождей и снега. Попадая в почву, вода частично впитывается в неё, пополняя запасы почвенной влаги и подземных вод, частично стекает по поверхности в реки и водоёмы почвенная влага частично переходит в растения, которые испаряют её в атмосферу, и частично стекает в реки, только с меньшей скоростью. Реки, питающиеся водой из поверхностных ручьёв и подземных вод, несут воду в Мировой океан, восполняя её убыль. Вода испаряется с его поверхности, снова оказывается в атмосфере, и круговорот замыкается. Такое же движение воды между всеми компонентами природы и всеми участками земной поверхности происходит постоянно и беспрерывно в течение многих миллионов лет.
Экология» : «Сточные воды и их очистка
... сточных вод отводятся по одной общей сети труб и каналов за пределы городской территории на очистные сооружения. Раздельные ... к их качеству; к этой категории вод относят воды, откачиваемые на поверхность земли при добыче полезных ископаемых); атмосферные (дождевые ... имеют вековые запасы воды в озерах, а также подземные воды. Использовать другие запасы пресной воды, например законсервированной в ледниках ...
Надо сказать, что круговорот воды не полностью замкнут. Часть её, попадая в верхние слои атмосферы, разлагается под действием солнечных лучей и уходит в космос. Но эти незначительные потери постоянно восполняются за счёт поступления воды из глубинных слоёв земли при вулканических извержениях. За счёт этого объём гидросферы постепенно увеличивается. По некоторым расчётам 4 млрд. лет назад объём её составлял 20 млн. км 3 , т.е. был в семь тысяч раз меньше современного. В будущем количество воды на Земле, по-видимому, так же будет возрастать, если учесть, что объём воды в мантии Земли оценивается в 20 млрд. км3 — это в 15 раз больше современного объёма гидросферы. Сравнивая объём воды в отдельных частях гидросферы с притоком воды в них и соседних звеньев круговорота, можно определить активность водообмена, т.е. время, за которое может полностью обновиться объём воды в Мировом океане, в атмосфере или почве. Медленнее всего обновляются воды в полярных ледниках (один раз за 8 тыс. лет).
А быстрее всего обновляется речная вода, которая во всех реках на Земле полностью меняется за 11 дней.

Вода в природе
Вода весьма распространенное на Земле вещество. Почти 3/4 поверхности земного шара покрыты водой, образующей океаны, моря, реки и озера. Много воды находится в газообразном состоянии в виде паров в атмосфере; в виде огромных масс снега и льда лежит она круглый год на вершинах высоких гор и в полярных странах. В недрах земли также находится вода, пропитывающая почву и горные породы. Природная вода не бывает совершенно чистой. Наиболее чистой является дождевая вода, но и она содержит незначительные количества различных примесей, которые захватывает из воздуха. Количество примесей в пресных водах обычно лежит в пределах от 0,01 до 0,1% (масс.).
«Состав водопроводной воды и её влияние на здоровье человека»
... чаще всего используют в качестве питьевой водопроводную воду*. Водопроводную кипяченую воду пьют 35% опрошенных; обычную воду из-под крана - 32%; водопроводную воду, очищенную бытовым фильтром -15%. Немногим более ... организма к усвоению жизненно важных веществ, содержащихся в пище. 11. Вода обеспечивает транспортировку всех веществ в пределах организма. 12. Вода усиливает способность эритроцитов к ...
Морская вода содержит 3,5% (масс.) растворенных веществ, главную массу которых составляет хлорид натрия (поваренная соль).
Вода, содержащая значительное количество солей кальция и магния, называется жесткой в отличие от мягкой воды, например дождевой. Жесткая вода дает мало пены с мылом, а на стенках котлов образует накипь. Чтобы освободить природную воду от взвешенных в ней частиц, ее фильтруют сквозь слой пористого вещества, например, угля, обожженной глины и т.п.
При фильтровании больших количеств воды пользуются фильтрами из песка и гравия. Фильтры задерживают также большую часть бактерий. Кроме того, для обеззараживания питьевой воды ее хлорируют; для полной стерилизации воды требуется не более 0,7 г хлора на 1 т воды. Фильтрованием можно удалить из воды только нерастворимые примеси. Растворенные вещества удаляют из нее путем перегонки (дистилляции) или ионного обмена. Вода имеет очень большое значение в жизни растений, животных и человека.
Согласно современным представлениям, само происхождение жизни связывается с морем. Во всяком организме вода представляет собой среду, в которой протекают химические процессы, обеспечивающие жизнедеятельность организма; кроме того, она сама принимает участие в целом ряде биохимических реакций.

Аномалии воды
Химически чистая вода обладает рядом свойств, резко отличающих ее от других природных тел и химических аналогов (гидридов элементов 6 группы периодической системы Менделеева) и от других жидкостей. Эти особые свойства известны под названием аномалии воды.
Исследуя воду и, особенно ее водные растворы, ученые раз за разом убеждались, что вода обладает ненормальными — аномальными свойствами, присущими только ей, ее Величеству — Воде, подарившей нам Жизнь и возможность мыслить. Мы даже и не подозреваем, что столь привычные и естественные свойства воды в природе, в различных технологиях, наконец, в обыденной жизни нашей являются уникальными и неповторимыми.
Плотность
Для всей биосферы исключительна важной особенностью воды является ее способность при замерзании увеличивать, а не уменьшать свой объем, т.е. уменьшать плотность. Действительно, при переходе любой жидкости в твердое состояние молекулы располагаются теснее, а само вещество, уменьшаясь в объеме, становится плотнее. Да, для любой из необозримо разных жидкостей, но не воды. Вода здесь представляет исключение. При охлаждении вода сначала ведет себя как и другие жидкости: постепенно уплотняясь, уменьшает свой объем. Такое явление можно наблюдать до +3,98°С. Затем, при дальнейшем снижении температуры до 0°С, вся вода замерзает и расширяется в объеме. В результате удельный вес льда становится меньше воды и лед плавает. Если бы лед не всплывал, а тонул, то все водоемы (реки, озера, моря) промерзли бы до дна, испарение бы резко сократилось, все пресноводные животные и растения погибли бы. Жизнь на Земле стала бы невозможной. Вода — единственная жидкость на Земле, лед которой не тонет за счет того, что его объем на 1/11 больше объема воды.
Воздействие нефти на гидросферу земли (2)
... нефтепродукты являются одним из важнейших энергоносителей для Человечества, и тенденция продлится, как минимум, на ближайшие 20 лет, проблема попадание нефти в гидросферу Земли остается достаточно актуальной. Загрязнение ... смесью химических веществ, содержащей сотни ... влияние загрязнения на жизнь моря. ... континентальных и океанических вод ...
Поверхностное натяжение
Благодаря тому, что круглые шарики воды очень упруги, идет дождь, выпадает роса. Что же это за удивительная сила, которая сохраняет капли росы, а поверхностный слой воды в любой лужице делает эластичным и относительно прочным?
Известно, что если стальную иголку осторожно положить на поверхность воды, налитой в блюдце, то иголка не тонет. А ведь удельная масса металла значительно больше, чем у воды. Молекулы воды связаны силой поверхностного натяжения, которая позволяет им подниматься вверх по капиллярам, преодолевая силу земного притяжения. Без этого свойства воды жизнь на Земле была бы также невозможна.
Теплоемкость
Ни одно вещество в мире не поглощает и не отдает среде столько тепла, сколько вода. Теплоемкость воды в 10 раз больше теплоемкости стали и в 30 раз больше ртути. Вода сохраняет тепло на Земле.
С поверхности морей, океанов, суши испаряется за год 520000 кубических километров воды, которые, конденсируясь, отдают много тепла холодным и полярным регионам.
Вода в организме человека составляет 70-90%. от веса тела. Не обладай вода такой теплоемкостью, как сейчас, обмен веществ в теплокровных и холоднокровных организмах был бы невозможен.
Легче всего вода нагревается и быстрее всего охлаждается в своеобразной «температурной яме», соответствующей +37°С, температуре человеческого тела.
Есть ещё несколько аномальных свойств воды:
Ни одна жидкость не поглощает газы с такой жадностью, как вода. Но она их также легко отдает. Дождь растворяет в себе все ядовитые газы атмосферы. Вода — ее мощный природный фильтр, очищающий атмосферу от всех вредных и ядовитых газов. Еще одно удивительное свойство воды проявляется при воздействии на нее магнитного поля. Вода, подвергнутая магнитной обработке, меняет растворимость солей и скорость химических реакций.
Но самое удивительное свойство воды — это свойство практически универсального растворителя. И если какие-то вещества в ней не растворяются, то и это для жизни сыграло громадную роль в эволюции: скорее всего именно гидрофобным свойствам первичных биологических мембран и обязана жизнь своим появлением и развитием в водной среде.
8. Применение воды
Роль воды в нынешней науке и технике очень велика. Вот только часть областей применения воды.
- В сельском хозяйстве для полива растений и питания животных
- В химической промышленности для получения кислот, оснований, органических веществ.
- В технике для охлаждения, в паровых двигателях.
- В металлургии для выплавки металлов.
- В медицине для приготовления лекарств.
В термоядерных реакторах для задержки нейтронов применяется тяжелая или сверхтяжелая вода (D2O, T2O соответственно; D — дейтерий, Т — тритий; это изотопы водорода).
Бурное развитие всех отраслей промышленности может повлечь за собой недостаток пресной воды. Чтобы изготовить 1 кг бумаги, требуется 100 л воды; чтобы вырастить корову требуется 100 л в сутки. Расход воды на одного городского жителя — около 40 литров в сутки. Экономисты посчитали, что все фабрики и заводы России » выпивают » за минуту целую реку Волгу. И это неудивительно. На производство одной тонны металла идет 500 тонн воды, на производство одной тонны капрона в 7-8 раз больше.
Загрязнение атмосферного воздуха вредными веществами
... интенсивное загрязнение воздуха, как и прежде, отмечается в крупных районах, где циркуляция воздуха задерживается и невелика. В атмосферу ежегодно выбрасываются сотни миллионов тонн различных веществ. Вот сколько ... "парниковый эффект". Подъем температуры у поверхности Земли вызывает таяние ледников, льдов полярных морей и океанов. Это вызовет подъем воды на десятки метров с затоплением миллионов ...
Чтобы избежать » водяного голода «, ученые предлагают опреснять воды Мирового океана. И сейчас по всей Земле строят дистилляционные установки для получения пресной воды. Есть и другие способы опреснения воды: замораживание; воздействие электротока; полупроницаемые мембраны, поры которых пропускают лишь мелкие молекулы воды, а молекулы солей задерживают и т.д.
вода оксид жидкость аномальный
Заключение
Вода — универсальный растворитель.
Вода является незаменимым веществом для всего живого на земле.
Вода — самое удивительное соединение на Земле.
Вода — одно из самых распространенных веществ на нашей планете.
Считают, что вода самое простое вещество на Земле. Она имеет огромное значение в эволюции как живой, так и неживой природы.
Покрывает 70% поверхности Земли и является средой обитания большого количества представителей флоры и фауны. Человеческое тело содержит около 65% воды.
На Земле происходит непрерывный круговорот воды, включающий использование воды на бытовые и производственные нужды человека, использование воды растениями и животными, испарение воды и фильтрацию ее через почву многое другое.
Характер процессов, протекающих с участием воды, во многом определяется ее свойствами как индивидуального вещества.
Химически чистая вода обладает рядом свойств, резко отличающих ее от других природных тел и химических аналогов (гидридов элементов 6 группы периодической системы Менделеева) и от других жидкостей. Эти особые свойства известны под названием аномалии воды.
Список литературы
[Электронный ресурс]//URL: https://drprom.ru/referat/voda-kak-reagent-i-kak-sreda-dlya-himicheskogo-protsessa/
1. Д.Э., Техника и производство. Москва, 1972 г.
— Хомченко Г.П., Химия для поступающих в ВУЗы. Москва, 1995 г.
— Прокофьев М.А., Энциклопедический словарь юного химика. Москва, 1982 г.
— Глинка Н.Л., Общая химия. Ленинград, 1984 г.
— Ахметов Н.С., Неорганическая химия. Москва, 1992 г.
— Петрянов И.В., Самое необыкновенное вещество в мире. Москва, 1975г.
— Алексинский В.Н. Занимательные опыты по химии: Пособие для учителей. — М.: Просвещение, 1980 г.
— Чернова Н.М., Былова А.М., «Экология».
— http://www.habit.ru
— http://food-chem.ru
— http://t-water.ru
—
