Семь металлов принято называть доисторическими. Золото, серебро, медь, железо, олово, свинец и ртуть были известны людям с древнейших времен. Роль меди в становлении человеческой культуры особенна. Каменный век сменился медным, медный — бронзовым. Не везде этот процесс шел одновременно. Коренное население Америки переходило от каменного века к медному в XVI в н.э. всего 400 лет назад! А в Древнем Египте медный век наступил в IV тысячелетии до н.э. Два миллиона 300 тысяч каменных глыб, из которых примерно 5000 лет назад была сложена 147-метровая пирамида Хеопса, добыты и обтесаны медными инструментами.
Подобно серебру и золоту, медь иногда образует самородки. Видимо, из них около 10 тысяч лет назад были изготовлены первые металлические орудия труда. Распространению меди способствовали такие ее свойства, как способность к холодной ковке и относительная простота выплавки из богатых руд.
Медный век длился около тысячи лет — вдвое меньше, чем бронзовый. Характерно. Что в Греции культура меди зародилась позже, чем в Египте, а бронзовый век наступил раньше. Руда, из которой выплавляли медь египтяне, не содержала олова. Грекам в этом отношении повезло больше. Они добывали «оловянный камень» для выплавки бронзы иногда там же, где и медную руду.
Искусство выплавки и обработки меди от греков унаследовали римляне. Они вывозили медь из покоренных стран, в первую очередь из Галлии и Испании, продолжали начатую греками добычу медной руды на Крите и Кипре. Кстати, с названием последнего острова связывают латинское название меди — «купрум».
Медь сыграла выдающуюся роль не только в становлении материальной культуры большинства народов, но и в изобразительном искусстве. В этом качестве медь прошла через века; и в наши дни делают барельефы и гравюры из меди.
Медь в природе
По распространению в земной коре (4,7 . 10-3 % по массе) медь следует за никелем и занимает всего лишь 26-е место среди других элементов. Медь встречается в природе в виде самородков, порой значительных размеров. Так, в 1957 году в США в районе Великих озер был найден самородок массой 420 тонн. Интересно. Что выступающие части его были отбиты еще каменными топорами. Однако, самородная медь в наше время составляет незначительную часть от общего производства металла.
Подавляющая часть меди присутствует в горных породах в виде соединений. Из сотен минералов меди промышленное значение имеют немногие, в частности, халькоперит -медный колчедан CuFeS 2 , халькозин — медный блеск — Cu 2 S , ковелин — CuS , малахит — С uCO 3 . С u ( OH )2 , азурит —
География медной промышленности стран мира
... 1. Характеристика ресурсной базы для медной промышленности мира. Территориальное распределение запасов меди. Медная промышленность в своем размещении в основном ориентируется на ресурсы меди (природное и вторичное сырье). ... Австралия, Папуа — Новая Гвинея). Главные медедобывающие страны выделяются и по выплавке меди, ведущее место принадлежит США, Чили, Японии, КНР, Канаде, России. Часть добываемой ...
2 С uCO3 . С u(OH)2 .
Физические и химические свойства.
Медь — металл красного, в изломе розоватого цвета, в тонких слоях при просвечивании приобретает зеленовато-голубой оттенок. Плотность меди -8,96 г/см 3 , температура плавления -1083 0 С, температура кипения — 2600 0 С. Это довольно мягкий, ковкий металл, из него можно прокатывать листы толщиной всего лишь в 2,5 микрона (в 5 раз тоньше папиросной бумаги).
Медь хорошо отражает свет, прекрасно проводит электричество и тепло.
Медь, серебро, золото составляют побочную подгруппу первой группы периодической системы Д.И. Менделеева. С щелочными металлами их сближает лишь способность образовывать одновалентные катионы. Для меди и ее аналогов характерно то, что они могут давать соединения с валентностью, превышающей номер своей группы. Кроме того, элементы подгруппы меди, в отличие от щелочных металлов, склонны к комплексообразованию, образуют окрашенные соли, т.е. проявляют свойства, сближающие их с никелем, палладием, платиной.
Такое поведение меди, серебра, золота объясняется конфигурацией внешних электронных оболочек их атомов. У атома меди самая наружная (4-я от ядра) оболочка содержит один s -электрон, ему предшествуют десять d -электронов (3-й от ядра) оболочки. Атомы меди и ее сплавов могут при образовании соединений терять не только самый внешний s -электрон, но один или два электрона предвнешнего d -уровня, проявляя более высокую степень окисления. Для меди окислительное число +2 (валентность II) , более характерно, чем +1 (валентность I).
Существует также немногочисленное число соединений меди (III).
Медь химически малоактивна и в чистом, сухом воздухе не изменяется. Однако атмосфера, в которой мы живем содержит водяные пары и двуокись углерода. Поэтому не удивительно, что, например, произведения скульптуры, изготовленные из меди и бронзы, со временем покрываются зеленоватым налетом — «патиной». В обычной атмосфере патина состоит из основного карбоната меди (малахита), в атмосфере, содержащей двуокись серы ( SO 2 ), медные изделия покрываются основным сульфатом CuSO 4 . 3 Cu ( OH )2 , а вблизи моря — основным хлоридом CuC 12 . 3 Cu ( OH )2 . Интересно, что патина образуется только во влажном воздухе (при влажности выше 75%).
Патина придает изделиям из меди и бронзы красивый, как говорится, «старинный» вид. А сплошной налет патины обладает еще и защитными свойствами, предохраняя от дальнейшего разрушения. Но образовавшаяся пленка может быть с дефектами и поэтому недостаточно надежной. Гораздо прочнее такое же покрытие, нанесенное на металл искусственно.
Один из способов искусственного получения патины таков: изделие из меди или бронзы обрабатывают серной кислотой и затем выставляют на воздух. Через некоторое время операцию повторяют. Образующийся сульфат меди гидролизуется и постепенно превращается в устойчивую пленку CuSO 4 . 3 Cu ( OH )2 .
Если быстро погрузить в холодную воду раскаленный докрасна кусок меди. То на его поверхности образуется ярко-красная пленка оксида меди (I).
При умеренном же нагревании меди на воздухе поверхность ее покрывается черной окисью CuO . Обычно образцы меди содержат сотые доли С u 2 O . При нагревании такого металла в атмосфере, содержащей водород и некоторые другие газы (СО , СН4 ) происходит восстановление Cu 2 O :
Cu 2 O + H2 = 2Cu + H2 O
Cu 2 O + CO = 2Cu + CO2
Образовавшиеся пары воды и двуокись углерода выделяются из металла, вызывая появление трещин. А это резко ухудшает механические свойства меди. («водородная болезнь»).
Гидроксид меди (II) выпадает в виде объемистого голубого осадка при действии щелочей на растворы солей двухвалентной меди. Это слабое основание, образующее с кислотами соли. Впрочем, свежеприготовленный Cu ( OH )2 растворяется и в концентрированных растворах щелочей, но его кислотный характер выражен слабо.
Фтор, хлор, бром реагируют с медью, образуя соответствующие галогениды двухвалентной меди, например:
Cu + C1 2 = CuC12
При взаимодействии иода с нагретым порошком меди получается иодид одновалентной меди:
2Cu + J 2 = 2
Медь горит в парах серы:
Cu + S = CuS
К сере медь проявляет большее сродство, чем к кислороду. На этом свойстве основан пиролитический способ получения меди.
В ряду напряжений металлов медь стоит после водорода. В бескислородных кислотах она не растворяется, но легко окисляется азотной кислотой:
3Cu + 8HNO 3 (
и концентрированной серной кислотой:
Cu + 2H 2 SO4 (
В целом химические свойства меди наглядно иллюстрирует схема 1.
Получение и очистка меди.
Почти все мировые производства металлической меди в настоящее время основываются на переработке сульфидных, оксидных и карбонатных руд. Медные руды, как правило, содержат большое количество пустой породы, так что непосредственное получение из них меди экономически невыгодно. Поэтому руды сначала измельчают, размалывают и обогащают с помощью гравитационных и флотационных методов.
В зависимости от характера руды и содержания в ней меди, для извлечения ее концентраты руд обрабатываются пирометаллургическими и гидрометаллургическими методами.
| Схема 1. [ ] | |
| — во влажном воздухе ® Сu 2 O | |
| — во влажном воздухе в присутствии СО 2 , Н2 S, SO2 ® основные карбонаты и сульфат меди | |
 |
— с NH 4 OH ® [Cu(NH3 )4 ](OH)2 |
| — c KCN + O 2 + H2 O ® K[Cu(CN)2 ] илиК3 [Cu(CN)4 ] | |
| — c HNO 3 ® Cu(NO3 )2 . n H2 O | |
| |
|
| — на воздухе ®Cu 2 O и СuO | |
| — c F 2 , C12 , Br2 , J2 ® CuF2 , CuC12 , CuBr2 , CuJ2 | |
| — c S, Se, Te ® CuS, CuSe, CuTe | |
| — с Н 2 S®CuS | |
| |
— P, As, Sb, C, Si ® Cu 3 P, Cu3 P2 , Cu3 As2 , Cu3 As, Cu5 As2 , Cu2 Sb, Cu3 Sb, карбид и силициды |
| — с концентрированной НС1 на воздухе СuС1 2 | |
| — с концентрированно Н 2 SO4 ®CuSO4 . H2 O | |
| — c NH 3 ® Cu3 N | |
| — c NO 2 или NO ® Cu2 O |
Пирометаллургический метод
Гидрометаллургический метод
афинажа
пирометаллургическим
Медь, рафинированная пирометаллургически содержит примеси Cu 2 O , Bi , Sn , иногда Ag , Au , Pt и платиновые металлы. Из такой меди отливают аноды, для дальнейшего получения электролитической меди.
Электролизерами для электролитической очистки меди служат бетонные чаны со стенами, обложенными свинцовыми пластинами. В них наливают электролит — раствор сульфата меди с серной кислотой и добавкой сульфата натрия. В электролизер помещают аноды из пирометаллургически полученной меди и катоды из чистой меди. При пропускании тока на катоде осаждается чистая медь, а аноды растворяются в процессе окисления. Неметаллические примеси и металлы, менее активные, чем медь ( Ag , Au , Pt , платиновые металлы), находящиеся на анодах выпадают в виде шлама на дно электролизера. При электролизе водного раствора сульфата меди на катоде осаждается чистая медь, а на аноде выделяется кислород.
CuSO 4
H 2 O
На катоде : Cu 2+ + 2 e ® Cu 0
На аноде : 2 O Н— — 2 e ® 1/2 O 2 + H 2 O
Коррозионное и электрохимическое
поведение меди.
В атмосферных условиях в отличие от многих других металлов, медь не подвергается коррозии, так как на ее поверхности образуется тонкий ровный слой (пленка) продуктов коррозии, не содержащая никаких агрессивных соединений, способных при каких-либо условиях разрушать металл. Коррозия меди в атмосферных условиях — процесс самопроизвольно затухающий, так как продукты коррозии защищают поверхность металла от внешней среды.
В воде и нейтральных растворах солей медь обладает достаточной устойчивостью, которая заметно снижается при доступе кислорода и окислителей. В морской воде, аэрируемой при малой скорости движения, медь характеризуется небольшим равномерным растворением (порядка 0,05 мм/год).
При высоких скоростях течения жидкости, а также ударах струи скорость коррозии меди сильно повышается [ [3] ].
Имеются данные о влиянии pH среды на депассивацию меди [ ] в хлоридсодержащих боратных буферных растворах. Установлено, что всем исследованном интервале рН при анодной поляризации медь переходит в пассивное состояние. При увеличении рН боратного буфера стационарный потенциал, потенциал пассивации и плотность тока пассивации уменьшается, т.к. изменяется структура, толщина и состав оксидной пленки на меди. В среде, близкой к нейтральной пассивирующая пленка состоит из оксидов Cu (I) и Cu (II), а в щелочной среде — в основном из оксида меди (I) и очень тонкой пленки оксида меди (II).
В последнем случае толщина пленки меньше, а пористость больше. При увеличении рН в хлоридсодержащих боратных буферах потенциал питтиногообразования снижается (разблагораживается), что связано как с изменением происходящими в оксидной пленке, так и с тем, что начальные стадии депассивации меди протекают через образование смешанных гидроксокомплексов. При постоянном значении рН потенциал питтингообразования не зависит от концентрации NaC 1 . Предложена схема механизма начальных стадий инициирования питтингообразования меди в хлоридсодержащих боратных растворах, согласно которой лимитирующей стадией является диссоциация гидроксида Cu (ОН)2 , а нуклеофильное замещение пассивирующего лиганда в поверхностном комплексе анионом-активатором протекает по диссоциативному механизму.
В [ ] приведены данные по коррозионному поведению меди М1 в 3% растворе хлорида натрия в сравнении с естественной морской водой, совокупность которых позволила авторам сделать вывод, что основным анодным процессом при коррозии меди в 3 % растворе NaC1 и морской воде является ее окисление в закись с последующим химическим растворением последней. Контролирующей стадией является отвод ионных форм меди (Сu+ , CuCl2 — , CuCl3 2 — ) в электролит.
В хлоридных растворах с рН =0,5, содержащих ионы двухвалентной меди, по данным [ ] при катодной поляризации наблюдается компонента скорости растворения, независимая от потенциала за счет процесса репропорционирования:
Cu + Cu 2+
Медь весьма склонна к комплексообразованию. Например, в нейтральных хлоридных средах эффективный заряд переходящих в раствор ионов ( m эфф ) меди равен 1±0,01 [ ]. Предложен следующий стадийный механизм растворения меди c двумя возможными маршрутами ионизации :
а) Сu + nCl —
б ) Cu ® Cu+ + e (12)
_________________________
Cu + + nCl—
Широкое применение в различных отраслях химической промышленности нашло химическое и электрохимическое травление меди. В медно-аммиачных травильных растворах, содержащих NH 3 и NH 4 C 1 [ ], установлена следующая последовательность формирования пассивирующих слоев с ростом потенциала: С uC 12 , Cu 2 O , CuO (при определенных условиях), CuC 12 . 3 Cu ( OH )2 и CuC 12 . 2 NH 4 C 1. H 2 O , либо их смесь. Различными электрохимическими и рентгенографическими методами было показано, что интенсивное вращение электрода удаляет лишь рыхлую часть продуктов реакции, оставляя пассивный слой. В любых условиях растворение идет через пассивную пленку.
Изучение травления в растворах FeC 12 показало, что химическое растворение меди протекает наряду с электрохимическим, основными продуктами которых являются CuC 1 и С u 2 О . Общая скорость ионизации металла определяется пассивированием поверхности меди малорастворимыми продуктами. Пассивирование для железо-хлоридных растворов тем глубже, чем позже оно наступает. Причиной является уплотнение слоя С u С1 в результате уменьшения количества дефектов в структуре, а также тот факт, что по сравнению с CuC 12 в железо-хлоридных растворах той же концентрации количество свободных С1 — ионов, не входящих в комплексы, больше, и, следовательно, лучше условия для пассивирования. Установлено, что образующийся при травлении меди пассивирующий слой Cu С1 обладает полупроводниковыми свойствами и оказывает существенное влияние на протекание анодного растворения металла. При малых концентрациях FeC 13 главную роль играет толщина поверхностного слоя, а при высоких концентрацияхFeC 13 — диффузия ионов Fe 3+ в твердую фазу.
Уменьшение экранирования поверхности электрода происходит при интенсивном перемешивании, снижение концентрации Fe 3+ — ионов и повышение концентрации С1 — -ионов, которые, по-видимому, облегчают растворение осадка CuC 1тв , переводя в комплексные соединения типа CuC 1 , CuC 1 ![]() , Cu 2 C 1
, Cu 2 C 1 ![]() .
.
В средах на основе CuC 12 и FeC 13 растворение происходит по реакциям:
Cu + CuC1 2
Cu + FeC1 3
протекающим по электрохимическому механизму, т.е., например, как совокупность реакций:
С u + C1— ® CuC1 + e (15)
CuC1 2 +
Первично образующаяся пленка С u С1 , наблюдаемая визуально на поверхности меди, при ее травлении растворяется с образованием комплексных ионов CuC 1 , CuC 1 ![]() , которые в свою очередь могут окисляться кислородом воздуха до меди ( II ).
, которые в свою очередь могут окисляться кислородом воздуха до меди ( II ).
Электрохимическое поведение меди комплексов С u (I) в расплаве эквимолярной смеси NaF — KC 1 [ ]. Установлено, что процесс разряда комплексов С u (I) до металла протекает обратимо. Определены коэффициенты диффузии С u (I) и условные стандартные потенциалы j С u + / Cu и j С u 2+ / Cu +. Показано, что при наличии большого избытка анионов фтора к меди (I) в расплаве происходит стабилизация двухвалентного состояния меди, а разряд комплексов Cu (II) протекает в одну двухэлектронную реакцию. В отсутствие же большого избытка F — образующиеся хлоридно-фторидные комплексы восстанавливаются через две одноэлектронные стадии.
При изучении электролиза растворов трехводного нитрата меди С u ( NO 3 )2 . 3 H 2 O в диметилсульфоксиде (ДМСО ) с медными анодами [ ] было обращено внимание на чрезвычайно высокий анодный выход по току в расчете на ионы меди (II).
Влияние плотности тока (Х1 ) и температуры (Х2 ) на анодный выход по току (ВТА ) изучали методом планирования эксперимента (Бокса-Уильсона).
Концентрацию соли в растворе 0,1М сохраняли постоянной. В качестве основного уровня были приняты плотность тока 6 мА/см2 и температура 55 0 С.
На основании проведенных экспериментов получено параметрическое уравнение (17).
Отметим прежде всего высокое значение первого коэффициента уравнения регрессии:
ВТА = 188,58 — 0,32Х 1 + 0,80Х2 — 0,33Х1 Х2
Судя по значениям других коэффициентов, большее влияние на исследуемый процесс оказывает температура. Величина выхода по току, рассчитываемая по (17), будет иметь разумные значения, если анодное окисление меди в диметилсульфоксидном растворе описывать уравнением
С u — e ® Cu+ (18)
Возможно, этому благоприятствует способность молекул ДМСО адсорбироваться преимущественно в области положительных зарядов поверхности металла и прочно сольватировать ионы меди (I), взаимодействуя с молекулами воды, вносимой в электролит в составе соли, по реакции:
Cu + + H2 O
2Cu + + H2 O
в результате чего образуются в растворе ярко окрашенные взвеси гидроксида желтого цвета и оксида красного цвета, хорошо наблюдаемые в анодном пространстве визуально.
Известны публикации по изучению анодного растворения меди в ацетонитриле [ ]. Температурно-кинетическим методом и методом вращающегося дискового электрода установлено, что при содержании в растворе 20 объемных процентов воды процесс анодного растворения меди в ацетонитрильных растворах С u ( NO 3 )2 лимитируется подводом окислителя в зону реакции. С увеличением концентрации воды процесс переходит в область смешанной кинетики и наблюдается уменьшение скорости травления вследствие изменения лимитирующих стадий сопряженных реакций растворения меди. Это связано с тем, что по сравнению с водными растворами, ионы С u + в ацетонитриле обладают более высокой энергией сольватации, что обусловливает их стабилизацию. Увеличение содержания воды приводит к разрушению сольватов Cu + с ацетонитрилом, дестабилизации ионов С u + , в результате чего процесс травления осложняется.
Коррозия меди в метанольном, н -пропанольном и водно-метанольном растворах Н2 SO4 , насыщенных кислородом, исследована в [ [12] ]. Показано, что растворение протекает по каталитическому механизму так же, как и в водном растворе, при котором кислород восстанавливается в химической реакции ионами Cu+ , а медь растворяется за счет сопряженных реакций. Опыты проводились с медью, осажденной на платине, при перемешивании раствора, с концентрацией кислоты (Н2 SO4 ) 0,5 моль/л при t =25 0 C.
i пред
О 2
О 2 + е
за которым следует ассоциация
О 2 — + Н+
Авторами [10] предложен следующий механизм коррозии меди в метанольной сернокислой среде:
С u+ + O2 ® Cu2+ + O2 — (23)
Cu ® Cu+ + e (24)
Cu 2+ + e
и далее:
HO 2 + Cu+
Н O2 — + H+ ® H2 O2 (27)
Н 2 О2 + Сu+
ОН + Сu +
OH — + H+
Подтверждением протекания химической реакции наряду с электрохимическим механизмом является тот факт, что измеренная радиометрически эффективная валентность меди, переходящей в раствор, равна 1.
Достаточно подробно изучено электрохимическое и коррозионное поведение меди в кислых спиртовых хлоридных средах, где комплесообразование меди особенно заметно [13-17]. В метанольных растворах хлороводорода исследована [ ] скорость коррозии определялась на неподвижном и вращающемся дисковом электродах по данным химического анализа коррозионной среды на медь посредством трилонометрического титрования в присутствии мурексида.
НС1
Введение воды приводит к снижению i пред . При содержании 10 мас.% Н2 О за счет сдвига равновесия вправо
СН 3 + + Н2 О
носителями кислотных свойств являются протоны в форме ионов гидроксония. Одновременно повышается перенапряжение водорода и коррозия протекает с кислородной деполяризацией.
По данным кулонометрических измерений медь переходит в раствор с эффективной валентностью ( Z эф ), близкой к 1 независимо от величины ионной силы раствора, скорости вращения диска (w ) и потенциала электрода. Это подтверждается и сопоставлением кинетики анодного процесса по поляризационным кривым и химическому анализу раствора. Введение двухзарядных ионов меди в виде С uC 12 снижает Z эф до 0,6-0,8. Одновременно существенно возрастает ток саморастворения металла и величина предельного тока. Увеличивается равновесный потенциал, разряд ионов водорода становится невозможным, одновременно появляется дополнительная катодная реакция восстановления С u 2+ до ионовCu + (12), т.к. однозарядные ионы в хлоридных метанольных растворах, видимо, значительно стабильнее двухзарядных.
Скорость коррозии меди понижается с увеличением содержания воды. Хлороводород оказывает обратное действие. Величины скорости коррозии в 10-20 раз меньше соответствующих предельных токов катодных поляризационных кривых. Следовательно, растворение определяется кинетическими факторами и не связано с транспортными ограничениями подвода деполяризатора.
Скорость коррозии меди значительно возрастает с увеличением концентрации хлорной меди, с порядком близким к 1. Одновременно предельный ток также растет с порядком 0,9. Однако i корр > i пред , т.е в присутствии С u 2+ скорость коррозии меди больше таковой, рассчитанной при протекании ее на предельном токе. Следовательно, по мнению авторов [13], имеет место параллельная реакция, видимо, неэлектрохимической природы — реакция репропорционорования (10).
Последнее удовлетворительно объясняет и меньшую величину эффективной валентности в присутствии CuC 12 .
В 1М условно безводных растворах НС1 скорость коррозии преимущественно определяется кинетикой катодной реакции, на что указывает резкое возрастание скорости саморастворения при введении дополнительного катодного деполяризатора.
Скорость коррозии меди в этиленгликолевых растворах НС1 [ ] также в значительной мере обусловлена химической реакцией репропорционирования (10).
Ионизация меди протекает до однозарядных ионов, а наличие Cu 2+ в растворе связано с окислением ионов С u + растворенным кислородом.
В работе [14] изучена скорость коррозии меди в этиленгликолевых растворах НС1 как функция концентрации воды (0,4-10 мас.%), хлороводорода (0,1-3,0 моль/л) и хлорной меди (10-2 -10-1 моль/л).
Исследования проведены в кислородной атмосфере при комнатной температуре на неподвижном электроде из меди марки М1. Скорость коррозии после двухчасовых испытаний определялась посредством анализа среды.
Медь корродирует в исследуемых средах с кислородной деполяризацией, что непосредственно следует из характера катодных поляризационных кривых. Величины i пред в условно безводных этиленгликолевых растворах (0,1-1,0 моль/л) составляет 20±10 мкА/см2 и равна 95±5 мкА/см2 для 1М водных сред. Его изменение при введении 2 и 10 мас.% Н2 О находится в пределах ошибки эксперимента.
В 1М водном растворе НС1 скорость коррозии, пересчитанная на электрохимические единицы ( i общ ) в 3 раза больше предельного тока, а , следовательно, химический процесс репропорционирования играет значительную роль. Однако, наличие добавок ионов Cu 2+ сказывается иначе, чем в спирте. По мере введения С u С12 разница между i общ и i пред уменьшается и, а затем они становятся одинаковыми. Это указывает на то, что растворении меди в 1М водном ратворе в присутствии Cu 2+ >10-2 моль/л практически полностью определяется электрохимической коррозией, катодная реакция которой (12) протекает на предельном токе и лимитирует процесс в целом. Причины этого легко понять, если учесть, что введение 5. 10-2 моль/л ионов Cu 2+ повышает величину предельного тока в у.б. этиленгликоле и воде соответственно до 100 и 2500 мкА/см2 . В воде относительный вклад реакции репропорционирования становится пренебрежительно мал.
Скорость коррозии меди увеличивается с ростом концентрации НС1 . Опыты показали, что порядок анодной ионизации по ионам водорода и хлора равен 2. Величина ( ¶ 1 gK / ¶ lgCHC 1 ) Ci составляет 0,15-0,20, что указывает на отсутствие влияния кинетики анодной реакции на скорость коррозии. Наличие ( ¶ lgK / ¶ lgCHC 1 )Ci > 0 при одновременном ( ¶ lgi пред / ¶ lgCHC 1 ) Ci = 0, видимо, связано, с ускоряющим влиянием НС1 на реакцию репропорционирования (10), что может быть обусловлено, в свою очередь, различной закомплексованностью ионов Cu 2+. Снижение скорости коррозии меди по мере введения воды также можно объяснить замедлением процесса (10).
В [ ] отмечается, что скорость анодного растворения меди в присутствии хлорид-ионов зависит от скорости вращения электрода. Однако, если процессу растворения меди в метаноле присущ чисто диффузионный механизм, то в этаноле начинают проявляться одновременно и кинетические затруднения. Тангенс угла наклона прямых lgi 0 — lgCC 1 — составляет 2. Эти результаты показывают, что процесс растворения меди в этаноле ограничен в основном диффузией CuC 12 в глубь самого раствора.
При переходе от этанола к пропанолу следует ожидать усиление доли кинетических затруднений; действительно, поляризационные кривые анодного растворения меди показывают, что процесс контролируется как диффузией, так и кинетикой. Так, например, положение кривых плотность тока — потенциал зависит от числа оборотов электрода. Прямолинейные зависимости были получены в координатах i -1 — w -1/2 , причем отрезки, отсекаемые от оси ординат, представляют собой значения кинетических плотностей токов. Тафелевский наклон анодной поляризационной кривой составляет 60 мВ.
Полученные результаты могут иметь объяснения, аналогичные предложенным для пентан-2,4-диона: в случае быстрой электрохимической реакции образуется сольватированный С uC 1 , который адсорбируется на электродах. Далее он реагирует с хлорид-ионами с образованием хлорокомплекса. Это превращение можно записать как реакцию замещения:
[CuC1(ROH) n ] + C1—
Очевидно, что с увеличением цепи алкильной группы возрастают стерические затруднения протекания этой реакции, так что скорость образования комплекса в ряду метанол ® этанол ® пропанол снижается.
Процесс анодного растворения меди определяется как свойствами анионов фона, так характером растворителя. Оба эти фактора влияют на диффузию ионов меди. Происходит также взаимодействие между молекулами растворителя и анионами.
Кинетика анодной ионизациии меди в системе изо -С3 Н7 ОН–Н2 О–НС1, как функция природы растворителя (0,2-10 мас.% воды), ионной силы раствора (1-3), потенциала электрода, гидродинамических условий в приэлектродном слое и характера атмосферы изучена в [ ]. Показано, что предварительное насыщение рабочего раствора кислородом не оказывает влияния на ход анодных поляризационных кривых. С учетом межфазного потенциала определены порядки реакции анодной ионизации меди по ионам водорода и хлора. Тафелевский наклон анодных кривых во всех случаях близок к 60 мВ. В растворе с содержанием Н2 О 0,2% n H + =1 или 2, а n С1 — близок к единице (ионная сила 1 и 2) и двум (ионная сила 3).
В смешанном водно-спиртовом растворителе во всех случаях n H + =0 , n С1 — =2.
На основе полученных кинетических параметров предложен механизм анодного растворения меди в исследуемых условиях можно представить в виде следующего двухстадийного процесса с последней лимитирующей стадией:
Сu + mH + C1–
Сu + mC1 –
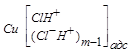 ® CuC1
® CuC1![]() + m H+ (34а )
+ m H+ (34а )
адс
Порядок реакции по ионам водорода равен n, где0<n <m и m принимает значения 1 или 2 при участии в процессе ионных пар или только 2, когда основную роль в анодной реакции играют ионы С1– , т. к. образование частиц СuC1 в силу малой растворимости хлорида меди (I) должно вести к солевой пассивности меди, но экспериментально этого не наблюдается. Тогда суммарное кинетическое уравнение запишется следующим образом:
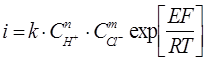 (35)
(35)
Если ионные ассоциаты не принимают участия в анодном процессе (схема (33б-34б), то n =0, если же реакция протекает только с участием ионных асcоциатов, которые представлены в виде ионных двойников, то n=m.
В [ ] указывается на то, что известные для водных сред ингибиторы коррозии меди ( бензотриазол ( БТА ), тиомочевина, никотиновая кислота [[18] ]) только не оказывают ингибирующего действия, но даже вызывают увеличение скорости коррозии в 1М изопропанольных растворах НС1 .
***
Подводя итог обзору литературных данных по коррозионному и электрохимическому поведению меди можно отметить следующее. Как в водных, так и в неводных, в частности, хлоридных спиртовых средах медь переходит в раствор в виде однозарядных ионов, образуя комплексные соединения. В органических растворителях дополнительная устойчивость Cu + обусловлена высоким значением энергии их сольватации.
В присутствии собственных двухвалентных ионов наблюдается параллельное протекание наряду с электрохимическими процесса коррозии меди и химической реакции репропорционирования на поверхности электрода, доля которой весьма значительна в неводных растворителях и составляет лишь несколько процентов в кислых водных средах.
Природа спирта, в целом, не вносит принципиального изменения в электрохимическое поведение меди. В то же время, не вполне ясно, будут ли наблюдаться те же закономерности и в спиртовых растворах с высоким содержанием хлороводорода, значительно чаще применяющихся в органическом синтезе . Цель настоящей работы состоит в выяснении характера влияния ионов Cu 2+ на коррозия меди в 5М безводных изопропанольных растворах НС1 а также в выявлении роли воды в смешанном водно-спиртовом растворителе.
II . МЕТОДИКА ЭКСПЕРИМЕНТА.
Объектом исследования служила медь марки М1 (99,94% Сu).
Применялись следующие составы электролитов:
Изопропиловый спирт + 5М НС1 + х М С, Изопропиловый спирт + 5М НС1 +10% Н 2 О + х М С
где х принимает значения 10 -4 ; 10-3 ; 10-2 ; 5. 10-2 ; 10-1 .
Содержание воды в исходном изопропиловом спирте квалификации « х.ч .» составляет не более 0,2 мас.%. Такой алкоголь далее будем называть условно безводным (у.б).
Рабочие растворы готовили насыщением спирта сухим хлороводородом, получаемым с использованием Н2 SO4 и NaCl квалификации «х.ч .», согласно [ [19] ], по уравнению:
NaC1 + H 2 SO4
Смешанный растворитель с 10 мас.% воды получали путем добавления к исходному спирту рассчитанного количества бидистиллята с последующим насыщением полученного растворителя хлороводородом по указанной выше методике, концентрацию которого определяли титрованием щелочью в присутствии фенолфталеина предварительно разбавленных водой проб.
При использовании комплексных электролитов в полученные титрованные растворы добавляли необходимые массы соли. Хлорид кальция и меди (II) высушивались в воздушном термостате при температуре 100 0 C.
К мас
К мас
где D m — потери массы образцов в граммах,
t — время в часах,
S — площадь поверхности образца в см2 .
К мас
i кор
Электрохимические измерения проводились потенциостатическим методом на неподвижном медном электроде. Использована поляризация медного дискового электрода, армированного во фторопласт (потенциостат П5827М, шаг потенциала 20 мВ).
Значения потенциалов измерены относительно водного насыщенного хлорсеребряного электрода сравнения (вспомогательный электрод — платиновый) и пересчитаны на водную водородную шкалу, а полученные значения силы тока (мкА) — на плотность тока (i ):
i = I [A] / S [см2 ] (39),
где S — площадь свободной грани электрода. Поляризационные кривые построены в координатах в полулогарифмических координатах.
Вязкость изученных растворов измерена вискозиметром типа ВПЖ с диаметром капилляра 1,12 мм и константой 0,07749 при 18 0 С. Точность оценки истечения времени не хуже 0,2 с. Кинематическая вязкость (n ) в сактистоксах (сСт) рассчитывалась по формуле:
n = К. . t ,(40)
где К — константа вискозиметра;
t — время истечения в секундах.
Плотность определена пикнометрическим методом по отношению к плотности чистой воды, взятой при 18 0 С и рассчитана согласно уравнению:
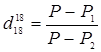 (41)
(41)
Р — вес пустого пикнометра;
Р 1
Р 2
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ, И ИХ ОБСУЖДЕНИЕ.
Скорость коррозии меди, определенная гравиметрически, в 5М у.б. изопропанольных растворах НС1 достаточно велика и составляет 2,1. 10-4 г/(см2. час).
Согласно литературным данным, введение в коррозионную среду двухвалентных ионов меди существенно увеличивает коррозионные потери, проявляя двоякое действие. Во первых, ионы С u2+ влияют на электрохимическую коррозию, выступая наряду с растворенным кислородом дополнительным катодным деполяризатором (12):
Cu 2+ + e
Во вторых, отмечено протекание параллельной с электрохимической коррозией меди неэлектрохимической реакции репропорционирования (10):
Cu + Cu 2+
Cu +
Величина скорости электрохимической коррозии, определенная путем экстраполяции начальных участков поляризационных кривых (рис.1) на потенциал коррозии также увеличивается с ростом концентрации хлорида меди (II), оставаясь ниже общих коррозионных потерь в 2-3 раза во всем изученном интервале концентраций С u2+ (таб. 1).
Таким образом, наряду с электрохимической коррозией меди в растворах, содержащих ионы Cu2+ наблюдается и некоторая доля неэлектрохимической составляющей коррозии.
Рис.1. Поляризационные кривые на меди в растворах состава 5М НС1 + х М С u С12 в у.б изопропиловом спирте.
Неподвижный электрод. Комнатная температура. Воздух.
х : 1-0; 2-10-4 ; 3-10-3 ; 4-5. 10-2 ; 5-10-1 .
Рис.2. Зависимость электрохимической и общей скоростей коррозии, а также предельного катодного тока от концентрации CuC 12 в растворах 5М НС1 + х М С u С12 в у.б изопропиловом спирте. Неподвижный электрод. Комнатная температура.
Воздух. х : 10-4 ;10-3 ;10-2 ; 5. 10-2 ; 5-10-1 .
1- i эх ;2- i кор,общ ; 3 — i пред ; 4 — (i кор,общ — i 0 )
Таблица 1.
Влияние добавки
скорость электрохимической коррозии и предельный ток катодных
поляризационных кривых в 5М у.б. изопропанольных растворах НС1.
(Воздух. Продолжительность коррозионных испытаний -2 часа.
Неподвижный электрод.)
| Параметр, | Концентрация CuC12 , моль/л | |||||
| А/см 2 | 0 | 10 -4 | 10 -3 | 10 -2 | 5 . 10-2 | 10 -1 |
| iкор,общ | 8,79 . 10-5 | 9,63 . 10-5 | 1,00 . 10-4 | 1,55 . 10-4 | 1,60 . 10-4 | 2,09 . 10-4 |
| iэх | 6,90 . 10-5 | 3,98 . 10-5 | 6,31 . 10-5 | 6,31 . 10-5 | 8,70 . 10-5 | 8,70 . 10-5 |
| iпред | 2,50 . 10-4 | 2,50 . 10-4 | 3,61 . 10-4 | 4,20 . 10-4 | 5,00 . 10-4 | 1,00 . 10-3 |
Анализ поляризационных кривых, полученных в 5М у.б. изопропанольных растворах НС1 , показывает, что с ростом концентрации CuС12 закономерно снижается стационарный потенциал, уменьшается скорость анодного процесса и увеличивается предельный ток катодных поляризационных кривых (рис. 1).
Последний факт подтверждает литературные данные о деполяризующем действии двухвалентных ионов меди. В таком случае предельный катодный ток (iпред ) должен складываться из двух величин — предельного катодного тока по кислороду (![]() ) и предельного тока по Cu2+ (iпред ,С u 2+ ):
) и предельного тока по Cu2+ (iпред ,С u 2+ ):
i пред
i эх
Таблица 2.
| № п/п | Параметры | условно безводный спирт | смешанный растворитель | ||
| концентрационный интервал CuC 12 | концентрационный интервал CuC 12 | ||||
| 1 | ( ¶ lgiэх / ¶ lgCCu 2+ ) | 0,12 | 10 -4 –10-1 | 0 | 10 -4 -10-2 |
| 0,80 | 10 -2 — 10-1 | ||||
| 2 | ( ¶ lgiкор,общ / ¶ lgCCu 2+ ) | 0,12 | 10 -4 –10-1 | 0 | 10 -4 -10-2 |
| 0,90 | 10 -2 — 10-1 | ||||
| 3 | ( ¶ lgiпред / ¶ lgCCu 2+ ) | 0,20 | 10 -4 –10-1 | 0 | 10 -4 -10-2 |
| 1,20 | 10 -2 — 10-1 | ||||
| 4 | ( ¶ lg( iкор,общ — i0 )/ ¶ lgCCu 2+ ) | 0,50 | 10 -4 –10-1 | 0 | 10 -4 -10-2 |
| 2,10 | 10 -2 — 10-1 | ||||
| 5 | ( ¶ lgia / ¶ lgCCu 2+ ) | -0,46 | 10 -4 –10-1 | -1,4 | 10 -4 -10-2 |
а, следовательно, коррозия протекает не на предельном токе и не связана с транспортными ограничениями окислителя-деполяризатора к поверхности электрода.
Порядок общей скорости коррозии по С uС1 2 , представляющий собой тангенс угла наклона соответствующей прямой равен 0,12; iэх и iпред также возрастают с порядками 0,12 и 0,20 соответственно (таб. 2).
Поскольку коррозия меди в солянокислых изопропанольных растворах НС1 с добавками Cu2+ , с одной стороны, вызвана, кислотностью среды, а с другой — влиянием CuC12 , то общая скорость коррозии, очевидно, будет представлять собой сумму:
i кор
i 0
i Cu 2+
i Cu 2+ =
CuC1 2
Cu 2+
J = 1/2 ![]() , (45)
, (45)
где С i — концентрация иона; Zi -заряд иона.
Вели чина J в нашем случае представляет собой сумму:
J = 1/2 (C H+ + CC1 — + 4CCu 2+ ),
C H + = CHC1 ;
Рис.3. а ) Анодные поляризационные кривые на меди в растворах состава 5М НС1 + х М С u С12 в у.б изопропиловом спирте. Неподвижный электрод. Комнатная температура. Воздух.
х : 1-10-4 ; 2-10-3 ; 3-5. 10-2 ; 4-10-1 .
б ) Нахождение порядка реакции анодной ионизации по данным рис. 3а .
Подставляя концентрации ионов в уравнение (46) получим:
J = CHC 1 + 3 ![]() . (47)
. (47)
Так как ионная сила раствора одно-одновалентных электролитов равна концентрации растворенного вещества, то изменение ее за счет введения соли будет составлять величину D J :
D J = J-J0 , (48)
J 0
Поскольку концентрация фонового электролита достаточно высока (5 моль/л НС1 ), то введение соли в концентрации 10-4 -10-1 моль/л весьма незначительно повышает величину J , а , следовательно этим изменением можно пренебречь (таб. 3).
Последнее допущение дает возможность считать постоянными коэфициенты активности, а, следовательно, и активности ионов электролитов согласно первому приближению Дебая-Гюккеля:
lg f ± = — A ![]() (49)
(49)
Таблица 3.
Влияние изученных концентраций
5М НС1 в изопропаноле.
| Ошибка измерения ионной силы раствора | Концентрация CuC12 , моль/л | |||||
| 10 -4 | 10 -3 | 10 -2 | 5 . 10-2 | 10 -1 | ||
|
Абсолютная D J = J- J0 , |
3 . 10-4 | 3 . 10-3 | 3 . 10-2 | 1,5 . 10-1 | 3 . 10-1 | |
|
Относительная l = |
6 . 10-3 | 6 . 10-2 | 0,6 | 2,9 | 5,76 | |
CuC1 2
i a
CuC1 2
В 5М изопропанольных растворах НС1 с 10 мас.% Н2 О в растворителе и добавками CuC12 наблюдаются, в основном, те же закономерности, что и в у.б. растворах: коррозия меди протекает не на предельном токе (iкор,об <iпред ), а скорость электрохимического растворения ниже общих коррозионных потерь приблизительно в 2 раза во всех исследуемых растворах (таб. 4).
Таблица 4.
Влияние добавки
скорость электрохимической коррозии и предельный ток катодных
поляризационных кривых в 5М изопропанольных растворах НС1 на основе смешанного растворителя (10 мас% Н2 О).
(Воздух. Продолжительность коррозионных испытаний -2 часа.
Неподвижный электрод.)
| Параметр, | Концентрация CuC12 , моль/л | |||||
| А/см 2 | 0 | 10 -4 | 10 -3 | 10 -2 | 5 . 10-2 | 10 -1 |
| iкор,общ | 6,28 . 10-5 | 7,53 . 10-5 | 7,95 . 10-5 | 7,95 . 10-5 | 3,72 . 10-4 | 1,09 . 10-3 |
| iэх | 3,63 . 10-5 | 3,80 . 10-5 | 3,80 . 10-5 | 3,80 . 10-5 | 1,58 . 10-5 | 2,29 . 10-5 |
| iпред | 1,82 . 10-4 | 1,99 . 10-4 | 1,99 . 10-4 | 1,99 . 10-4 | 1,99 . 10-3 | 3,98 . 10-3 |
Н 2 О
Рис.4. Зависимость скорости коррозии меди в 5М изопропанольных растворах НС1 от содержания Н2 О в растворителе.
Неподвижный электрод. Комнатная температура. t =2 часа.
Рис.5. Поляризационные кривые на меди в растворах состава 5М НС1 + х М С u С12 + 10 мас.% Н2 О в изопропиловом спирте.
Неподвижный электрод. Комнатная температура. Воздух.
х : 1-0; 2-10-4 ; 3-10-3 ; 4-10-2 ; 5-5. 10-2 ; 6-10-1 .
Рис.6. Зависимость электрохимической и общей скоростей коррозии, а также предельного катодного тока от концентрации CuC 12 в растворах 5М НС1 + х М С u С12 + 10 мас.% Н2 О в изопропиловом спирте. Неподвижный электрод. Комнатная температура. Воздух. х : 10-4 ;10-3 ;10-2 ; 5. 10-2 ; 5-10-1 .
1- i эх ;2- i кор,общ ; 3 — i пред ; 4 — (i кор,общ — i 0 )
Рис.7. а ) Анодные поляризационные кривые на меди в растворах состава 5М НС1 + х М С u С12 + 10 мас.% Н2 О в изопропиловом спирте. Неподвижный электрод. Комнатная температура. Воздух. х : 1-10-4 ; 2-10-3 ; 3-10-2 ; 4-5. 10-2 ; 5-10-1 .
б ) Нахождение порядка реакции анодной ионизации по данным рис. 7а .
На рис. 7 a приведены анодные поляризационные кривые в системе 5М НС1 + 10% Н2 О + х М С uС12 . Порядок реакции анодной ионизации меди по С u2+ , определенный описанным выше методом, равен -1,4. Таким образом, и в средах с содержанием воды в растворителе 10 мас %, очевидно, увеличение скорости электрохимической коррозии с ростом Cu2+ обусловлено влиянием их на катодную реакцию (12).
В [ ] отмечается, что перемешивание раствора (до 2000 об/мин вращающегося дискового электрода) в 1М изопропанольных растворах НС1 с 0,1М добавкой С uC 12 повышает общие коррозионные потери почти на порядок. Следовательно, в указанной среде процесс коррозии ограничен либо диффузией реагентов к поверхности электрода, либо скоростью отвода продуктов реакции. Причем диффузионные ограничения довольно легко снимаются путем перемешивания раствора. Облегчение коррозионного процесса меди в 5М растворе НС1 на основе смешанного растворителя, таким образом, можно связать с повышением скорости диффузии. Коэффициент диффузии (D ) зависит, прежде всего, от температуры и вязкости среды, в которой происходит перенос вещества [[21] ]:
![]()
где В — коэффициент пропорциональности, зависящий от природы растворенного вещества; T — абсолютная температура; h — динамическая вязкость раствора. Так как все испытания проводились при постоянной температуре, то повышение скорости диффузии, предположительно, может быть обусловлено снижением вязкости электролитных композиций на основе смешанного растворителя по сравнению с безводными растворами. Поэтому во всех исследуемых коррозионных средах была измерена кинематическая вязкость (n ), которая связана с динамической соотношением [21]:
h = n . d , (51)
где d — плотность раствора.
Концетрационная зависимость кинематической и динамической вязкостей от С u С12 показана на рис.8. Введение воды в растворитель в количестве 10 мас.% оказывает весьма слабое влияние на значения n и h . Таким образом, изменение вязкости растворов при переходе от у.б. 5М изопопанольных растворов НС1 с добавками С u С12 к аналогичным средам на основе смешанного водно-спиртового растворителя в изученном интервале концентраций CuC 12 не может быть ответственным за увеличение скорости коррозии меди в последних.
Рис.8. Влияние концентрации CuC 12 и воды в растворителе на кинематическую (1) и динамическую (2) вязкости в 5М изопропанольных растворах НС1. Температура — 18 0 С.
а — у.б. растворитель; б — 10 мас.% Н2 О в растворителе.
ВЫВОДЫ :
Изучено влияние ионов Cu 2+ на коррозию меди в у.б. изопропанольных растворах состава 5М НС1 + х М С u С12 (х = 10-4 -10-1 ).
Показано, что добавки С uC 12 вызывают повышение i кор,общ , i эх и i пред с порядками по Cu 2+ 0,12; 0,12; и 0,20 соответственно. Процесс анодной ионизации меди в указанных средах имеет отрицательный порядок по Cu 2+ (-0.46), что связано с их ингибирующим действием на процесс анодной ионизации меди.
Исследовано влияние ионов Cu 2+ на коррозионное и электрохимическое поведение меди в растворах состава 5М НС1 + х М С u С12 (х =10-4 -10-1 ) в смешанном водно-спиртовом растворителе (10% Н2 О). Показано, что ионы Cu 2+ в концентрации 10-4 -10-1 моль/л практически не оказывают влияния на предельный ток катодных поляризационных кривых, на скорость электрохимической коррозии и на общие коррозионные потери. В интервале CСuC12 10-2 -10-1 моль/л все указанные параметры резко возрастают с порядком, близким к 1. Реакция анодной ионизации меди в средах на основе смешанного растворителя имеет порядок по Cu 2+ , равный -1,40.
Коррозия меди в 5М у.б. и обводненных изопропанольных растворах НС1 с добавками Cu С12 протекает не на предельном токе и не связана с транспортными ограничениями окислителя-деполяризатора; i кор,общ > i эх во всем исследованном интервале концентраций CuC 12 и воды, что говорит о наличии неэлектрохимической составляющей коррозии.
Н 2 О
Определены кинематическая и динамическая вязкости всех изученных составов. Показано, что с повышением концентрации CuC 12 вязкость растворов увеличивается; введение 10 мас.% Н2 О в растворитель практически не сказывается на величинах n и h
ЛИТЕРАТУРА
[Электронный ресурс]//URL: https://drprom.ru/diplomnaya/korrozionnyie-svoystva-medi/
[1].
Краткая химическая энциклопедия. М., 1964. Т.3. С.76-82.
— Рипан Р., Четяну И. Неорганическая химия. М., Мир. Т.2. С.681-723.
— Томашов Н.Д. Теория коррозии и защиты металлов. М., 1959.
— Рылкина М.В., Андреева Н.П., Кузнецов Ю.И. Влияние среды на депассивацию меди. //Защита металлов. 1993. Т.29. №2. С.207-214.
-Чернов Б.Б., Кузовлева К.Т., Овсянникова А.А. Коррозионное поведение меди в 3%-ном растворе хлорида натрия и морской воде. //Защита металлов. 1985. №1.
— Астахова Р.К., Красиков В.С. К вопросу о поведении меди в солянокислых растворах. // Журн. прикл. химии. 1971. Т.44. №2. С.363-371.
— Скорчелетти В.В., Степанов А.И., Куксенко Е.П. Анодное поведение сплавов системы медь-цинк в 0,1М растворе хлористого натрия. //Журн. прикл. химии. 1958. Т.31. №12. С.1823-1831.
— Кузнецова Л.А., Коварский Н.Я. Электроосаждение и электрорастворение меди на электроде, предварительно модифицированном тиомочевиной. //Электрохимия. 1993. Т.29. №2. С.234-238.
— Кузнецов С.А. Электрохимическое поведение меди в хлоридных и хлоридно-фторидных растворах. // Электрохимия. 1994. Т.27. №11. С..
— Вахидов Р.С., Джемилев У.М., Селимов Ф.А., Хазиева А.Р. Анодное поведение меди в диметилсульфоксиде.// Электрохимия. 1993. Т.29. №8. С..
— Атоносянц А.Г., Кучеренко А.В., Шумелов В.И. анодное растворение меди в водно-ацетонитрильных растворах нитрата меди (II).
// Электрохимия. 1988. Т.24. №5. С.653.
— Молодов А.И., Янов Л.А., Лосев В.В. Механизм коррозии меди в метаноле и н -пропаноле в присутствии кислорода. // Защита металлов. 1985. Т.21. №6. С.884-889.
— Шарифулина И.И., Цыганкова Л.Е., Вигдорович В.И. Коррозия меди в метанольных растворах хлористого водорода. //Журн. Прикл. химии. 1977. Т.50. №10. С.2417.
— Вигдорович В. И., Цыганкова Л. Е., Шарифулина И. И. Коррозия меди в этиленгликолевых растворах HСl. // Химия и хим. технология. 1977 №8, С.1179.
— Шефер В., Дубинин А.Г. Анодное поведение меди в различных ратворителях в присутствии хлорид-ионов. //Электрохимия. 1996. Т.32. №3. С.333-338.
— Цыганкова Л.Е., Вигдорович В.И., Бердникова Г.Г., Машкова Т.П. Анодная ионизация меди в растворах изо -С3 Н7 ОН–Н2 О–НС1. //Электрохимия. 1998.Т.34. №8. С.848-854.
— Бердникова Г.Г., Машкова Т.П., Ермолова Е.Е., Губанова Н.А., Шувалова С.И., Пашенцев А.В., Цыганкова Л.Е. Коррозия и электрохимическое поведение меди в системе НС1 — пропанол-2 — Н 2 О. //Вестник ТГУ. 1997. Т.2. Вып.1. С.12-18.
— Алцыбеева А. И., Левин С. З., Ингибиторы коррозии металлов. Л.: Химия. 1968.
— Карякин Ю.В., Ангелов М.И. Чистые химические реактивы, М. ; Химия. 1974. С.186.
— Бердникова Г.Г. Автореферат канд. дис. Тамбов. 1998. 21с.
— Кухлинг Х. Справочник по физике: Пер. с нем. — М: Мир, 1982. С.128-140.
