Переработка цинковых руд началась в глубокой древности при выплавки латуни (сплав цинка с медью).
Еще в V в. до н. э. в Индии окисленную руду переплавляли в небольших горнах с углем и медью. Позднее латунь начали выплавлять в Китае и других странах Востока.
До середины XVII в. Цинк в Европе не производили, хотя еще в конце XIII в. Марко Поло описал, как получают цинк в Персии. Крупнейшие ученые XVI в. Парацельс и Агрикола в своих трудах уделяли место выплавке цинка. Однако заводское получение цинка организовать не удалось.
Цинк пытались получить точно так же, как и другие металлы: обжигали руду, превращая соединения цинка в оксид, и восстанавливали его углем, предполагая выплавить металл. Цинк при этом восстанавливался до металлического, но не выплавлялся, так как при температуре процесса он весь испарялся и, окисляясь в газовой фазе печи кислородом воздуха, снова превращался в оксид цинка. Наладить производство цинка в странах Европы удалось лишь после того, как руду стали восстанавливать в закрытых ретортах без доступа воздуха.
В 1743 г. в Бристоле (Англия) заработал первый в Европе цинковый завод. На американском континенте первый цинковый завод был
В настоящее время производство цинка по масштабам уступает только производству железа, алюминия и меди
Отечественная цинковая промышленность была создана после Великой Октябрьской социалистической революции. До революции в России работал один цинковый завод в г. Орджоникидзе, который удовлетворял потребности страны в цинке не более чем на 5%. В 1929 г. был построен цинкдистилляционный завод в г. Константинове, в 1931 г. начал работать такой же завод в г. Белово, в 1933 г. пустили первый в стране завод “Электроцинк” (г. Орджоникидзе), а в 1935 г. Челябинский цинкэлектролитный завод.
Цинковая промышленность России не играет сколько-нибудь важной роли в мире, однако очень важна для отечественной экономики. Добыча цинка в России составляет лишь 1,7% от мировой, а производство рафинированного цинка — 2,7%. Низким остается уровень потребления цинка в стране — около 1 кг/чел., это намного ниже среднемирового.
В России цинк извлекается из медноколчеданных месторождений Урала, а также из полиметаллических месторождений в горах Южной Сибири и Приморья. На долю месторождений Уральского региона (Башкирия, Челябинская и Оренбургская обл.) приходится более 75% объема выпуска российских цинковых концентратов. Обеспеченность разведанными запасами эксплуатируемых месторождений в целом по стране хорошая и составляет 27 лет — на столько времени хватит известных ныне достоверных запасов, чтобы обеспечить нынешний уровень добычи.
Черная и цветная металлургия в России
... металлургия Тяготеет к центрам машиностроения Производство ферросплавов Тяготеет к крупным источникам электроэнергии и металлургическим заводам полного цикла Природной основой черной металлургии служат источники металлического сырья и топлива. Россия хорошо обеспечена сырьем для черной металлургии, ...
Мировые цены на цинк в последние годы стремительно падают: среднегодовая цена 1 т цинка в 2000 г. на бирже равнялась 1128 долл., в 2001 г. — 885, а в 2002 г. — 778 долл. Все это стало следствием избыточного выпуска цинка, особенно в странах Азии, а также отражением того, что в мире имеется множество бездействующих мощностей по выплавке этого металла. При нынешней ситуации на рынке цинка около четверти всех цинковых рудников мира не покрывают свои эксплуатационные расходы. Прибыль некоторые цинковые предприятия получают только в результате извлечения попутно с цинком других металлов, например серебра, индия, кадмия, а также от реализации серной кислоты, получаемой как побочный продукт при выплавке. [1], [3]
1 Общие сведения, .1 Физические свойства
Металлический цинк обладает характерным голубоватым блеском на свежей поверхности, который он быстро теряет во влажном воздухе. Температура плавления 419,58° С, температура кипения 906,2° С, плотность 7,133 г/см3. При комнатной температуре цинк хрупок, при 100-150° С становится пластичным и легко прокатывается в тонкие листы и проволоку, а при 200-250° С вновь становится очень хрупким и его можно быть истолочь в порошок.
Полиморфных модификаций не имеет. Кристаллизуется в гексагональной решетке с параметрами а = 2,6594Å, с = 4,9370Å. Атомный радиус 1,37Å; ионный Zn2+ — 0,83Å. Плотность твердого цинка 7,133 г/см3 (20 °С), жидкого 6,66 г/см3 (419,5 °С); tпл 419,5 °С; tкип 906 °С. Температурный коэффициент линейного расширения 39,7·10-3 (20-250 °С), коэффициент теплопроводности 110,950 вт/(м ·К) 0,265 кал/см·сек·°С (20 °С), удельное электросопротивление 5,9·10-6 ом·см (20 °С), удельная теплоемкость Цинка 25,433 кдж/(кг·К.) [6,07 кал/(г·°С)]. Предел прочности при растяжении 200-250 Мн/м2 (2000-2500 кгс/см2), относительное удлинение 40-50%, твердость по Бринеллю 400-500 Мн/м2(4000-5000 кгс/см2).
Цинк диамагнитен, его удельная магнитная восприимчивость -0,175·10-6.
Радиус атома Zn 0,139 нм, радиус иона Zn2+ 0,060 нм (координационное число 4), 0,0740 нм (координационное число 6) и 0,090 нм (координационное число 8).
Энергии последовательной ионизации атома соответствуют 9,394, 17,964, 39,7, 61,6 и 86,3 эВ. Электроотрицательность по Полингу 1,66.[4]
цинк руда концентрат электролиз
1.2 Химические свойства
Цинк является довольно активным металлом. Он легко взаимодействует с кислородом, галогенами, серой и фосфором:
- Zn + О2 = 2 ZnО (оксид цинка);
- (1)+ Сl2 = ZnСl2 (хлорид цинка);
- (2)+ S = ZnS (сульфид цинка);
- (3)
Zn + 2 Р = Zn3Р2 (фосфид цинка).
(4)
При нагревании взаимодействует с аммиаком, в результате чего образуется нитрид цинка:
Zn + 2 NН3 = Zn2N3 + 3 Н2, (5)
а также с водой:
+ Н2О = ZnО + Н2 (6)
и сероводородом:
+ Н2S = ZnS + Н2. (7)
Образующийся на поверхности цинка сульфид предохраняет его от дальнейшего взаимодействия с сероводородом.
Цинк хорошо растворим в кислотах и щелочах:
- + Н2SO4 = ZnSO4 + Н2; (8)
Zn + 10 НNО3 = 4 Zn(NО3)2 + NН4NО3 + 3 Н2О; (9)+ 2 КОH + 2 Н2О = К2[Zn(ОН)4] + Н2. (10)
В отличие от алюминия цинк растворяется в водном растворе аммиака, так как образует хорошо растворимый аммиакат:
Свойства и получение цинка
... то целью его является возможно более полный перевод сернистого цинка в оксид цинка, растворимую в разбавленных растворах серной кислоты. Выщелачивание огарка осуществляется отработанным электролитом, содержащим серную ... с дутьем. Производительность постепенно повышалась, но цинк содержал до 3 % примесей, в том числе ценный кадмий. Дистилляционный цинк очищают ликвацией (то есть отстаиванием жидкого ...
+ 4 NН4ОН = [Zn(NН3)4](ОН)2 + Н2 + 2 Н2О. (11)
Цинк вытесняет менее активные металлы из растворов их солей:
- СuSO4 + Zn = ZnSO4 + Сu; (12)
СdSO4 + Zn = ZnSO4 + Сd. (13) , [4]
1.3 Применение цинка
Положение цинка в таблице электрохимических потенциалов металлических элементов указывает, что он способен защитить железо, сталь и медные сплавы от коррозии. Это свойство известно как анодная защита, и половина производимого в мире цинка расходуется на покрытие стали. Старейший метод цинкования путем погружения в расплав все еще остается наиболее удобным методом нанесения покрытий на металлические оконные рамы и другие механически обработанные изделия. Следующее по важности применение цинка — латунь и другие литейные сплавы на основе цинка. Такие сплавы имеют хорошую коррозионную стойкость; цинк, расходуемый на их получение, потребляется примерно в том же количестве, что и цинк, идущий на цинкование. Цинковые сплавы прочны, стойки и обладают прочностью на растяжение до 300 МПа. Легкость и точность, с которыми могут формоваться изделия из них методами литья в кокиль, обусловливают их использование в качестве материалов для автомобильных деталей, скобяных изделий, игрушек и другой продукции. Оксид цинка применяется в покрытиях, а цинковая пыль — в антикоррозийных красках. Литопон — продукт соосаждения сульфида цинка и сульфата бария — используется в красках и пластмассах. Цинк с небольшими добавками других металлов применяется как кровельный материал, для изготовления фрикционных накладок барабанных тормозов, сухих гальванических элементов и электрических конденсаторов.
Примерно 50% мирового производства цинка расходуется на покрытие железных изделий с целью защиты их от ржавления.
Более 30% всего производства в мире цинка употребляется на производство сплавов. Различные сорта бронз широко применяют в машиностроении. Сплавы цинка с медью и никелем называют мельхиором и нейзильбером. Благодаря способности давать сплавы с серебром и золотом, цинк используется в металлургии для извлечения благородных металлов.
Цинковая пыль применяется для осаждения золота и серебра из растворов при их получении гидрометаллургическим путем, для очистки растворов от меди и кадмия перед электролизом растворов цинка.
Оксид цинка широко используют при производстве резины и ее обработке. Он улучшает качество резиновых шин и ряда других резиновых изделий. Широко используют чистый цинковый купорос при производстве корда-осных шин.
Соединения цинка, в частности его антимонид, используют в качестве интерметаллических полупроводников в приборах для превращения электрической энергии в тепловую. Антимонид цинка применяют также для точечного охлаждения детекторных приборов при изучении космоса.[1]
2. Вещественный состав цинксодержащих руд и концентратов
Цинксодержащие руды делят на сульфидные и окисленные в зависимости от того, какими минералами представлены в них металлы. В сульфидных рудах цинк обычно находится в виде сфалерита ZnS (67,1 % Zn), иногда вюртцита ZnS (67,1 % Zn), реже — в виде марматита
Цинк обычно не образует самостоятельных руд, а входит в состав полиметаллических свинцово-цинковых или медно-свинцово-цинковых руд.
Особенности производственного процесса ОАО «Челябинский ...
... заводе применен гидрометаллургический способ производства цинка, с использованием сульфидных цинковых концентратов. Сущность гидрометаллургического метода производства цинка заключается в выщелачивании обожженных цинковых концентратов слабым раствором серной кислоты с целью перевода цинка в раствор в виде ...
В этих рудах наряду со сфалеритом, присутствуют сульфиды свинца, меди, кадмия, марганца, серебра, мышьяка, сурьмы, кобальта. В сфалерите зачастую в виде примесей содержатся редкие элементы — индий, таллий, галлий и германий, а также золото в количестве от тысячных до сотых долей процента.
Свинец в сульфидных цинковых рудах представлен обычно в виде галенита PbS. В окисленных зонах месторождений цинксодержащих руд цинк присутствует в виде следующих минералов: цинкита ZnO (80,3 % Zn), франклинита (Zn, Mn)![]() (6-18 % Zn), виллемита
(6-18 % Zn), виллемита ![]() (58,6% Zn), каламина
(58,6% Zn), каламина ![]() (57,1 % Zn), смитсонита ZnC03 (52,1 % Zn) и гидроцинкита
(57,1 % Zn), смитсонита ZnC03 (52,1 % Zn) и гидроцинкита ![]() (47,6 % Zn).
(47,6 % Zn).
Из породообразующих компонентов в цинковых рудах содержатся кварц, глина, карбонаты кальция и магния, барит и др.
Низкое содержание цинка (1-3.%) и сложность состава цинксодержащих руд обусловливают необходимость их предварительного обогащения. Селективная флотация полиметаллических руд обеспечивает получение высококачественных цинковых концентратов, содержащих, %: (51 ±3,5) Zn; (32±2,5) S; (8,0±3,5) Fe; (0,2±0,05) Cd; (1±0,5) Pb; (l±0,5)Cu; (2,5±1,5) карбонатов и силикатов.
Кроме основных составляющих, в концентратах содержится незначительное количество золота; серебро(75-100 г/т); индий, ртуть, галлий, таллий; вредные примеси (0,01-0,1 % As; 0,01-0,03 % Sb; 0,01-0,02 % CI; -0,01% F; 0,001-0,01% Co; 0,01-0,05% Ni; германий, селен, теллур).
Таким образом, цинковые концентраты представляют собой комплексное сырье. Отечественные предприятия к настоящему времени освоили извлечение из них 11-17 элементов с высокой экономической эффективностью.[1]
Для извлечения цинка из концентратов применяют два способа: пирометаллургический (дистилляционный), показанный на рисунке 1 и гидрометаллургический (электролитический), показанный на рисунке 2. В России основное количество цинка получают гидрометаллургическим способом.
Исторически первым способом переработки был пирометаллургический. Технология способа и его аппаратурное оформление связаны с особенностями восстановления цинка из оксида. Восстановление оксида цинка до металла углеродом и СО происходит при температуре свыше 1000-1100 °С (температура кипения цинка 906°С).
Реакции восстановления сопровождаются выделением газообразного цинка, его возгонкой (дистилляцией).
Компоненты пустой породы остаются при этом в твердом виде. Конденсацией паров можно получить жидкий металлический цинк.
ZnO + C Zn + CO; (1)+ CОZn + CO2 . (2)
Поэтому пирометаллургический способ производства цинка называют дистилляционным или просто дистилляцией.
Дистилляционный способ связан с большой затратой топлива и огнеупорных материалов и дает цинк только низших марок, а для получения высококачественной продукции требуется рафинирование.
Принципиальная схема гидрометаллургического способа переработки цинковых концентратов приведена на рисунке 2. В основе гидрометаллургической схемы заложено выщелачивание оксида цинка из обожженного цинкового концентрата разбавленной серной кислотой:
Реферат цинк и его сплавы
... серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ...
ZnO + H 2 S04 = ZnS04 + H2 0. (3)
Цинк из раствора выделяют путем электролитического восстановления на катоде. На аноде в это время регенерируется серная кислота, что позволяет использовать отработанный электролит в качестве растворителя при выщелачивании огарка.
Так как в раствор при выщелачивании переходят многие сопутствующие элементы-примеси (Си, Cd, Co и др.), то перед электролизом раствор подвергают тщательной очистке. Чем чище поступает на электролиз раствор, тем более высокого качества получают товарный цинк.
При электролизе происходит следующая реакция:
ZnS0 4 + Н2 0 = Zn + H2 S04 + 0,5O2. (4)
3.1 Обжиг цинковых концентратов
На гидрометаллургическую переработку поступают сульфидные цинковые концентраты, содержащие, %: 45- 60 Zn; 29-35 S; 6-; 6-12 Fe; 1,5-5,0 Аl 2 О3 ; 0,2-4,0Рb; 0,1- 3,0Cu; 0,4-3,0 SiO2 ; 0,5-1,5 СаО; 0,2-1,0 MgO; 0,25- 0,80 Cd; 0,01-0,4 As; 0,01-0,3 Sb, а также 20-160 г/т Ag и 0,5-10 г/т Au.
Сульфид цинка ZnS практически нерастворим в разбавленных кислотах. Выщелачивание его в концентрированной серной кислоте (60-65 % H 2 SO4 ) возможно при 150-170 °С, но сложно в аппаратурном оформлении и экономически нецелесообразно. Поэтому перед выщелачиванием цинковые сульфидные концентраты подвергают окислительному обжигу, продукты которого хорошо растворимы в разбавленных растворах серной кислоты при низких температурах. Обжиг позволяет применить к переработке цинковых концентратов гидрометаллургическую технологию, принципиальная схема которой приведена на риснуке 3.1.
При осуществлении окислительного обжига цинковых концентратов стремятся получить огарок, как можно полнее соответствующий требованиям последующих гидрометаллургических процессов. Очень важно, чтобы продукт обжига был порошкообразным. Чем мельче порошок, тем выше скорость его выщелачивания. Обжиг следует вести в основном с получением оксида цинка ZnO и некоторого количества сульфата цинка ZnSO 4 .
Наиболее полно удовлетворяет требованиям обжиг в печах кипящего слоя (КС).
Поэтому в настоящее время на всех отечественных цинковых заводах обжиг ведут в печах КС.[1]
3.2 Выщелачивание обожженного концентрата
Взаимодействие компонентов огарка с серной кислотой. Назначение операции выщелачивания огарка — растворить как можно полнее соединения цинка, содержащиеся в огарке, и получить чистые растворы для электролиза. Растворение происходит в сернокислых растворах. Выбор серной кислоты как растворителя обусловлен хорошей растворимостью в ней ZnO, условиями последующей операции электролитического восстановления цинка, а также наличием на любом цинковом заводе в достаточном количестве серной кислоты, получаемой при электролизе и производимой на месте из обжиговых газов.
Оксид цинка хорошо растворим в слабых растворах серной кислоты, сульфат цинка — в воде:
+ H 2 SO4 = ZnSO4 + H2 O.
Сульфид цинка ZnS можно растворить только в концентрированной серной кислоте при нагревании. При этом выделяется токсичный сероводород:
+ H 2 SO4 = ZnSO4 + H2 S.
Цинк и его свойства
... + 2 Н2 О. Цинк вытесняет менее активные металлы из растворов их солей. СuSO 4 ... Цинк зависит от наличия в нем примесей. Чистый Цинк менее реакционноспособен по отношению к этим реагентам из-за высокого перенапряжения на нем водорода. В воде соли Цинка ... пирометаллургии цинка – в этом процессе ... тока отрицательный электрод чаще всего делается из цинка. Значительна роль этого элемента в полиграфии. Из цинка ...
В ходе обжига образуется некоторое количество силикатов (ZnO·mSiO 2 ), ферритов (xZnO·Fe2 O3 ) и алюмината (ZnO·Al2 O3 ) цинка, малорастворимых в раствоpax серной кислоты. Их растворимость возрастает по мере повышения концентрации Н2 SO4 и температуры раствора. Так, для перевода в раствор цинка из ферритных, соединений необходима концентрация H2 SO4 200- 300 г/л и температура 80-90 °С.
Для непрерывного выщелачивания обычно применяют агитаторы с пневматическим перемешиванием (пачуки).
Для обеспечения необходимой продолжительности выщелачивания устанавливают несколько последовательно соединенных пачуков. Исходную пульпу подают в головной пачук, а из последнего пачука пульпу направляют в сгустители.
При периодическом выщелачивании огарка процесс проводят в агитаторах с механическим перемешиванием. [1]
3.3 Очистка раствора сульфата цинка от примесей
Примеси в растворе сульфата цинка в соответствии со способами выведения их из раствора можно разделить на группы. Первая группа объединяет примеси, которые можно удалить из раствора гидролизом, соосаждением, адсорбцией и коагуляцией: железо, медь, алюминий, мышьяк, сурьма, индий, германий, галлий, кремнезем. Гидролитическая очистка происходит при нейтральном выщелачивании огарка и сгущении нейтральной пульпы. Во вторую группу входят металлы, более электроположительные, чем цинк (медь, кадмий, никель, кобальт, таллий), которые можно вывести из раствора цементацией металлическим цинком.
Для удаления из раствора примесей третьей группы необходимо применять специальные реагенты, образующие с этими примесями труднорастворимые соединения. К этой группе относятся кобальт, хлорид-ион и фторид-ион. Примеси четвертой группы (калий, натрий, магний, марганец) не извлекаются применяемыми методами очистки растворов и накапливаются. Для поддержания их концентрации на определенном уровне приходится часть рабочего раствора выводить из процесса и заменять свежеприготовленным, не содержащим примесей этой группы.[1]
4. Электроосаждение цинка, .1 Теоретические положения
Выделение цинка из очищенного раствора сульфата цинка с получением готового продукта осуществляют путем электролиза раствора. Для осуществления процесса подводят электрический ток к электродам электролизной ячейки: катоду и аноду. На катоде идет восстановление ионов Zn 2+ из раствора до металлического состояния. На аноде электрическая энергия расходуется на анодные реакции. При электролитическом рафинировании металлов на аноде происходит полезный процесс — растворение чернового металла. В случае же электролиза цинка анод растворять нельзя, так как металл анода или примеси, растворяясь, загрязнит раствор, а затем и цинковый катодный осадок. Полезных анодных реакций при электроосаждении цинка из раствора практически нет. Следовательно, при реализации электролитического восстановления цинка из раствора необходимо, чтобы продукты анодного процесса не загрязняли электролит, а сам процесс шел с минимальным расходом энергии; кроме того, выделяющиеся на аноде вещества не должны быть токсичными, В наибольшей степени этим требованиям удовлетворяет процесс анодного разложения воды с образованием газообразного кислорода:
Коррозия меди в 5М изопропанольных растворах НС
... электролит - раствор сульфата меди с серной кислотой и добавкой сульфата натрия. В электролизер помещают аноды из пирометаллургически полученной меди и катоды из чистой меди. При пропускании тока ... свойстве основан пиролитический способ получения меди. В ряду напряжений металлов медь стоит после водорода. ... O 2 + H 2 O Коррозионное и электрохимическое поведение меди. В атмосферных условиях в отличие от ...
![]() E0 =+1,229 В
E0 =+1,229 В
Правда, при этом все-таки образуется нежелательная примесь — ионы водорода, которые могут восстанавливаться на катоде вместе с цинком, снижая выход по току и выход по энергии.
Чтобы осуществить процесс (276), нужно изготовить анод из такого материала, который бы при анодной поляризации до 1,23 В (а с учетом перенапряжения кислорода- до 2 В) не окислялся и не растворялся в электролите.
Для сульфатного электролита анод может быть изготовлен из свинца, хотя ![]() В, что значительно электроотрицательнее
В, что значительно электроотрицательнее ![]() , и растворение свинца на аноде должно предшествовать разложению воды. Возможность применения свинцового анода объясняется следующим. В сульфатном растворе ионы Pb2+ связываются в труднорастворимый сульфат свинца PbSO4. Это облегчает ионизацию свинца, и на свинцовом аноде в сульфатной среде протекает электродный процесс
, и растворение свинца на аноде должно предшествовать разложению воды. Возможность применения свинцового анода объясняется следующим. В сульфатном растворе ионы Pb2+ связываются в труднорастворимый сульфат свинца PbSO4. Это облегчает ионизацию свинца, и на свинцовом аноде в сульфатной среде протекает электродный процесс
![]()
![]()
В прианодном слое быстро наступает предел растворимости сульфата свинца, и на поверхности анода выкристаллизовывается PbSO,}. Сульфат свинца обладает низкой электропроводностью, и для поддержания заданной скорости электролиза (плотности тока) приходится увеличивать анодную поляризацию.
При более высоком анодном потенциале свинец окисляется до диоксида PbO2, который откладывается в порах рыхлой пленки PbSO4 и закрывает их:
Pb + 2Н 2 O — 4еPbO2 + 4Н+
После этого растворение свинцового анода прекращается. Но так как PbO 2 обладает электронной проводимостью, то при дальнейшей поляризации анода может протекать процесс (276).
Однако выделение кислорода на PbO2 идет с большим перенапряжением, и процесс (276) протекает с необходимой скоростью (ia =500 — 600 А/м2 )| при анодном потенциале около 2 В. Образование тончайшей пленки PbO2 , предохраняющей анод от дальнейшего растворения, происходит быстро, но формирование устойчивой пленки длится не менее 24 ч.
Для повышения химической устойчивости и механической прочности анода в его состав вводят серебро (0,75 — 1 %).
Свинцовосеребряные аноды меньше разрушаются в ходе электролиза и срок службы их больше. Они дают меньше взвесей PbO 2 и позволяют получать цинк с меньшим содержанием свинца.
Катодный процесс восстановления цинка из его кислого сульфатного раствора оказывается возможным потому, что выделение водорода на цинке сопровождается очень высоким перенапряжением (не менее 0,7 В).
На катоде происходит следующие две основные и конкурирующие электродные реакции:
2+ + 2eZn; ![]() ;
;
Н + aq + 1е 0,5Н2 ; ![]() .
.
Электрический ток в жидкостях (электролитах)
... проводят электрический ток, называются неэлектролитами. Электролитическая диссоциация , Процесс распада электролита на ионы называется электролитической диссоциацией. С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах ...
На электродах в первую очередь реализуются менее энергоемкие процессы, поэтому на катоде сначала восстанавливаются более электроположительные элементы.
Перенапряжение (Dj) зависит от условий образования на поверхности катода новой фазы. Так, если кристаллизация металла на металле — малоэнергоемкий процесс и требует перенапряжения порядка нескольких сотых вольта, то образование молекулы водорода на металлическом катоде — весьма энергоемкий процесс, который требует отрицательной поляризации электрода в несколько десятых вольта.
Перенапряжение водорода на цинке зависит от ряда факторов: катодной плотности тока, температуры электролита, содержания примесей и поверхностно-активных добавок, состояния катодной поверхности и др.
Зависимость перенапряжения водорода на цинке от катодной плотности тока при 25 °С выражают уравнением:
- Dj = 0,77 + 0,118 lg i k
где i k — катодная плотность тока, А/м2 .
Повышение плотности тока обусловливает увеличение перенапряжения водорода. Однако разогрев электролита, вызванный повышением плотности тока, уменьшает перенапряжение водорода. В интервале температур 20 — 80 °С зависимость Dj от температуры приближенно можно выразить уравнением:
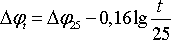
где t — температура электролита, °С; Dj t и Dj25 — перенапряжение водорода на цинке соответственно при температуре электролита и при 25 °С.
В слабокислых растворах (<0,1 н. H 2 SO4 ) перенапряжение водорода практически не зависит от концентрации H2 SO4 , но в более кислых растворах перенапряжение водорода снижается с повышением концентрации серной кислоты.
Влияние перечисленных факторов на перенапряжение восстановления ионов Zn 2+ на цинковом катоде сказывается в значительно меньшей степени, чем на перенапряжение восстановления ионов Н+ . Поэтому характер зависимости выхода по току от различных факторов при электроосаждении цинка идентичен подобной зависимости для перенапряжения водорода. Так, зависимость выхода по току от плотности тока, температуры электролита и концентрации серной кислоты согласуется с влиянием этих факторов на перенапряжение водорода.
Снижение концентрации в электролите цинка в соответствии с уравнением обусловит увеличение поляризации цинкового катода, что закономерно ухудшит выход по току.
Если рассматривать процесс электролиза раствора сульфата цинка в целом, то электроэнергия в электролитической ячейке расходуется на осуществление следующих суммарных электрохимических процессов:
ZnSO 4 + H2 O Zn + H2 SO4 + 0,5O2 ;
H 2 O H2 + 0,5О2 .
Уравнение описывает основной процесс — электроосаждение цинка из раствора сульфата цинка, а уравнение — побочный процесс разложения воды, сопровождающийся выделением водорода на катоде и снижающий выход по току. Кроме этих процессов, электроэнергия тратится на перемещение ионов в электролите: катионов — к катоду, анионов — к аноду.
На электроосаждение цинка приходится около 70 % электроэнергии, в том числе на восстановление ионов до металла около 21,5 %; на разложение воды до газообразного водорода и кислорода 7- 8 %; на преодоление сопротивления электролита переносу ионов к электродам примерно 15 %.
Электрический ток в жидкостях, газах и плазме
... дырочной проводимостью. Плазма, под которой понимается газ, имеющий концентрацию зарядоносителей, намного превышающую незаряженных частиц, обладает электронной и ионной проводимостью. ТОК В ЖИДКОСТЯХ Происхождение электрического тока (движение электрических зарядов) через раствор существенно отличается ...
Если рассматривать затраты электроэнергии только на катоде, то примерно 90 % их можно отнести к основному процессу — восстановлению ионов Zn 2+ , а около 10 % — к побочному процессу — восстановлению ионов Н+ (выход по току — 90%).
Большую роль в процессе электроосаждения играют примеси. По электрохимическим свойствам примеси можно разделить на четыре группы: группа — катионы, более положительные, чем цинк; группа — катионы, более отрицательные, чем цинк; группа — анионы;группа — органические примеси.
Катионы, более положительные, чем цинк действуют следующим образом. Металлы-примеси разряжаются на катоде, образуя участки с повышенным перенапряжением водорода, на которых ионы водорода разряжаются от внешнего источника тока и вследствие работы короткозамкнутых гальванических элементов. Степень осаждения примеси на цинковом катоде зависит в основном от потенциала ее разряда, концентрации в растворе и скорости диффузии. Катионы, более отрицательные, чем цинк — магний, натрий, калий, марганец — не очень влияют на электроосаждение цинка, так как эти примеси не разряжаются на катоде и не загрязняют цинк, но накопление таких катионов ведет к повышению вязкости и удельного сопротивления электролита, вследствие чего увеличивается напряжение на ванне и возрастает расход электроэнергии при электролитическом выделении цинка.
Органические примеси можно разделит на 2 группы: 1)Примеси, переходящие в электролит из деревянной аппаратуры, фильтровальной ткани, смазочных материалов , сырья и реагентов , и 2) поверхностно активные и коллоидные добавки.
Органические примеси первой группы отрицательно влияют на процесс электролиза, присутствие их в электролите снижает их выход по току и приводит к получению хрупких катодных осадков цинка.
4.2 Основные показатели процесса электролиза
Выход по току при электролитическом осаждении цинка характеризует эффективность использования электрического тока в процессе катодного восстановления цинка. Определяют выход по току как долю электрического тока, затраченного на осаждение цинка, от количества прошедшего через катод электричества:
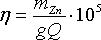 ,
,
где η — выход по току, %; m Z n — масса цинка, осажденного на ванне или серии ванн, кг; Q — количество электричества, затраченного на электролиз на ванне или серии ванн за тот же период времени, А·ч; g — электрохимический эквивалент цинка [g = l,22 г/(А·ч)].
Выход по току при электроосаждении цинка зависит от концентрации цинка и серной кислоты в электролите, плотности тока, температуры, загрязненности электролита примесями и состояния катодной поверхности.
Повышение концентрации цинка в электролите при постоянной концентрации H2SO4 повышает эффективность использования электрического тока. Напротив, обеднение электролита цинком в ходе электролиза приводит к снижению выхода по току, которое становится особенно ощутимым при концентрации цинка ниже 50 г/л. Повышение концентрации серной кислоты и ходе электролиза обусловит снижение выхода по току за счет интенсификации реакции выделения водорода. Увеличение катодной плотности тока повышает выход по току, несколько компенсируя влияние возрастания кислотности электролита.
Эффективность использования электроэнергии в процессе электролитического осаждения цинка оценивают по расходу электроэнергии на 1 кг катодного цинка, который вычисляют по уравнению
![]() ,
,
где W — удельный расход электроэнергии, кВт-ч/кг; U — напряжение на ванне, В; η — выход по току, %; g — электрохимический эквивалент цинка [g=l,22 г/(А·ч)].
Повысить эффективность использования электроэнергии, т. е. уменьшить удельный расход энергии, можно пустей снижения напряжения на ванне и увеличения выхода по току.
Напряжение на ванне складывается из
![]()
где Е а и Ек — электродный потенциал анода и катода, В; Djа и Djк — анодная и катодная поляризация, В; DUэл — потеря напряжения в электролите, В; DUш — потеря напряжения в шламовой корке, В; DUкон — падение напряжения в металлических проводниках и контактах, В;
- Примерное соотношение составляющих напряжения на ванне в производственных условиях следующее, %: электродные потенциалы и поляризация электродов 75 — 77;
- падение напряжения в электролите 15 — 17;
- в шламе на аноде 1 — 5, в контактах 1 — 2, в катодных штангах 0,5 — 4, в анодных штангах 0,5 — 0,6. Как следует из приведенных данных, на напряжение на ванне существенно влияет падение напряжения в электролите, которое зависит от плотности тока, расстояния между анодом и катодом и удельного сопротивления электролита.
Сближение электродов обеспечивает снижение напряжения на ванне и удельного расхода электроэнергии. Поэтому расстояние между электродами стремятся поддерживать минимальным. В настоящее время в зависимости от конструкции ванны и условий электролиза расстояние между осями одноименных электродов составляет 55 — 70 мм.
Повышение плотности тока положительно влияет на выход по току, но напряжение на ванне при этом увеличивается.
Характер зависимости удельного расхода электроэнергии от плотности тока во многом определяется величиной концентрации в электролите серной кислоты. Наименьшее значение удельного расхода электроэнергии наблюдается при концентрации H 2 SO4 120 — 140 г/л. При меньшей кислотности электролита удельный расход электроэнергии резко возрастает с повышением плотности тока, и минимальные значения W достигаются только при низких плотностях тока.
Повышение температуры электролита приводит к уменьшению U и η. Но если U изменяется монотонно, то зависимость η от t имеет четко выраженный максимум при 36 — 38°С. В этом интервале температур наблюдается минимум W.
Таким образом, для применяемых в мировой практике плотностей тока i = 400 — 700 А/м 2 оптимальная температура электролита составляет 35 — 38°С.
Однако влияние температуры электролита на электроосаждение цинка нельзя рассматривать только с точки зрения возможности снижения расхода электроэнергии. От температуры электролита зависит чистота катодного осадка, срок эксплуатации свинцовых анодов и алюминиевых катодов.
С повышением температуры возрастает скорость коррозионного разрушения электродов, усиливается отрицательное влияние примесей в электролите на катодное восстановление цинка, ослабляется действие поверхностно-активных добавок и пенообразующих веществ, ухудшаются условия труда в цехе и т. п. С этих позиций разогрев электролита в процессе электролиза нельзя допускать выше 35 — 40°С. [1],[5]
4.3 Конструкция ванн и электродов
Ванны для электролиза цинка изготовляют из дерева (Рисунок 4) или железобетона (Рисунок 3).
Железобетонные ванны дороже и сложнее в изготовлении, чем деревянные. Но меньшая утечка тока, пожаростойкость, длительный срок службы (от 4 до 8 лет) обеспечивают им предпочтение.
Внутренние стенки ванны футеруют рольным свинцом, полихлорвинилом или листовым винипластом. Сначала внутреннюю поверхность стенок и днища ванны оклеивают рубероидом на битуме в два слоя, а затем вставляют винипластовый вкладыш толщиной 8 мм. Из винипласта делают также и обортовку ванн и сливные пробки.
Винипластовая футеровка, в отличие от свинца, исключает возможность замыкания на корпус, но трудоемкость изготовления и растрескивание при эксплуатации снижают ее достоинства. Лучше себя зарекомендовала футеровка из полихлорвинила. Снаружи ванну окрашивают кислотоупорной краской или битумом.
Корпус ванны устанавливают на железобетонную раму, покоящуюся на столбах высотой 2 м. Ванна опирается на четыре изолятора из стекла или фарфора.
Для отвода раствора ванны снабжены сливными носиками, изготовленными из винипласта или свинца.
Днище ванны имеет отверстие для аварийного стока электролита и смыва шлама.
В ванну внутренними размерами (2,08-2,18)х(0,86-0,91)х(l,45-l,50) мм устанавливают 28 — 32 катода и 29 — 33 анода. Ванна рассчитана на I=15-20 кА. Число катодов и анодов зависит от размера ванны и от расстояния между электродами. Расстояние между осями одноименных электродов на отечественных заводах принято 58 — 60 мм, на большинстве зарубежных заводов 70 — 80 мм.
Аноды отливают из свинца чистотой 99,99 % с добавкой 1 % серебра. Поверхность анода выполняют гладкой или рифленой. Прокатанные аноды толщиной 5 мм в 2 — 3 раза жестче, чем литые толщиной 8 мм, а срок службы их в 2 раза больше.
Анодные штанги делают из медной освинцованной шины и приваривают к анодному полотну водородной сваркой. На края анодов укрепляют ограничители из дерева, прессованного стекла или винипласта. Эти ограничители упираются в края катода, фиксируют положение электродов, предупреждая короткие замыкания, улучшают условия циркуляции электролита.
Катоды изготовляют из холоднокатаного алюминиевого листа толщиной 3 — 4 мм. Для уменьшения дендритообразования на краях катоды делают на 20 — 25 мм шире и длиннее анодов. На края катодов для предупреждения осаждения на них цинка надевают деревянные или резиновые рейки. Катодный лист приваривают к алюминиевой штанге, на одном конце которой прикрепляют или приваривают медный контакт.
Ванны располагают в здании цеха рядами по 20 — 30 ванн. Между рядами ванн имеются проходы для обслуживания.
Приняты две основные схемы компоновки и ошиновки ванн. Схема I предусматривает стыковку ванн длинными торцами. В этом случае ток подводится к двум крайним (головным) ваннам ряда. Внутри ряда от ванны к ванне ток передается через промежуточные ходам. Кроме того, при выемке катодов для сдирки цинка контакты загрязняются стекающим с катодов электролитом. По схеме II ванны компонуют сдвоенными рядами. По внешним бортам сдвоенных ванн проложены токоведущие шины, на которые опираются аноды одной ванны и катоды другой. На средней разделительной стенке уложена промежуточная шина, на которую также опираются контактные концы анодов одной ванны и катодов другой. Схема II удобна для обслуживания каждой ячейки всех ванн с проходов, позволяет механизировать выемку и транспортировку катодов и анодов. Вынос контактов легкие шины, уложенные на длинных сторонах ванн. Контакт осуществляют постановкой штанг анодов и катодов на шину или друг на друга.
Схема I по, сравнению со схемой II требует меньшего расхода меди для токонесущих шин, но создает неудобства в обслуживании ванн, обращенных торцами к про
за габариты ряда предотвращает смачивание контактов электролитом, стекающим с катодов при их транспортировке вдоль ряда.
Для вновь построенных в последнее время предприятий принимают схему II.[1],[5]
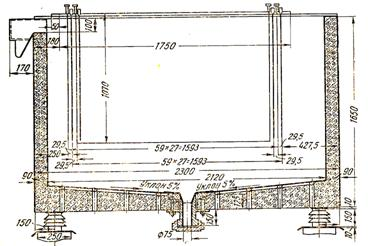
Рисунок 3 Ванна из железобетона для электролитического осаждения цинка
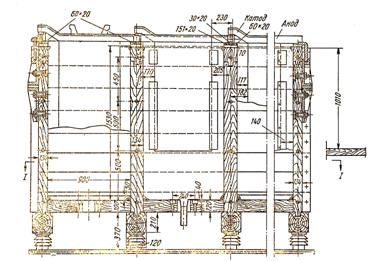
Рисунок 4 Продольный разрез блока деревянных ванн для электроосаждения цинка
4.4 Циркуляция и охлаждение электролита
В процессе электролиза раствора сульфата цинка выделяется значительное количество тепла. При катодной плотности тока 600 А/м2 и осаждении из 1 л раствора 100 г цинка выделившееся тепло может повысить температуру электролита на 70°С.
Охлаждение цинкового электролита вне ванн (централизованное) или непосредственно в ваннах (индивидуальное) позволяет поддерживать его температуру в допустимых пределах. В настоящее время на всех заводах она составляет 33 — 38° С.
Охлаждение непосредственно в ванне позволяет непрерывно отводить тепло и иметь скорость циркуляции электролита, соответствующую осаждению из 1 л раствора 100 г цинка («однократная циркуляция»).
Централизованное охлаждение требует многократной циркуляции электролита в системе ванна-охладитель. Кратность циркуляции определяется перепадом температуры
в холодильной установке (при перепаде температуры 20°С требуется пятикратная циркуляция, при перепаде 10°С — двадцатикратная).
Для приближенного определения оптимальной кратности циркуляции электролита можно воспользоваться следующим соотношением:
n = i к /100, (304)
где n — кратность циркуляции (отношение фактической скорости циркуляции электролита к скорости «однократной циркуляции»); i к — катодная плотность тока, А/м2 .
По способу циркуляции электролита цинковые заводы можно разделить на три группы. На заводах первой группы ванны располагают каскадом, перелив каждой ванны идет в следующую. Слив последней ванны каскада представляет собой отработанный электролит, направляемый на выщелачивание. Нейтральный раствор подают во все ванны каскада. Скорость циркуляции электролита в верхних ваннах минимальна и возрастает к концу каскада.
На заводах второй группы ванны располагают на одном уровне, и нейтральный раствор подают в каждую ванну индивидуально. С каждой ванны получают отработанный электролит. В обоих случаях охлаждение электролита осуществляют змеевиками, установленными в ваннах.
На заводах третьей группы ванны располагают на одном уровне, а электролит циркулирует через ванны и охладительную установку многократно. Такую систему циркуляции применяют в том случае, когда при электролизе выделяется тепла больше, чем можно отвести через змеевики в электролизных ваннах.
Выбор системы циркуляции зависит от режима электролиза. При плотности тока 400 — 550 А/м 2 достаточно однократного прохождения раствора через ванны. Если в ванны подают охлажденный нейтральный раствор, то охлаждение электролита можно обеспечить с помощью змеевиков в ваннах в сочетании с централизованным охлаждением или без него. При плотности тока 700 — 1000 А/м2 приходится прибегать к централизованному охлаждению и интенсивной и многократной циркуляции электролита через ванны.
Охлаждающие змеевики изготовляют из свинцовых или алюминиевых труб и устанавливают в ванне у одного из коротких торцов. Алюминиевые змеевики эффективнее свинцовых, но требуют очистки электролита от фторид-иона (35 — 50 мг/л) и хлорид-иона (200 — 250 мг/л).
Змеевики обрастают снаружи сульфатом цинка и шламом, а внутри них откладывается соль. Поэтому теплопроводность их уменьшается со временем. В связи с этим змеевики периодически вынимают из ванн и очищают.
Охлаждающую воду подводят и отводят от змеевика через резиновые шланги во избежание утечки тока. Так как для производства 1 т катодного цинка расходуется до 550 м 3 воды, то часто возникает необходимость применения вакуумно-испарительного охлаждения. В вакуум-испарительной установке раствор охлаждается за счет интенсивного испарения воды при пониженном давлении. Разрежение в испарителе обеспечивают с помощью пароструйных эжекторов. В сопло эжектора подают водяной пар со скоростью 750 — 1000 м/с. При этом газовая фаза из испарителя увлекается и отводится в конденсатор.
«Горячий» электролит засасывается в испаритель первой ступени, где поддерживается остаточное давление 5,3 кПа. За счет испарения воды температура электролита снижается до 34°С. Далее электролит поступает в испаритель второй ступени (остаточное давление 4 кПа), где охлаждается до 29°С. В третьей ступени (остаточное давление 2,7 кПа) электролит охлаждается до 25 — 26°С и направляется на циркуляцию.
При централизованной системе охлаждения электролита весь цех электролиза работает практически как одна ванна и вся регулировка параметров процесса (температуры, кислотности, содержания цинка в растворе) осуществляется с одного пульта. Кроме того, высокие скорости циркуляции электролита в ваннах при централизованной системе охлаждения способствуют улучшению технологических и экономических показателей электроосаждения цинка.
Внутри ванны электролит перемешивается благодаря перепаду температур по высоте ванны, изменению плотности раствора и выделению газообразного кислорода и водорода в ходе электролиза. Перемешиванию электролита в межэлектродном пространстве способствуют ограничители-изоляторы на анодах, которые, соприкасаясь с ограничительными рейками на катодах, образуют между электродами замкнутое пространство, открытое сверху и снизу.
Электролит, заполняющий пространство между электродами, нагревается за счет выделения джоулева тепла и теплоты экзотермических электродных реакций, плотность его становится меньше, чем у остального электролита. Плотность электролита в межэлектродном пространстве снижается также за счет интенсивного газовыделения на электродах. Нагретый и газонасыщенный электролит вытесняется более плотным и холодным. При этом образуется восходящий поток. 1 — Вблизи поверхности электролит движется к краям 1 ванны, постепенно освобождаясь от газа и смешиваясь с более холодным электролитом. В пространстве между краями электродов и стенкой ванны плотность электролита больше, чем между электродами, и он опускается На дно ванны. Возникает довольно интенсивная круговая циркуляция электролита в каждом межэлектродном пространстве, способствующая выравниванию концентрации цинка и серной кислоты. Изменение концентрации цинка и серной кислоты по высоте ячейки от 1 Нижнего края электродов до поверхности незначительно. По длине ванны концентрация цинка постепенно уменьшается, а концентрация серной кислоты возрастает. Разница концентраций в начале и конце ванны сокращается при увеличении кратности циркуляции электролита.[1]
4.5 Обслуживание процесса электролиза
О ходе процесса электроосаждения судят по составу и температуре электролита. Концентрацию в электролите цинка контролируют по плотности раствора, определяемой с помощью ареометра. Концентрацию кислоты определяют методом измерения удельного сопротивления электролита или рассчитывают по разности концентрации цинка в нейтральном и отработанном электролите.
Один раз в сутки катоды вынимают из ванн с помощью подъемников и на специальных площадках производят сдирку катодного осадка с алюминиевой матрицы. Для этого рабочий ударом зубила, направленного под осадок в верхней части катода, отделяет металл и сдирает его, площадки для сдирки катодного осадка лучше оборудовать в торце цеха, куда катоды доставляют тельфером. Однако на многих заводах сдирку производят рядом с ваннами на столах или на площадках, передвигающихся над ваннами по монорельсам.
Одновременно вынимают из ванны 5 — 10 катодов, а на место вынутых ставят новые, либо во время сдирки осадков ванна работает на повышенной плотности тока.
Снятый с катодов цинк складывают на электрокару и отвозят в плавильное отделение, а алюминиевые катоды после осмотра и зачистки контактов вновь завешивают в ванны.
Иногда съем цинка бывает затруднен в результате резкого возрастания сцепления осадков с алюминиевыми матрицами. Возникновение «трудной сдирки» объясняется нарушением пленки оксида алюминия на поверхности матрицы в результате коррозии или механического повреждения. Основной причиной явления «трудной сдирки» считают накопление в растворе фторид-иона выше критической для данного процесса концентрации. В ряде случаев затруднения со сдиркой начинаются при содержании фторид-иона в электролите свыше 30 мг/л.
Для предупреждения «трудной сдирки» алюминиевые матрицы перед установкой в ванны выдерживают несколько минут в отработанном электролите. На отечественных заводах для облегчения сдирки вводят в ванну растворимую соль сурьмы. Концентрация сурьмы 0,2 — 0,3 мг/л в электролите в момент образования первого слоя цинка на алюминиевой матрице обеспечивает получение прилегающего к матрице слоя катодного цинка со структурой кристаллов, не плотно сцепленных с матрицей.
В настоящее время на цинкэлектролитных заводах начинают применять механическую сдирку катодов на катодосдирочных машинах.
Очистку ванн и анодов от шлама производят периодически в зависимости от содержания в электролите марганца, плотности тока и состояния поверхности анодов. На большинстве заводов ее производят через 20 — 30 дней. Для откачки шлама вынимают катоды и отключают ванну. При непрерывном перемешивании электролита сжатым воздухом откачивают пульпу кислотостойким насосом. Откачка идет 4 — 8 мин. В некоторых случаях пульпу выпускают из ванны через донный штуцер в сборный зумпф. Шламовую пульпу перекачивают на выщелачивание огарка, используя его в качестве окислителя железа.[1]
4.6 Интенсификация электролиза цинка
Производительность цинкового завода по готовой продукции пропорциональна произведению плотности тока на выход по току: i к η. Поэтому интенсификация электролитического осаждения цинка сопряжена с увеличением плотности тока в ячейке. При этом в центре внимания остается катодная плотность тока, так как от нее зависят качество катодного цинка и условия электролиза. Однако повышение катодной плотности тока, а также производительности завода неизбежно сопровождается увеличением эксплуатационных затрат на производство цинка и себестоимости производства 1 т чушкового цинка. Повышение катодной плотности тока при электролизе выгодно до тех пор, пока, несмотря на увеличение себестоимости, общая прибыль и другие экономические показатели завода возрастают.
Оптимальное условие электроосаждения цинка может быть выражено формулой S/(i к η)àmin,
Для каждого завода с учетом местных условий зависимость S от i к имеет минимум при оптимальном значении катодной плотности тока, которое для разных заводов может не совпадать.
Расчетная экономическая плотность тока составляет 700-800 А/м 2 . Отечественные заводы постепенно интенсифицируют электроосаждение цинка, повышая плотность тока. В настоящее время iк = 550-7-650 А/м2 .
Значительное повышение плотности тока против оптимального значения (700-800 А/м 2 ) потребует увеличения токоподводящих шин, контактов электродов, что сопряжено с реконструкцией системы электроснабжения. Поэтому производительность электролизеров стремятся повысить еще и за счет повышения выхода по току. Это достигают более тщательной очисткой электролита от примесей, улучшением системы охлаждения электролита, применением реверсивного или прерывистого электрического тока. В обычных условиях электроосаждения цинка наращивание катодного осадка происходит при постоянном токе, неизменном как по величине, так и по направлению. При этом скачок потенциала между цинковым катодом и раствором, обусловливающий электроосаждение цинка, равен сумме равновесного потенциала цинкового электрода (jZn ) и перенапряжения выделения цинка (Djк <0), соответствующего заданной плотности тока (iк ):
jк =j Zn +Djк .
В случае электролиза на прерывистом токе, периодически на короткое время ванну отключают от питания электрическим током. На рис. 99, б показана схема изменения тока, проходящего через катод, и потенциала катода. При отключенном токе цинковый катод и электролит образуют гальванический элемент, в котором цинковый электрод становится анодом, а водородный электрод — катодом: Zn|ZnSO4||H2SO4|H2. ЭДС этого короткозамкнутого гальванического элемента обусловит протекание в системе катод — раствор электрического тока, сопровождающегося растворением цинка и выделением водорода:
E=j H 2 — jZn
ЭДС максимальна в начальный момент, когда ток растворения цинка близок к нулю. По мере возрастания тока э. д. с. уменьшается. В случае электролиза на реверсивном токе периодически на короткое время переключают полярность электродов в ванне. Какую-то часть времени (1/30- 1/200) свинцовый анод функционирует как катод, а цинковый катод — как анод. Скачок потенциала между цинковым анодом и электролитом при этом равен сумме равновесного электродного потенциала цинка в.растворе данного состава (фгп) и перенапряжения анодного растворения цинка (Dj а >0) при заданной плотности тока:
j а = jZn +Djа .
Таким образом, как в случае с реверсированием тока, так и в случае его прерывания, цинковый катод подвергается периодически электрохимическому растворению. Так как в первую очередь растворяются Активные участки поверхности и дендриты, то устраняются условия для роста уже образовавшихся центров кристаллизации и возникают новые центры кристаллизации. В результате катодный осадок приобретает мелкокристаллическую структуру, становится плотным и гладким. Возрастает истинная плотность тока на катоде и повышается выход по току. Это позволяет увеличить продолжительность наращивания осадка, сократить число операций сдирки.
При двух — шести переключениях тока в минуту замена постоянного тока реверсивным позволяет на 25 — 30 % интенсифицировать электроосаждение цинка. Однако при этом существенно возрастает удельный расход электроэнергии (в анодный период электроэнергия на катоде расходуется не для осаждения цинка, а для его растворения).
Чередование при реверсивном токе катодной активации и анодной пассивации свинцового анода приводит к повышенному коррозионному разрушению анодов и, как следствие, к увеличению загрязнения катодного осадка свинцом и другими примесями. Возникают особые требования к чистоте электролита и электродов. В связи с этим представляет интерес электроосаждение цинка прерывистым током, при котором на аноде в период бестоковой паузы не происходят никакие электрохимические реакции.
Электролиз с применением прерывистого тока был испытан в полупромышленных условиях на Лениногорском цинковом заводе. Испытания показали, что катодные осадки цинка получаются мелкокристаллическими с очень гладкой поверхностью, благодаря чему при электролизе поддерживается высокая истинная плотность тока. Последнее повышает перенапряжение выделения водорода и уменьшает коррозию на катоде цинка, в результате чего выход цинка по току возрастает. Одновременно за счет уменьшения среднего значения анодного потенциала снижаются напряжение на ванне и расход электроэнергии.
Результаты испытаний свидетельствуют о перспективности интенсификации электролиза цинка с применением прерывистого тока .[1], [5]
5. Практическая часть
Производительность электролизного цеха 180000 т чушкового цинка в год, число рабочих дней в году 365, среднее число рабочих часов для электролизной ванны 23,5 (коэффициент машинного времени ванны 98%), выход цинка по току 93%, угар и переход в дросс при переплавке катодного металла 4%. На приготовление цинковой пыли, используемой для очистки растворов, расходуется 5% чушкового цинка. Катодная плотность тока 600 А/м 2 . Состав отработанного электролита, г/л: 50 Zn; 150 H2 SO4 . Температура электролита 35 ºС, температура окружающей среды в цехе 25 ºС, температура наружных стен ванны 30 ºС.
Определение размеров и числа электродов в ванне, силы тока на ванне и количества ванн в цехе
Зная суммарную величину потерь цинка и количество металла, затрачиваемое на изготовление цинковой пыли, находим, что общее количество катодного цинка должно быть на 4+5=9 % больше количества чушкового металла. Тогда годовая производительность цеха по катодному цинку составит, т/год:
·1,09=196200,
а суточная, т/сут:
:365=537,5
Суммарная поверхность катодов в цехе определяем по уравнению
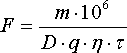 ,
,
где m — суточная производительность цеха по катодному цинку, т; D — катодная плотность тока, А/м 2 ; q — электрохимический эквивалент цинка, q=1,219 г/(А·ч); η — выход цинка по току, η=0,93; τ — продолжительность работы ванны в сут/ч.
Подставляя известные данные в уравнение, будем иметь, м 2 :
F=537,5·10 6 :(600·1,219·0,93·23,5)=3,73·104 м2 .
Определим размеры катода. Катоды изготавливают из алюминиевого листа размером 1000x666x6 мм. На края катода помещают резиновые рейки для уменьшения дендритообразования и облегчения съема осадка цинка. Рейки уменьшают рабочую ширину катода на 10 мм с каждой стороны. При коэффициенте заполнения ванны электролитом, равном 0,85 — 0,90, катод погружается на глубину 0,86 м, тогда рабочая поверхность одного катода (с двух сторон), м 2 :
f к = 0,86·0,646·2=1,11.
Общее число катодов в цехе равно, шт.:
,73·10 4 :1,11=33661 (округленно 33660 шт.)
На основании опыта работы отечественных и зарубежных цинковых заводов принимаем силу тока на электролизной ванне равной 16000 А. Тогда суммарную рабочую поверхность катодов в одной ванне определим из соотношения, м 2 :
f=J:D=16000:600=26,6
Зная суммарную поверхность катодов в ванне и поверхность одного электрода, находим число катодов в ванне, шт.:
n к =f:fк =26,6:1,11=24.
Определяем число анодов, шт.:
n а =nк +1=24+1=25.
Находим число постоянно работающих ванн в цехе, шт:
N р =33660:24=1403.
Так как часть ванн постоянно находится на ремонте и на очистке от шлама, то общее число ванн в цехе должно быть увеличено с учетом резерва. Принимая амортизационный период ванны 10 лет, находим общее число ванн в цехе, шт:
Nобщ=1403·(1+1:10)=1543,
или округленно, с учетом удобства расположения ванн в цехе, 1544.
Определение линейных размеров электролизной ванны
Внутреннюю длину ванны можно рассчитать по формуле:
![]() ,
,
Где n a — количество анодов в ванне; δa — толщина анода, δa =8 мм; nк — число катодов в ванне; δк — толщина катода, δк =6 мм; l — расстояния от крайних анодов до торцевых стенок ванны, обычно k1 =k2 =200 мм.
Подставляя известные величины, будем иметь, мм:
L=25·8+24·6+2·24+200+200=1848.
Внутреннюю высоту ванны определим по уравнению
H=h к +δ,
Где h к — высота катода, мм; δ — расстояние от нижней кромки катода до дна ванны, δ=400 мм.
H=1000+400=1400 мм.
Внешние размеры ванны находим путем сложения соответствующего внутреннего размера с толщиной стенок или дна. Принимаем толщину торцевых стенок δ т =90 мм, боковых стенок δб =120 мм и дна δд =100 мм. Тогда внешняя длина ванны составит, мм
L=L+2δ т =1848=2·90=2028.
Внешняя ширина ванны составит, мм:
В=В+2δ б =870+2·120=1110.
Внешняя высота ванны составит, мм:
H=H+δ д =1400+100=1500.
Определяем внутренний объем ванны, м 3 :
V=L·B·H=1848·870·1400=2250864000 мм 3 =2,25.
Ванна заполняется электролитом примерно на 85 — 90% своего внутреннего объема. Следовательно, объем ванны, заполненный электродами и электролитом, составит, м 3 :
V=0,9·V=0,9·2,25=2,025.
Определение состава нейтрального электролита и скорости подачи нейтрального раствора в ванну
Во время электролиза расходуется сернокислый цинк, а в электролите образуется эквивалентное количество серной кислоты. Следовательно, зная содержание цинка и серной кислоты в отработанном электролите, можно найти концентрацию цинка в нейтральном растворе по уравнению
(C Zn )нейтр =(CZn )отр +(СH 2 SO 4 )отр· 65,4:98.
Так как (C Zn )отр =50г/л, а (СH 2 SO 4 )отр =150 г/л, то
(C Zn )нейтр =50+150·65,4:98=150г/л.
Количество нейтрального раствора, подаваемого в ванну в течение одного часа определим по уравнению, л/ч
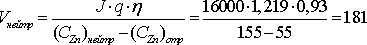 .исп
.исп
На все работающие ванны цеха (1403 шт) необходимо подавать в течение одного часа нейтрального раствора в количестве, м 3 /ч:
·1403=253943 л/ч=254.
В сутки требуется нейтрального электролита, м 3 /сут:
Расчет электрического баланса ванны
Определение величины напряжения на электролизной ванне.
Напряжение на ванне Uв описывается уравнением
Uв=jр(а)- jр(к)+( Djа-Djк)+D·r·l+J·r,
где jр(а) и jр(к) — равновесные потенциалы анода и катода, В;
- Djа и Djк — анодная и катодная поляризация, В;
- D — катодная плотность тока, А/см2;
- r — удельное сопротивление электролита, Ом·см;
- l — расстояние между катодом и анодом, см;
- r — суммарное падение напряжения в контактах, шламе, шинах и электродах, В.
Определение величины равновесного потенциала анода и анодной поляризации. При электролизе на свинцовом аноде выделяется кислород, равновесный потенциал этого процесса будет описываться уравнением Нернста:
![]() ,
,
где jо2=0,411 В; R=8,315 Дж; Т=273+35=308 К; F=96500 Кл.
Рассчитаем активность гидроксил ионов в электролите, содержащем 150 г/ серной кислоты и 50 г/л цинка.
Концентрация ионов водорода в таком растворе составляет Cн=150·2:98,05=3,06 г-ион/л, а концентрация гидроксил-ионов — Сон=Kw:Сн, где Kw — ионное произведение воды при 35 ºС, Kw=3·10-14 г-ион/л.
Тогда Сон=3·10-14:3,06=0,9810-14 г-ион/л.
Коэффициент активности гидроксил ионов в указанном растворе равен 0,75. Тогда равновесный потенциал кислородного электрода (анода) составит, В:
jр(а)=0,411-2,303·8,315·308:96500·lg(0,75·0,98·10-14)=1,273.
Величина анодной поляризации Djа при плотности тока 600 А/м2 составляет 0,75 В. Следовательно, потенциал анода под током, В:
jа=jр(а)+ Djа=1,273+0,75=2,023.
Определение величины равновесного потенциала катода и катодной поляризации. При электролизе алюминиевый катод покрыт слоем цинка, поэтому равновесный потенциал катода равен равновесному потенциалу цинкового электрода в электролите указанного состава при температуре 35 ºС:
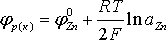 .
.
Концентрация ионов цинка в электролите, содержащем 50г/л цинка и 150 г/л серной кислоты, составит, г-моль/л:
C Zn =50:65,37=0,764.
Коэффициент активности ионов цинка в указанном растворе составит 0,5. Тогда равновесный потенциал цинкового электрода (катода), В:
j р(к) =-0,763+2,303·8,315·308:(2·96500)·lg(0,5·0,764)=-0,775.
Учитывая, что катодная поляризация цинкового электрода имеет небольшую величину (Dj к =0,01-0,02 В), потенциал катода под током составит, В:
j к =jр(к) — Djк =-0,775·0,02=-0,795.
Напряжение разложения Е нр сернокислого цинка составит, В:
Е НР j р(а)- j р(к) =1,273+0,775=2,048,
а разность потенциалов анода и катода под током, В:
j а -jк =2,023+0,759=2,818.
Определение удельного сопротивления электролита.
Электролит такого состава при температуре 35 ºС имеет удельное сопротивление ρ=2,32 Ом-см
По методу Скворовского учтем влияние содержащихся в электролите примесей марганца и магния на удельное сопротивление раствора. Примем, что влияние марганца аналогично влиянию железа, а для магния будем считать, что 1 г/л магния повышает процентное сопротивление раствора на 2,1 %. Поправка на марганец П Mn =100+2,1·5=110,5 %.
Удельное сопротивление электролита с учетом указанных поправок составит, Ом·см:
ρ=2,32·108·110,5:(100·100)=2,77.
Учитывая, что в электролите имеется также кремнекислота, кальций и соли щелочных металлов, увеличиваем удельное сопротивление на 20 %:
ρ=2,77·1,2=3,32 Ом·см.
Теперь рассчитаем падение напряжения в электролите по формуле, В:
DU эл =D·ρ·l=600·104 ·3,32·2,3=0,458.
Определение падения напряжения в шламе, в электродах, в контактных шинах. Падение напряжения в шламе (на аноде образуется шлам, состоящий из диоксида марганца) можно принять 30 % от падения напряжения в электролите, тогда DU шл =0,458·0,3=0,138 В. По данным практики, падение напряжения на аноде равно 0,02 В, в контактах — 0,03 В. Падение напряжения в катодных штангах составляет 0,02 В, в бортовых шинах — 0,03 В. Таким образом, суммарное падение напряжения в шламе, электродах, контактах и шинах составляет, В:
J·r=0,138+0,02+0,03+0,02+0,03=0,238.
Общее напряжение на ванне, В:
U в =jр(а) + Djа (jр(к) + Djк )+D·ρ·l+J·r=2,818+0,458+0,238=3,514.
Электрический баланс сведен в таблице *.1
Таблица 5.1 — Баланс напряжения на ванне электролиза цинка
|
Составляющие электрического баланса |
Количество |
|
|
В |
% |
|
|
Равновесный потенциал анода Анодная поляризация Равновесный потенциал катода Катодная поляризация Падение напряжения в электролите Падение напряжения в шламе Падение напряжения в электродах, контактах, шинах Напряжение на ванне |
1,273 0,75 0,775 0,02 0,458 0,138 0,1 3,514 |
36,12 21,40 22,10 0,57 13,05 3,92 2,84 100 |
Определение удельного расхода электроэнергии
В цехе постоянно работает 1403 ванны. Напряжение на одной ванне 3,5 В. Если все ванны соединить между собой, то общее напряжение в электрической сети составит, В:
,5·1403=4910.
Исходя из требований техники безопасности, максимальное напряжение в цепи последовательно соединенных ванн не должно превышать 600-700 В. Следовательно, в цехе необходимо иметь 8 цепей ванн, с общим количеством ванн в каждой серии, шт:
:8=176.
Напряжение на серии ванн составит, В:
,5·176=617,
сила тока в сети равна 16000 А.
Определяем удельный расход электроэнергии на 1 т катодного цинка.
Расход электроэнергии за сутки составит, кВт·ч/т:
·617·8·24:1000=1895500.
Суточная производительность по катодному цинку составляет 597 т. Тогда удельный расход электрической энергии будет равен, кВт·ч/т:
:597=3175.
Зная напряжение на ванне, величину напряжения разложения сульфата цинка и выход по току, можно рассчитать коэффициент электроэнергии, используемый при электролизе по уравнению, %:
B=Eнр ·h:Uв =2,048·93:3,5=65,8.
Расчет теплового баланса ванны
Рассчитаем тепловой баланс одной ванны за один час.
Приход тепла.
Количество джоулева тепла можно рассчитать по формуле, кДж/ч:
q1 =J(Uв -DUкш -DUконт -DUш )·3600:1000=197800.
Расход тепла.
Потери тепла с отработанным электролитом (q3 ) не рассчитываем, так как q3 =q2 .
Потери тепла с испаряющей водой с поверхности электролита (q4 ) находим по формуле, кДж/ч:
q4 =λ·mH2 O·F,
где λ — скрытая теплота испарения 1 кг воды при заданной температуре, кДж/кг; mH2 O — масса испаряющей воды с 1 м2 поверхности электролита в час при заданной температуре, кг/м2 ·ч; F — площадь свободной поверхности электролита в ванне (зеркало электролита), м2 .
Скрытую теплоту испарения λ находим по уравнению, кДж/кг:
λ=( λ0 -tэл )·4,184,
где λ0 — скрытая теплота испарения 1 кг воды при стандартных условиях, λ0 =618 ккал/кг; tэл — температура электролита в ванне, ºС; 4,184 — коэффициент пересчета ккал в кДж:
λ=(618-35)·4,184=2439,27.
Массу воды находим по таблице. mH2 O=0,65.
Площадь свободной поверхности электролита в ванне рассчитываем исходя из размеров электролизной ванны и размеров и количества электродов, установленных в одной ванне.
Длина ванны составляет 1848 мм, ширина — 870 мм. В ванне находится 24 катода и 25 анодов. Ширина анода по данным практики составляет 645 мм, толщина анода — 8 мм. Ширина катода равна 666 мм, толщина катода — 6 мм. Тогда свободная поверхность электролита в ванне составит, м2 :
F=(1,848·0,87)-(0,645·0,008·25+0,666·0,006·24)=1,383.
Находим количество тепла, теряемое ванной за счет испарения воды с зеркала электролита, кДж/ч:
q4 =2439,27·0,65·1,383=2192,78.
Потери тепла зеркалом электролита вследствие лучеиспускания и конвекции находим по формуле Фурье, кДж/ч:
q5 =K·F·(tэл -tок.ср ),
где tок.ср — температура окружающей среды, ºС; K — коэффициент теплоотдачи, кДж/м2 ·ч·град, определяется по формуле Стефана-Больцмана:
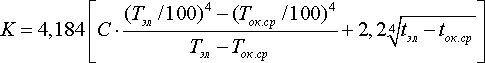
Для зеркала электролита С=3,2, tэл =35 ºС, tок.ср =20 ºС, тогда, кДж/м2 ·ч·град:
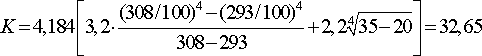 исп
исп
Подставляя данные получим потери тепла лучеиспусканием, кДж/ч:
q5 =32,65·1,383·(35-20)=677,43.
Потери тепла железобетонной поверхностью ванны в окружающую среду определим также по формуле Фурье, кДж/ч:
q6 =K’·F’·(tст -tок.ср ),
где tст — температура железобетонных стен электролизной ванны, tст =30ºС;
F’ — площадь боковых и торцевых стен ванны и её днища, м2 ; K’ — коэффициент теплоотдачи железобетонных стен ванны, кДж/м2 ·ч·град.
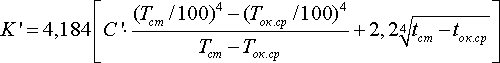
Для железобетонной поверхности C’=4, тогда, кДж/м2·ч·град:
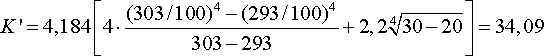 .
.
Площадь F’ определим исходя из габаритов ванны
F’=2(2,028·1,5+1,11·1,5)+2,028·1,11=11,66м2 ,
q6 =34,09·11,66·(30-20)=3974,9 кДж/ч.
Потери тепла с разбрызгиванием электролита определяем по формуле, кДж/ч:
q7 =F·mэл ·сэл ·tл ,
где mэл — масса раствора, теряющаяся с разбрызгиванием электролита с 1 м2 зеркала ванны в течение 1 ч, по данным практики mэл =0,3 кг/м2 ·ч; сэл — удельная теплоемкость электролита, сэл =3,26 кДж/кг·град.
Тогда, кДж/ч:
q7 =1,383·0,3·3,36·35=43,34.
Расход тела, связанный с протеканием химической реакции при электролизе рассчитываем по формуле, кДж/ч:
q8 =DH·mZn ·103 ·M,
где M — молекулярная масса цинка, M=65,37; mZn — масса цинка, полученная в одной ванне за 1 ч, кг/ч; DH — тепловой эффект химической реакции, при t=25 ºС DH=-452,16 кДж/моль. Для температуры электролита 35 ºС принимаем приближенное значение DH=-452 кДж/моль.
Для определения mZn необходимо суточную производительность цеха разделить на количество ванн, установленных в цехе и разделить на количество часов в сутках:
mZn =597000:(24·1403)=17,72 кг/ч,
q8 =452·17,56·103 :65,37=121418,39 кДж/ч.
Результаты расчета статей прихода и расхода тепла сводим в таблицу 5.2.
Разность между приходом и расходом тепла составит, кДж/ч:
Dq=Qприх -Qрасх =(q1 +q2 )-(q3 +q4 +q5 +q6 +q7 +q8 )=197800-(2192,78+677,43+3974,9+43,34+121418,39)= 69493,16
Таблица 5.2 — Тепловой баланс ванны электролиза раствора сульфата цинка
|
Приход тепла |
Расход тепла |
||||
|
Статьи прихода |
количество |
Статьи расхода |
количество |
||
|
кДж/ч |
% |
кДж/ч |
% |
||
|
Джоулево тепло Тепло, поступающее с электролитом |
197800 Не рассчи-тывали |
100 |
Тепло с отработанным раствором Тепло с испаряющейся водой Тепло зеркала электролита Тепло поверхности ванны Тепло с разбрызгиванием электролита Тепло экзотермической реакции Избыток тепла, который необходимо отводить, охлаждая электролит |
— 2192,78 677,43 3974,90 43,34 121418,4 69493,16 |
— — — — — — — |
|
Итого |
197800 |
100 |
Итого |
197800 |
100 Циркуляция раствора должна обеспечивать отвод всего избыточного тепла. Используя уравнение, кДж/ч: Dq=υ ц ·ρ·с·(tэл -tохл ), где υ ц — скорость циркуляции раствора, л/ч; ρ — плотность отработанного электролита, ρ=1,17 г/см3 ; с — удельная теплоемкость отработанного электролита, с=3,26 кДж/кг·град; tэл — температура электролита в ванне, ºС; tохл — температура поступающего охлажденного электролита, ºС, можно определить скорость циркуляции раствора, которая обеспечит полный отвод избыточного тепла при известном значении tохл , или определить температуру, до которой надо охлаждать раствор, задавшись определенной скоростью циркуляции. Примем температуру охлажденного электролита, поступающего в ванны, tохл=19 ºС. Тогда скорость циркуляции в ванне составит, л/ч: Эта величина в 6,29 раза превышает рассчитанную ранее скорость подачи в ванну нейтрального раствора. Полученная скорость циркуляции электролита при централизованном охлаждении раствора хорошо согласуется с практикой для выбранного значения t охл =19 ºС. Зная скорость циркуляции, содержание цинка и серной кислоты в отработанном электролите, можем определить концентрацию этих веществ в поступающем в ванну растворе. Содержание цинка в поступающем растворе, г/л: Таким образом, при централизованном охлаждении в результате повышенной циркуляции электролита из одного литра раствора извлекается примерно 16 г цинка, что в 6,2 раза ниже извлечения в случае подачи в ванну нейтрального раствора. Концентрацию серной кислоты в поступающем в ванну растворе можно посчитать по формуле, г/л: Суммарная скорость циркуляции электролита в цехе с учетом всех работающих ванн составит, л/ч: (υ ц )=1403·υц =1403·1138,7=1597596,1 л/ч или 1597,6 м3 /ч. Скорость циркуляции электролита на одной серии ванн составит, м 3 /ч: (υ ц )с =(υц ):8=1597,6:8=199,7м3 /ч=200. [2] Список использованных источников [Электронный ресурс]//URL: https://drprom.ru/kursovaya/elektroliz-tsinka-iz-sulfatnyih-rastvorov/ 1 Металлургия свинца и цинка. Шиврин Г.Н. — М.: Металлургия — 1982.- 183-297 с. Расчеты технологических процессов в металлургии свинца и цинка: Учебное пособие. Колмаков А.А., Садилова Л.Г., Спектор О.В. ГАЦМиЗ.-Красноярск, 1998. — 120 с. 3 Интернет — ресурс <http://www.expert.ru> Интернет — ресурс <http://www.sibirservis.ru> Металлургия цинка и кадмия. М.М. Лакерник, Г. Н. Пахомова — 317 — 385с. |

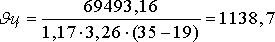 .
. 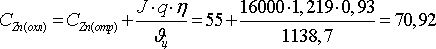 .
.