Курсы — важный способ проверки и этап в изучении любой дисциплины. Здесь в полной мере проявляются знания и профессиональные качества, которыми обладает студент.
Данная курсовая работа посвящена синтезу и анализу сульфата магния.
Сульфат магния широко применяется в различных отраслях промышленности [11]:
1. В химической промышленности он применяется в технологических процессах получения H 2 SO4 и MgO; при производстве синтетических моющих средств.
2. В сельском хозяйстве сульфат магния используется как почвенное удобрение для сельскохозяйственных культур.
3. В текстильной промышленности сульфат магния применяют в технологических процессах обработки тканей; для приготовления огнестойких составов для пропитки различных материалов; используется как наполнитель материалов, утяжелитель шелка и хлопка, протрава для покраски тканей и как отбеливающий компонент.
4. В медицине в качестве успокаивающего и спазмолитического средства; применение сульфата магния в комплексной терапии больных дискулярной энцефалопии позволяет уменьшить последствия ишемического повреждения головного мозга и купировать общемозговые нарушения.
5. В фармацевтической промышленности сульфат магния используется в процессах производства антибиотиков.
6. Строительная индустрия:
1).
Сульфат магния применяется как добавка для устройства дорожных и аэродромных оснований и покрытий;
2).
Входит в состав магнезиального цемента ( это композиция из каустического магнезита (продукт обжига MgСО 3 при температурах до 700 0 С в форме MgО) и солей магния, главным образом MgСl2 и MgSO4 . Водные растворы последних часто называют «затвердителями». Без отвердителей каустический мел, смешанный с водой, медленно затвердевает.
7. В целлюлозно-бумажной промышленности сульфат магния используется как наполнитель, а также как компонент позволяющий сохранить и улучшить физико-механические показатели бумаги при использовании отбеливателей (особенно хлорсодержащих) и для получения огнестойких изделий из бумаги.
Цели исследования в данной работе:
1. Синтезировать и идентифицировать соединение;
2. подтвердить его чистоту
3. провести количественный и качественный анализ.
Задачи исследования:
По литературным источникам:
[Электронный ресурс]//URL: https://drprom.ru/kursovaya/magniya-sulfat/
Биодоступность оксида и других соединений магния при пероральном приеме (обзор)
... диеты). Начиная с 49–го дня диеты животные получали соли магния (Mg хлорид, Mg сульфат, Mg оксид, Mg нитрат, Mg тиосульфат, Mg гидрофосфат, Mg карбонат, Mg трисиликат, ... [6]. Следует отметить, что, несмотря на активный интерес к роли магния в обменных процессах, влияния дефицита магния на развитие неврологической и сердечно-сосудистой патологии, патологии беременности и ...
- составить характеристику исследуемого вещества
- осуществить подбор и обработку методик синтеза и анализа;
- составить схему качественного анализа
- описать способы приготовления растворов, их стандартизацию.
В ходе эксперимента:
- синтезировать вещество;
- определить выход препарата;
- определить качественный и количественный состав синтезируемого соединения.
1.1.
Характеристика и химические свойства сульфата магния
Сульфат магния (магний сернокислый, горькая соль), MgSO 4 — это белый кристаллический порошок с плотностью 2,66 г/см3 . При 1127°С разлагается с выделением SO2 . Хорошо растворяется в воде (слабый гидролиз по катиону).
Образует кристаллогидраты: MgSO4 *H2 O (бесцветные кристаллы с моноклинной решеткой с плотностью 2,6 г/см3 ), MgSO4 *6H2 O (кристаллы с моноклинной решеткой с плотностью 1,70 г/см3 ) и MgSO4 *7H2 O (бесцветные кристаллы с ромбической решеткой с плотностью 1,68 г/см3 ).
Сульфат магния используют как сырье для получения MgO, в производстве магнезиальных цементов, в качестве утяжелителей хлопка и шелка, протравы при крашении тканей, как наполнитель бумаги, спазмолитическое, слабительное и желчегонное лекарственное средство [11].
Химические свойства:
1. Сульфат магния хорошо растворяется в воде, гидролизуется по катиону:
MgSO 4 (разб.) + 4H2 O → [Mg(H2 O)4 ]2+ + SO4 2- ,
[Mg(H 2 O)4 ]2+ + H2 O → [Mg(H2 O)3 (OH)]+ + H3 O+ ;
2. Вступает в реакции обмена:
MgSO 4 + BaCl2 → BaSO4 ↓ + MgCl2
3. Может взаимодействовать с концентрированной серной кислотой:
MgSO 4 + H2 SO4 → Mg(HSO4 )2
4. Реагирует с щелочами:
MgSO 4 + NaOHразб → Mg(OH)2 ↓ + Na2 SO4
5. Взаимодействует с концентрированным аммиаком:
MgSO 4 +2 NH4 OHконц → Mg(OH)2 ↓ + (NH4 )2 SO4
1.2. Способы получения сульфата магния.
По Ключникову Н. Г. [6]
С помощью этого метода сульфат магния может быть получен путем растворения оксида магния в горячей серной кислоте.
+ H 2 SO4 → MgSO4 + H2 O
По методике, описанной в практикуме Корякина и Ангелова [1], MgSO 4 можно получить, растворяя карбонат магния в серной кислоте:
Вгорячую30%-ную серную кислоту вносят при энергичном перемешивании MgCO 3 (технический) до прекращения вспенивания жидкости. Отфильтрованная проба жидкости не должна давать красного окрашивания с NH4 SCN, в противном случае прибавляют еще MgCO3 . Раствор фильтруют и фильтрат оставляют кристаллизоваться на холоду. На следующий день, выпавшие кристаллы отсасывают на воронке Бюхнера, промывают небольшими количеством ледяной воды и перекристаллизовывают из воды (на 100 г соли берут 40 мл воды).
Химическая посуда и другие принадлежности (2)
... в лаборатории верхнюю одежду. О любом происшествии в лаборатории, даже самом незначительном, необходимо сообщить преподавателю или инженеру [2]. 2. Химическая посуда и другие принадлежности 2.1 Стеклянная посуда Применяемая в лабораториях химическая посуда ... посуду, в которой будет проводиться реакция с металлическим натрием. После окончания работы нельзя сразу мыть эту посуду водой, следует ...
1.3. Техника безопасности при работе в химической лаборатории
1. Основные правила работы в лаборатории общей химии
1) К работе в лаборатории могут быть допущены лица, прошедшие инструктаж по технике безопасности.
2) Все опыты, реакции и все связанные с ними операции следует делать аккуратно, точно придерживаясь указаний, имеющихся в учебниках, руководствах или сообщённых преподавателем.
3) Лабораторный рабочий стол следует содержать в порядке и чистоте, потому что загрязнения со стола могут попасть в анализируемый раствор и испортить анализ.
4) Лабораторный стол нельзя загромождать посудой и приборами, т.к. все это мешает работе. На столе должно быть только то, что необходимо в любой момент времени для проведения эксперимента.
5) Многие работы в химической лаборатории связаны с возможностью загрязнения, а также порчи одежды при попадании на неё кислот и других реактивов, поэтому каждый работающий в химической лаборатории должен надевать халат.
6) Химическая посуда в большинстве случаев тонкостенная и хрупкая, поэтому при небрежном отношении к ней можно её разбить и порезаться. Обращаться с посудой и столовыми приборами необходимо осторожно, не сжимая их пальцами. Химическую посуду нельзя ставить на стол резко, особенно если он покрыт керамикой.
7) Нюхать вещества нужно, не наклоняясь над сосудом и не вдыхая полной грудью, а только направляя к себе пары движением руки.
8) Категорически запрещается пробовать что-либо на язык. Запрещается набирать ртом при помощи пипетки пли трубки ядовитые или едкие жидкости; для этого следует пользоваться грушей.
9) Во избежание случайных отравлений запрещается пользоваться для питья какой-либо химической посудой.
10) Строго запрещается принимать в лаборатории пищу.
11) Все опыты с ядовитыми, вредными для здоровья и дурно пахнущими веществами следует проводить обязательно под тягой.
12) При приготовлении растворов кислот, надо вливать кислоту в воду, а не наоборот, и пользоваться при этом толстостенной или фарфоровой посудой.
13) Производя химические опыты, приборы следует располагать таким образом, чтобы реагирующие вещества в случае разбрызгивания не могли попасть на самого экспериментатора или находящихся вблизи других лиц.
14) Взвешивать твёрдую щелочь нужно обязательно в какой-нибудь стеклянной или фарфоровой посуде.
15) Химические реактивы брать только шпателем, пинцетом или ложечкой (не руками!).
16) Неизрасходованные реактивы не высыпать и не выливать обратно в те сосуды, откуда они были взяты.
17) Жидкости переливать через химические воронки. Бутылку, из которой наливается жидкость, необходимо держать этикеткой в руке, чтобы не повредить ее.
18) При нагревании растворов и веществ в пробирке необходимо использовать держатель. Открытие шланга должно быть направлено в сторону от вас и других рабочих.
19) При неосторожной работе возможны ожоги нагретой стеклянной посудой, тиглями и т.п., поэтому нельзя брать горячую посуду незащищёнными руками.
20) Если на сосуде нет этикетки или надписи и не известно, какой реактив содержится в нём, то пользоваться этим реактивом нельзя.
Металлическая посуда
... на основе меди. В этих подгруппах металлическую посуду подразделяют по видам и разновидностям. По конфигурации корпуса стальная эмалированная посуда бывает цилиндрическая, прямоугольная, коническая, сферическая, сложная ... крышки лентой из нержавеющей стали. Стальная эмалированная посуда для тепловой обработки пищевых продуктов выпускается следующих видов: кастрюли различной формы, в том числе ...
21) После работы в лаборатории нужно тщательно вымыть руки, так как значительная часть веществ, с которыми приходится соприкасаться в лаборатории, ядовита.
2. О пожарах в лаборатории и способах их устранения
1) Если загорелись деревянные предметы, пожар можно тушить водой, песком и с помощью огнетушителя.
2) Если горит нерастворимое в воде вещество (например, бензин, скипидар, масло и др.), то нельзя применять для тушения воду, потому что пожар не только не будет ликвидирован, но даже может усилиться. Многие горючие органические вещества легче воды и при контакте с ней образуют горящую пленку.
3) Нерастворимые в воде органические вещества следует тушить песком или накрыванием шерстяным одеялом. необходимо прикрыть сердце огня и не бросить его, чтобы огненные брызги не разлетелись в стороны.
4) В легко доступном месте лаборатории должен висеть проверенный огнетушитель, а также должен быть ящик с песком или листовым асбестом. Работающим в лаборатории необходимо ознакомиться с инструкцией по обращению с огнетушителем, обычно написанной на каждом из них.
5) В случае загорания проводов и электроприборов, находящихся под током, необходимо немедленно выключить ток и тушить огонь сухим углекислотным огнетушителем, сухим песком, покрывалом из асбеста.
6) Если загорелась одежда, следует сначала погасить пламя, накинув на пострадавшего шерстяное одеяло.
3. Медицинская помощь в лаборатории
1) В случае пореза стеклом нужно вначале осмотреть ранку и извлечь из нее осколки стекла, если они есть, а затем обмыть пораненное место, смазать йодом и завязать бинтом или залепить лейкопластырем.
2) При тепловом ожоге надо смочить обожжённое место раствором перманганата калия, затем смазать мазью от ожогов, и перевязать бинтом.
3) При ожоге кислотами поражённый участок кожи быстро промыть большим количеством воды, затем обмыть 2%-ным раствором соды NaНСО 3 , смазать обожженное место вазелином и перевязать бинтом.
4) При ожогах щёлочью: смыть водой, а затем 2%-ным раствором уксусной или борной кислоты, после этого смазать борным вазелином или 5%-ным раствором марганцевокислого калия и перевязать бинтом. При ожогах промыть глаза 1% раствором борной кислоты и капнуть 1-2 капли касторового масла.
5) При поражении электричеством выключить ток пли устранить контакт при помощи резиновых перчаток или сухой деревянной палки. [9, 10]
4. Техника безопасности при работе с сульфатом магния.[12]
7-водный сульфат магния безопасен от возгорания и взрывов, по степени воздействия на организм относится к веществам 4-го класса опасности.
Сульфат магния 7-водный расфасовывают в полипропиленовые, полиэтиленовые, бумажные пакеты, специальные мягкие контейнеры для одноразового использования, пакеты с полимерной внутренней подкладкой, из комбинированных полимеров и водонепроницаемых материалов или другие влагонепроницаемые контейнеры.
Опасность для человека
Средства индивидуальной защиты
Инертные газы: история открытия, свойства, применение
... сотрудники занялись минералами, природными водами, даже метеоритами. Результаты анализов неизменно оказывались отрицательными. Между тем—теперь мы это знаем—новый газ в них был. Но методами, существовавшими в ... – инертный газ, и предполагали, что это металл. И только спустя почти четверть века гелий был обнаружен на земле. В 1895, через несколько месяцев после открытия аргона, У.Рамзай ...
1).
Защитные очки, респираторы Кама или У-2К, перчатки из хлопка, резины или поливинилхлорида, спецодежда.
2).
Одежду следует стирать в мыльно-содовом растворе не реже 1 раза в неделю, резиновые перчатки и защитные очки следует мыть ежедневно водой, респираторы следует менять по мере необходимости.
3).
Перед едой необходимо тщательно вымыть руки и лицо с мылом, прополоскать рот.
Необходимые действия в аварийных ситуациях:
При утечке, разливе и россыпи
Освободившуюся тару сжечь или утилизировать в отведенных местах.
При пожаре
Рекомендуемые средства тушения – вода, пенные огнетушители и песок.
Меры первой помощи
При попадании в глаза, При вдыхании, При отравлении
1.4. Анализ MgSO 4 и его возможных примесей., Качественный анализ:
Анализ проводится согласно схемы 1.
1. Небольшое количество сухой соли растворить в воде при перемешивании. Если полного растворения не произошло, отделить осадок 1 центрифугированием. Получаем раствор 1 , содержащий Fe 2+ ; Ca 2+ ; Mg 2+ ; Mn 2+ ; Pb 2+ ; Zn 2+ ; NO 3 — ; SO 4 — ; Cl — , и осадок 1 , содержащий CaSO 4 ↓, Ca 3 ( PO 4 )2 ↓, CaCO 3 ↓, PbSO 4 ↓, Pb 3 ( PO 4 )2 ↓, PbCO 3 ↓, PbCl 2 ↓, Mg 3 ( PO 4 )2 ↓, MgCO 3 ↓, Mn 3 ( PO 4 )2 ↓, MnCO 3 ↓, Fe 3 ( PO 4 )2 ↓, FeCO 3 ↓, Zn 3 ( PO 4 )3 ↓, ZnCO 3 ↓ [3].
2. Анализ раствора 1
2.1. Осаждение Ca2+ и
раствора 1
Са 2+ + Н 2 SO4 = CaSO4 ↓ + 2H+
Pb 2+ +
Получаем раствор 2, содержащий Fe 2+ , Mg 2+ , Zn 2+ , Mn 2+ , Cl — , NO 3 — , SO 4 — и осадок 2, содержащий CaSO 4 ↓ и PbSO 4 ↓.
2.2. Открытие
К осадку 2 добавить (NH4 )2 SO4, немного нагреть. Осадок 3 PbSO4 ↓ отделить от раствора 3 , содержащего Ca2+ центрифугированием:
Са SO4 ↓+(NH4 )2 SO4 .→ (NH4 )2 [ Са (SO4 )2 ]
2.2.1.
PbSO4 ↓ + 4CH3 COONH4 = (NH4 )2 [Pb(CH3 COO)4 ] + (NH4 )2 SO4
Получим раствор 4, содержащий Pb 2+ .
2.2.2.
Pb 2+ + 2 KI = PbI 2 ↓+ 2 K +
PbI 2 ↓ + 2 KI = K 2 [ PbI 4 ]
PbI 2 ↓ + 2 CH 3 COOH = ( CH 3 COO )2 Pb + 2 HI
2.3. Открытие
раствора 3
SO 4 2- + Ca2+ = CaSO4 ↓

а) б)
Кристаллы Ca 2 SO4 *2H2 O, образующиеся в разбавленных (а) и в концентрированных (б) растворах кислот
3. Анализ раствора 2.
3.1. Осаждение
раствора 2
Pb 2+ +K2 CO3 = PbCO3 ↓+2K+
Ca 2+ +K2 CO3 = CaCO3 ↓+2K+
Fe 2+ +K2 CO3 = FeCO3 ↓+2K+
Mn 2+ +K2 CO3 = MnCO3 ↓+2K+
Mg 2+ +K2 CO3 = MgCO3 ↓+2K+
Zn 2+ +K2 CO3 = ZnCO3 ↓+2K+
3.2. Открытие
раствор 2
K 2 CO3 +2 CH3 COOH = H2
3.2.1.
раствора 5
Йодокрахмальная бумажка синеет:
 10 KCl + 2 KMnO 4 + 8 H 2 SO 4 = 5 Cl 2 + 2 MnSO 4 + 6 K 2 SO 4 + 8 H 2 O
10 KCl + 2 KMnO 4 + 8 H 2 SO 4 = 5 Cl 2 + 2 MnSO 4 + 6 K 2 SO 4 + 8 H 2 O
Окисление: MnO 4 — +8 H + + 5 e = Mn 2+ + 4 H 2 O
Восстановление: 2 Cl — -2 e = Cl 2
_____________________________________________
2 MnO 4 — + 16 H + + 10 Cl — = 2 Mn 2+ + 8 H 2 O + 5 Cl 2
Йодокрахмальная бумажка синеет вследствие:
Cl — + 2 I — = I 2 + 2 Cl —
I 2 + крахмал = синий комплекс
3.2.2 Открытие
раствора 5
SO 4 2- + Ca2+ = CaSO4 ↓

а) б)
Кристаллы Ca 2 SO4 *2H2 O, образующиеся в разбавленных (а) и в концентрированных (б) растворах кислот
3.2.3. Открытие
раствора 5
2NaNO 3 + Cu + 2H2 SO4 = CuSO4 + 2NO2
Восстановлении, Окисление
_______________________________________________________________________
Cu0 + 2NO3 — + 4H+ = Cu2+ + 2NO2 ↑+ 2H2 O
4. Анализ осадка 4.
4.1.Перевод тяжелых металлов из осадка 4 в раствор 6 [3]:
Осадок 4 растворить в 2N HNO3 :
FeCO3 ↓+2HNO3 = Fe(NO3 )2 +2H2 O+ CO2 ↑
MnCO3 ↓+2HNO3 = Mn (NO3 ) +2H2 O + CO2 ↑
MgCO3 ↓+2HNO3 = Mg (NO3 ) +2H2 O +CO2 ↑
CaCO3 ↓+2HNO3 = Ca(NO3 )2 +2H2 O+ CO2 ↑
PbCO3 ↓+2HNO3 = Pb(NO3 )2 +2H2 O+ CO2 ↑
ZnCO3 ↓+2HNO3 = Zn(NO3 )2 +2H2 O+ CO2 ↑
раствор 6
4.2.Осаждение
раствору 6
Ca(NO3 )2 + K2 SO4 = CaSO4 ↓ + 2KNO3
Pb(NO3 )2 + K2 SO4 = PbSO4 ↓ + 2KNO3
раствора 6
4.2. Определение
раствору 6
Fe2+ +K3 [Fe(CN)6 ] = KFe[Fe(CN)6 ] ↓+2K+ ,
KFe[Fe(CN) 6 ] ↓+2KOH = K3 [Fe(CN)6 ] +Fe(OH)2 ↓.
4.3. Открытие
раствором 6
Mg 2+ + 2NaOH = Mg(OH)2 ↓ + 2Na+
Fe 2+ + 3NaOH = Fe(OH)2 ↓ + 3Na+
Mn 2+ + 2NaOH = Mn(OH)2 ↓ + 2Na+
Zn 2+ + 2NaOH = Na2 [Zn(OH)2 ]
Разделим получившийся осадок 5 на две равные части 5.1 и 5.2 . В каждой части будет находиться Mg ( OH )2 ↓ , Fe ( OH )2 ↓, иMn ( OH )2 ↓.
4.3.1. Открытие
осадку 5.2.
Mn(OH) 2 ↓ + H2 SO4 = Mn SO4 + 2H+
Mg(OH) 2 ↓ + H2 SO4 = Mg SO4 + 2H+
Fe(OH) 2 ↓ + H2 SO4 = Fe SO4 + 2H+
Zn(OH) 2 ↓ + H2 SO4 = Zn SO4 + 2H+
Перенести несколько кристаллов персульфата аммония в пробирку, добавить 3-5 капель 2N азотной кислоты и 1-2 капли 1% раствора нитрата серебра. Смесь нагреть до 70˚ С. В нагретую смесь внести палочкой одну каплю исследуемого раствора. Смесь можно подогреть. При наличии в растворе Mn 2+ раствор станет розовым или малиновым. При большой концентрации ионов Mn 2+ в раствормогут высыпать бурые хлопья MnO ( OH )2 . В этом случае опыт повторить, предварительно разбавив анализируемый раствор дистиллированной водой в 2-5 раз.
 2MnSO4 + 5(NH4 )2 S2 O8 +8H2 O = 2HMnO4 + 5(NH4 )2 SO4 + 7H2 SO4
2MnSO4 + 5(NH4 )2 S2 O8 +8H2 O = 2HMnO4 + 5(NH4 )2 SO4 + 7H2 SO4
Mn 2+ + 4H2 O +5e = MnO4 — + 8 H+
S 2 O8 2- -2e = 2SO4 2
2Mn2+ + 8H2 O+ 5 S2 O8 2- = 2 MnO4 — + 16H+ + 10 SO4 2-
4.3.2. Открытие
осадку 5.1.
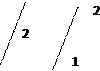 1. 2Fe(OH)2 ↓ +4 NaOH + H2 O2 = 2Fe(OH)3 ↓ + Na+
1. 2Fe(OH)2 ↓ +4 NaOH + H2 O2 = 2Fe(OH)3 ↓ + Na+
Fe 2+ + 3OH— — 1e = Fe(OH)3 ↓
H 2 O2 + 2e = 2OH—
Fe(OH)2 ↓+ 4OH — + H2 O2 = Fe(OH)3 ↓+ 2OH—
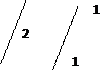 2. Mn(OH)2 ↓ +2 NaOH + H2 O2 = MnO(OH)2 ↓ +2 Na+ + H2 O
2. Mn(OH)2 ↓ +2 NaOH + H2 O2 = MnO(OH)2 ↓ +2 Na+ + H2 O
Mn 2+ +4OH — — 2e = MnO(OH)2 + H2 O
H 2 O2 + 2e = 2OH—
Mn(OH)2 ↓ +2OH — + H2 O2 = MnO(OH)2 ↓ + H2 O
осадок 6,
Mg ( OH )2 ↓ + 2 NH 4 Cl = MgCl 2 + 2 NH 3 * H 2 O
раствор 8
Mg 2+ + NH 3 * H 2 O + Na 2 HPO 4 = ( NH 4 ) MgPO 4 ↓ + 2 Na + + H 2 O
Рисунок:
5. Осаждение тяжелых металлов
раствора 1
раствор 5
Fe 2+ +K2 CO3 = FeCO3 ↓+2K+
Mn 2+ +K2 CO3 = MnCO3 ↓+2K+
Pb 2+ +K2 CO3 = PbCO3 ↓+2K+
Mg 2+ +K2 CO3 = MgCO3 ↓+2K+
Ca 2+ +K2 CO3 = CaCO3 ↓+2K+
Zn 2+ +K2 CO3 = ZnCO3 ↓+2K+
5.1. перевод тяжелых металлов из осадка 9 в раствор 10
Осадок 9 растворить в 2N азотной кислоте:
FeCO3 ↓+2HNO3 = Fe(NO3 )2 +2H2 O + CO2 ↑
MnCO3 ↓+2HNO3 = Mn (NO3 )2 +2H2 O + CO2 ↑
MgCO3 ↓+2HNO3 = Mg (NO3 ) +2H2 O + CO2 ↑
CaCO3 ↓+2HNO3 = Ca(NO3 )2 +2H2 O + CO2 ↑
PbCO3 ↓+2HNO3 = Pb(NO3 )2 +2H2 O+ CO2 ↑
ZnCO3 ↓+2HNO3 = Zn(NO3 )2 +2H2 O+ CO2 ↑
раствор 10.
5.2.Осаждение Ca2+ и
раствору 10
Са 2+ + Н 2 SO4 = CaSO4 ↓ + 2H+
Pb 2+ +
раствор 11
Анализ осадка 2 смотреть в пункте 2 (без осаждения) – 2.3.
6. Анализ раствора 11
6.1. дробное открытие
4.1.
6.2. открытие
К раствору в пробирке добавить избыток щелочи NaOH.
Mg 2+ + 2NaOH = Mg(OH)2 ↓+ 2Na+
Mn 2+ +2 NaOH = Mn(OH)2 ↓+ 2Na+
Fe 2+ + 2NaOH = Fe(OH)2 ↓+ 2Na+
Zn 2+ + 2NaOH = Na2 [Zn(OH)4 ]
осадок 5,
Zn 2+ + 2NaOH = Zn(OH)2 + 2Na+
Zn(OH) 2 + 2NaOH = Na2 [Zn(OH)4 ]
Zn 2+ + 4 OH — = [ Zn ( OH )4 ]2-
Анализ осадка 5 смотреть в пункте 4.3.
7. Анализ осадка 1
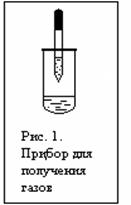
7.1. Открытие
Дробно. Собрать прибор, как это показано на рисунке 1. В пипетку набрать известковую воду. В пробирку поместить намного осадка 1 . К осадку добавить 5 капель 2N раствора HNO3 . Пробирку быстро закрыть пробкой с вставленной в нее пипеткой:
FeCO 3 ↓ + 2 HNO 3 = Fe ( NO 3 )2 + CO 2 ↑+ H 2 O
PbCO3 ↓ + 2HNO3 = Pb(NO3 )2 + CO2 ↑+ H2 O
CaCO3 ↓ + 2HNO3 = Ca(NO3 )2 + CO2 ↑+ H2 O
 MgCO3 ↓ + 2HNO3 = Mg(NO3 )2 + CO2 ↑+ H2 O
MgCO3 ↓ + 2HNO3 = Mg(NO3 )2 + CO2 ↑+ H2 O
MnCO3 ↓ + 2HNO3 = Mn(NO3 )2 + CO2 ↑+ H2 O
ZnCO3 ↓ + 2HNO3 = Zn(NO3 )2 + CO2 ↑+ H2 O
Известковая вода в пипетке мутнеет:
Ca(OH) 2 + CO2 ↑ = CaCO3 ↓ + H2 O
7.2. Перевод
К осадку 1 добавить воды и немного нагреть. Раствор 13 отделить от осадка 11 центрифугированием:
PbCl 2 ↓+ 4 H 2 O = [ Pb ( H 2 O )4 ] Cl 2
7.3. открытие
См. п.2.2.
7.4. открытие
раствора 13
Pb 2+ + K 2 CO 3 = PbCO 3 ↓+2 K +
Нейтрализация раствора 17:
K 2 CO 3 +2 CH 3 COOH = 2 CH 3 COOK + CO 2 ↑ + H 2 O
Открытие Cl — смотреть в пункте 3.2.1.
8. Анализ осадка 11
8.1. Открытие
осадку 11
PbSO4 ↓ + 4CH3 COONH4 = (NH4 )2 [Pb(CH3 COO)4 ] + (NH4 )2 SO4
раствор 14
8.1.1. Открытие
7.3.
8.1.2. Открытие
раствору 14
Pb 2+ + K 2 CO 3 = PbCO 3 ↓+2 K +
Нейтрализация раствора 16:
K 2 CO 3 +2 CH 3 COOH = 2 CH 3 COOK + CO 2 ↑ + H 2 O
Анализ раствора 16 см 3.2.2 .
8.2. Перевод осадка 12 в раствор15
осадку 12
FeCO3 +2 HNO3 = Fe(NO3 )2 + CO2 + 2H2 O
Fe3 (PO4 )2 + 6HNO3 = 3Fe(NO3 )2 + 2H3 PO4
MnCO3 ↓+ 2HNO3 = Mn (NO3 )2 + 2H2 O + CO2 ↑
Mn3 (PO4 )2 + 6HNO3 = 3Mn(NO3 )2 + 2H3 PO4
MgCO3 ↓+ 2HNO3 = Mg (NO3 ) + 2H2 O + CO2 ↑
Mg3 (PO4 )2 + 6HNO3 = 3Mg(NO3 )2 + 2H3 PO4
CaCO3 ↓+ 2HNO3 = Ca(NO3 )2 + 2H2 O + CO2 ↑
Ca3 (PO4 )2 + 6HNO3 = 3Ca(NO3 )2 + 2H3 PO4
ZnCO3 ↓+ 2HNO3 = Zn(NO3 )2 + 2H2 O + CO2 ↑
Zn3 (PO4 )2 + 6HNO3 = 3Zn(NO3 )2 + 2H3 PO4
8.3. Открытие
раствору 15
Fe 2+ + N
Mn 2+ + Na2 CO3 = MnCO3 ↓+2 Na+
Pb 2+ + Na2 CO3 = PbCO3 ↓+2Na+
Mg 2+ + Na2 CO3 = MgCO3 ↓+2Na+
Ca 2+ + Na2 CO3 = CaCO3 ↓+2Na+
Zn 2+ + Na2 CO3 = ZnCO3 ↓+2Na+
Получим осадок 9 и раствор 18 , содержащий PO4 3- .
8.3.1. Нейтрализация раствора 18
раствору 18
Na 2 CO 3 +2 CH 3 COOH = H 2 О+ CO 2 ↑+2 CH 3 COONa
В полученный нейтральный раствор добавьте несколько капель молибденовой жидкости. Образовавшийся желтый кристаллический осадок додекамолибдофосфата свидетельствует о наличие в растворе фосфат-ионов:
PO4 3- + 12(NH4 )2 MoO4 + 24HNO3 ! = (NH4 )3 [PMo12 O40 ] ↓ + 12H2 O + NH4 NO3 + +3NO3 —
8.4. Анализ осадка 9
| ион | Метод | Вид титрования | Титрант | Индикатор | рН | |||
| SO 4 2- |
1. Комплексонометрия 2. Ионообменная хроматография, катионит в Н – форме. |
Обратное |
титрант 1: BaCl 2 титрант 2: ЭДТА |
Хромоген черный | 8-10 (аммиачный буфер) | |||
| Fe 2+ |
1. Перманганатометрия, 2. ОВТ, |
Прямое | KMnO 4 | Безындика-торный | 4-6 (сернокислая среда) | |||
| Са 2+ | Комплексонометрия | Прямое | ЭДТА | Мурексид | 12 (щелочь) | |||
| Pb 2+ | Комплексонометрия | Прямое | ЭДТА | Ксиленоловый оранжевый | 5 (ацетатный буфер) | |||
| Cl — |
1. Осадительное, 2. Аргентометрия, 3. метод Мора |
Прямое | AgNO 3 | K 2 CrO4 | 7 | |||
| NO 3 — |
1. Катионообменная хроматография, катионит в Н-форме 2. КОТ, алкалиметрия |
Прямое | NaOH | ф/ф | 7 | |||
| CO 3 2- | КОТ, алкалиметрия | обратное | титрант 1: HCl титрант 2: NaOH | ф/ф | 7 | |||
| Mn 2+ |
1. ОВТ, 2. Перманганатометрия |
Прямое | KMnO 4 | Безындика-торный |
7 (ZnO) |
|||
| Mg 2+ | Комплексонометрия | Прямое | ЭДТА | Эриохром |
9,5-10 (аммонийный буфер) |
|||
1.5. Количественное определение сульфата магния и его примесей [4]:
Таблица 1
1.6. Количественный анализ:
Количественное определение
Количественное определение
1. Приготовление установочного вещества [4]:
Приготовить 50 мл 0,1N раствора MgSO 4 *7H2 O.
1.1 Расчет навески:
1. fэ = ½
2. Мэ = fэ*М =1/2*246,47=123,235 г
3. g(MgSO 4 ∙7H2 O)=Мэ *V*CN =123,235 г/моль*0,05 л*0,1 моль/л = 0,6162 г
1.2 Взятие навески (сначала на ТВ, а потом на АВ) [4].
m пуст.кап =
m кап.с в-вом =
m кап.с ост. =
g практ. =
1.3 Растворение навески [4]:
1.3.1. Заполнить мерную колбу на 1/3 объема дистиллированной водой.
1.3.2. Высыпать навеску в мерную колбу через сухую воронку. Смыть остатки образца с воронки и горлышка колбы небольшим количеством воды.
1.3.3. Растворить соль. Если вещество плохо растворяется, слегка нагрейте колбу на горячей плите до полного растворения вещества.
1.3.4. Охладить колбу до комнатной температуры. Довести объем раствора в колбе дистиллированной водой до метки по нижней границе мениска (последнюю каплю воды добавлять глазной пипеткой).
1.3.5. Закрыть колбу пробкой и перемешать 15-20 раз. Содержимое колбы вылить в чистую посуду.
1.4 Рассчеты:
1. Т(MgSO 4 ∙7H2 O)= g(MgSO4 ∙7H2 O)/V(колбы)
2. С N (MgSO4 ∙7H2 O)=Т(MgSO4 ∙7H2 O)*1000/Мэ(MgSO4 ∙7H2 O)
3. К=g практ ./gтеор.
2. Приготовление рабочего раствора [4]:
Приготовить 50 мл 0,1N раствора ЭДТА.
2.1. Расчет навески:
1. fэ = ½
2. Мэ(ЭДТА) = fэ*М=½*372,24=186,12 г/моль
3. g теор. (ЭДТА) = Мэ *V*CN = 186,12 г/моль*0,05 л*0,1 моль/л=0,9306 г≈0,93 г
2.2. Взятие навески (на ТВ).
2.3. Растворение навески: проводить как в п. 1.3.
3. Приготовление аммонийного буфера:
1) Колбу на 10 мл заполняем на ⅓ дистиллированной водой.
2) Добавляем туда 57 мл 25%-ного раствора NH 3 *H2 O и 6,7 г NH4 Cl.
3) Перемешиваем и доводим объем до метки дистиллированной водой.
4) Приготовленный раствор переливаем в чистую посуду. Среду проверяем рН-метром (8-10).
4. Стандартизация рабочего раствора [4]:
MgSO 4 + H2 Ind ═ H2 SO4 + MgInd
![]()
![]() HOOCH2 C CH2 COONa
HOOCH2 C CH2 COONa
![]()
![]() MgInd + N─ CH2 ─ CH2 ─ N → H2 Ind . NaOOC H2 C CH2 COOH
MgInd + N─ CH2 ─ CH2 ─ N → H2 Ind . NaOOC H2 C CH2 COOH
— OOC─H2 C CH3 COONa
+ N─ CH 2 ─ CH2 ─ N
Na OOC ─H2 C CH3 COO—
Mg
Таблица 2
| № | V соли | V ЭДТА | Условия титрования |
|
1 2 3 |
2 2 2 |
V 1 V 2 V 3 V ср |
1. Прямое, индикаторное титрование. 2.Титрант – ЭДТА. 3.В колбе для титрования 2 мл MgSO 4 ∙7H2 O + 2 мл аммонийного буфера + сухой эриохром. 4. рН=10. 5. Титровать энергично перемешивая от винно-красной до синей окраски. Объем избыточной капли не вычитать. |
Стандартизация раствора ЭДТА по сульфату магния
Расчеты:
1. C N (ЭДТА)= CN (MgSO4 ∙7H2 O)*V(MgSO4 ∙7H2 O)/V(ЭДТА)
2. Т(ЭДТА)= C N (ЭДТА)*Мэ(ЭДТА)/1000
3. Т(ЭДТА/ MgSO 4 ∙7H2 O)= CN (ЭДТА)*Мэ(MgSO4 ∙7H2 O)/1000
5. Приготовление анализируемого раствора:
Приготовить 50 мл 0,1N раствора MgSO 4
5.1 Расчет навески:
1. f э =1/2
2. М э = 120,36 * ½=60,18г/моль
3. g т =CN *Vл *Mэ =0,1моль/л*0,050л*60,18г/моль=0,3009г
5.2. Взятие навески (сначала на ТВ, затем на АВ):
m пуст.кап =
m кап.с в-вом =
m кап.с ост. =
g практ. =
5.3. Растворение навески см п. 1.3
6. Определение Mg 2+ методом прямой комплексонометрии, титрант – ЭДТА [4]
Таблица 3
Титрование анализируемого раствора
| № | V соли | V ЭДТА | Условия титрования |
|
1 2 3 |
2 2 2 |
V 1 V 2 V 3 V ср |
1. Прямое, индикаторное титрование. 2.Титрант – ЭДТА. 3.В колбе для титрования 2 мл MgSO 4 + 2 мл аммонийного буфера + сухой эриохром. 4. рН=10. 5. Титровать энергично перемешивая от винно-красной до синей окраски. Объем избыточной капли не вычитать. |
Расчеты:
1. C N (Mg2+ ) = CN (ЭДТА)*V(ЭДТА)/Vопр
2. Т(ЭДТА/Mg 2+ ) = CN (ЭДТА)*Мэ(Mg2+ )/1000
3. Т(ЭДТА/ MgSO 4 ) = CN (ЭДТА)*Мэ(MgSO4 )/1000
4.ω% пр (Mg2+ ) = [T(ЭДТА/ Mg2+ )*V(ЭДТА) * Vразв * 100] / [gпр. ( MgSO4 )*Vоп ]
5. ω% теор (Mg2+ ) = М(Mg2+ )/М(MgSO4 )=24,305/120,36=0,2019 или 20,19%
6. D абс = ωпр (Mg2+ )-ωтеор (Mg2+ )
7. D отн. = Dабс *100% / ωтеор. ( Mg2+ )
8. ω% пр (MgSO4 ) = [T(ЭДТА/ MgSO4 ) *V(ЭДТА) *Vразв *100]/[gпр. (MgSO4 )*Vоп ]
9. D абс = ωпр (MgSO4 )-ωтеор (MgSO4 )
10. D отн. = Dабс *100% / ωтеор. ( MgSO4 )
7. Катионообменная хроматография [5]
Катионообменная хроматография необходима для удаления ионов магния, которые могут помешать обнаружению сульфат-ионов.
7.1. Подготовка катионита к работе [5]:
1 . Возьмите бюретку с краном объемом 25 мл и диаметром 1 см; вставьте поддерживающий ватный диск в нижнюю часть. В химический стакан налить 5 г катионита КУ-2 пятикратным объемом дистиллированной воды на 30 минут. Этой взвесью аккуратно заполнить бюретку, лишнюю воду слить через кран. Слой катионита должен быть 10 см, 0,5 мл воды должно оставаться выше уровня катионита, и между частицами катионита не должно быть воздуха.
2 . Чтобы преобразовать катионит в H, пропустите 50 мл 4M HCl через колонку, установив скорость потока с помощью клапана на 1 каплю в секунду.
Приготовление 40 мл 4N раствора HCl:
f=1
Mэ = 36,4612 г/моль
g т =CN *Vл *Mэ = 4 моль/л*0,050 мл*36,461 г/моль=7,2922 г≈7,29 г
3. Взятие навески [4]:
Кислоты, особенно концентрированные, нельзя взвешивать на весах, поэтому нужно пересчитать навеску на объем концентрированной кислоты Т % =С% *ρ/100, где ρ определяется практически по ареометру, С% — по справочнику:
V(HCl конц.) = g теор (HCl)/ Т% (HCl)
4. Растворение аликвоты [4]:
1) Заполнить мерную колбу на ½ объема дистиллированной водой.
2) Внести туда мерной пипеткой необходимое количество концентрированной кислоты.
3) Перемешать.
4) Довести объем до метки дистиллированной водой, последние капли добавляя глазной пипеткой, перемешать 15-20 раз, перелить раствор в чистую посуду.
8. Ионообменная хроматография[5]:
2R-H + + MgSO4 = R2 -Mg2+ + H2 SO4
Возьмите 10 мл анализируемого раствора с помощью дозирующей пипетки и пропустите его через колонку с катионитом в форме H, поддерживая скорость 2 мл в минуту. Вытекающий из колонки элюат собрать в коническую колбу. Промыть колонку дистиллированной водой (~60-80 мл), пропуская ее небольшими порциями. Добавьте новую порцию воды, когда жидкость в колонне почти достигнет поверхности анионита. Сделать проверку последних порций элюата на полноту омывки (индикатор не должен менять свой цвет).
Перенести промывочную воду и основной элюат в мерную колбу на 100 мл, долить до метки дистиллированной водой. Колонку после работы регенерировать (см. пункт)
9. Определение SO 4 2- обратным комплексонометрическим титрованием [4]:
9.1. В колбу для титрования поместить 10 мл анализируемого раствора, 2-3 капли 2NHCl и прокипятить 2 – 3 минуты для удаления СО2 (если использовать прокипяченную дистиллированную воду, то кипячение смеси необязательно).
Добавить 5 мл ВаCl2 (готовится растворением 0,5г ВаCl2 *2Н2 О и 0,1 г MgCl2 *6Н2 О в мерной колбе на 250 мл).
Растворение проводить по методике, описанной в п. 1.3.
9.2. Оттитровывание избытка Ва 2+ :
Раствор перемешать, охладить. Добавить 5 мл аммонийного буфера и немного сухого эриохрома. Титруйте смесь стандартным раствором ЭДТА от красного до синего цвета. Определить V 1 титранта.
9.3 Контрольный эксперимент: поместите 10 мл дистиллированной воды в колбу для титрования вместо анализируемого раствора. Повторить п. 4.1. и 4.2. Определить V2 титранта.
MgSO 4 + ВаCl2 → ВаSO4 ↓ + MgCl2
Ва 2+ изб. + H2 Ind → ВаInd + 2Н+
![]()
![]() HOOCH2 CCH2 COONa
HOOCH2 CCH2 COONa
![]()
![]() ВаInd + N─ CH2 ─ CH2 ─ N → H2 Ind . NaOOCH2 C CH2 COOH
ВаInd + N─ CH2 ─ CH2 ─ N → H2 Ind . NaOOCH2 C CH2 COOH
— OOCH2 C CH2 COONa
+ N─ CH 2 ─ CH2 ─ N
NaOOCH2 C CH2 COO—
Ва
Таблица 4
Определение сульфат-ионов
| № | V опр | V 1титранта | V 2титранта | Условия титрования |
|
1 2 3 |
10 10 10 |
V 1 V 2 V 3 V 1титранта ср |
V 1 V 2 V 3 V 2титранта ср |
1. Обратное, индикаторное титрование. 2.Титрант – ЭДТА. 3.В колбе для титрования 10 мл элюата + 5 мл ВаCl 2 + 5 мл аммонийного буфера + эриохром. 4. рН=10. 5. Титровать энергично перемешивая от винно-красной до синей окраски. Объем избыточной капли не вычитать. |
Расчеты:
1. С N (SO4 2- ) = CN (ЭДТА)*( V2 (ЭДТА) – V1 (ЭДТА) )/ Vопр
2. T(ЭДТА/SO 4 2- ) = CN (ЭДТА)* Mэ (SO4 2- ) /1000
3. T(ЭДТА/ (MgSO 4 )= CN (ЭДТА)* Mэ (MgSO4 )/1000
4. ω% пр (SO4 2- ) = [T(ЭДТА/SO4 2- )* V(ЭДТА) * Vразв * 100] /gпр . ( MgSO4 )*Vоп
5. ω% теор (SO4 2- ) = М (SO4 2- ) / М(MgSO4 ) = 96,062 /120,36=0,7981 или79,81 %
6. D абс = ωпр (SO4 2- ) – ω теор (SO4 2- )
7. D отн . = Dабс *100% / ωтеор (SO4 2- )
8. ω% пр (MgSO4 )= T(ЭДТА/ MgSO4 )*V(ЭДТА)* Vразв * 100] / gпр . ( MgSO4 )*Vоп
9. D абс (MgSO4 ) = ωпр (MgSO4 )- ωтеор (MgSO4 )
10. D отн . (MgSO4 ) = Dабс (MgSO4 )*100% / ωтеор (MgSO4 )
2.1. Задачи эксперимента
- Освоить методику получения сульфата магния.
- Отработать практические навыки по неорганическому синтезу.
- Проведите качественный и количественный анализ полученного соединения, закрепив таким образом теоретические и практические знания аналитической химии.
- Отработать навыки самостоятельной работы в химической лаборатории.
2.2.
Синтез сульфата магния
2.2.1. Методика синтеза
По методике, описанной в практикуме Корякина и Ангелова [1], MgSO 4 можно получить, растворяя карбонат магния в серной кислоте:
Вгорячую30%-ную серную кислоту вносят при энергичном перемешивании MgCO 3 (технический) до прекращения вспенивания жидкости. Отфильтрованная проба жидкости не должна давать красного окрашивания с NH4 SCN, в противном случае прибавляют еще MgCO3 . Раствор фильтруют и фильтрат оставляют кристаллизоваться на холоду. На следующий день, выпавшие кристаллы отсасывают на воронке Бюхнера, промывают небольшими количеством ледяной воды и перекристаллизовывают из воды (на 100 г соли берут 40 мл воды).
2.2.2. Расчет синтеза
Таблица 5
Характеристика исходных веществ
| Вещество | Mr | В кристаллическом виде | ||
|
t плавления 0 С |
растворимость, г/100 г Н 2 О | |||
| При 20 0 С | при 100 0 С | |||
| MgCO 3 | 84,32 | >350 | Сл.р | — |
| MgSO 4 | 120,36 | 1127 | 33,7 | 50 |
| MgSO 4 *H2 O | 138,383 | 200 разл | — | 68,3 |
| MgSO 4 *6H2 O | 22,458 | — | 44,5 | 73,4 |
| MgSO 4 *7H2 O | 246,475 | 50 | 35,5 | — |
|
H 2 SO4 |
98,07 | 10,37 | ∞ | ∞ |
Полностью нам нужно получить 10 г чистого вещества, а практический выход составляет 67%, то, исходя из формулы ω = m пр /mтеор , выразим
m теор = mпр / ω
Сделаем расчет:
m теор =10 г/0,67 = 14,97 г = 15 г
Подставим полученное число в уравнение реакции и по пропорции высчитаем массы реагирующих веществ:
ху 15 г
MgCO 3 + H2 SO4 → MgSO4 + CO2 +H2 O
М 84,314г/моль 98,07г/моль 120,36г/моль
х = m(MgCO 3 ) = 84,314 * 15 / 120,36 = 10,50 (г)
у = m(H 2 SO4 ) = 98,07 * 15 / 120,36 = 12,22 (г)
Для синтеза нужно взять 10,50 г карбоната магния и 12,22 г серной кислоты. Но т.к. H 2 SO4 – это жидкость, то нужно пересчитать массу на объем:
ω = m в-ва / mр-ра → mр-ра = mв-ва / ω = 10,5/0,3 = 40,7 (г)
ρ = m р-ра / Vр-ра → Vр-ра = mр-ра / ρ = 40,7/1,118 = 36,4 (мл)
2.2.3. Подготовка к синтезу
- По справочнику [2] определяем плотность 30%-ной серной кислоты:
ρ = 1,118 г/мл
m р-ра =50*1,118 = 55,9 (г)
m вещ-ва =0,3*55,9=16,77 (г)
- Ареометром измеряем плотность концентрированной кислоты, имеющейся в лаборатории:
ρ = 1,830 г/мл
- Находим по справочнику [2] ω конц. = 93,64 %
- Рассчитываем необходимый объем концентрированной кислоты:
m р-ра = 16,77/ 0,9364 = 17,91(г)
V р-ра = 17,91/ 1,830 = 9,8(мл)
Для проведения синтеза необходимо 9,8 мл концентрированной серной кислоты и долить водой до 50 мл, соблюдая правила техники безопасности.
2.2.4. Техника безопасности при работе с серной кислотой
Если необходимо разбавить концентрированную серную кислоту, необходимо тонкой струйкой влить ее в воду и постоянно помешивать. Если вы сделаете обратное, кислота, в которую попала вода, мгновенно закипит, и произойдет взрыв пара с выделением концентрированных капель кислоты, которые могут упасть на ваши руки и лицо, вызывая их мгновенное обугливание под действием кислоты.
Другое правило – не работать с серной кислотой в хорошей одежде. Как бы хорошо ни укутываться в лабораторный халат или любую другую одежду, кислота все равно испортит все.
Третье правило – правило организации лабораторий. Серную кислоту нельзя сливать в канализацию. Если вы это делать постоянно, канализация превратится в дырявое решето. Слабоконцентрированная серная кислота эффективна для разрушения чугунных и пластиковых канализационных труб. Если вы все же сливаете кислоту в канализацию, сделайте это следующим образом. Запустите максимальный поток холодной воды и медленно слейте кислоту, затем подержите поток воды еще 5-10 минут, чтобы смыть ее остатки.
При попадании кислоты внутрь, ее необходимо как можно быстрее оттуда удалить, самый простой способ — вызвать рвотный рефлекс, вставив два пальца в рот и нажать на язык как можно дальше в горле, если это не получается, быстро выпить как можно больше воды и попытаться еще раз. После удаления кислоты необходимо выпить как можно больше воды и повторить рвотный рефлекс, желательно более одного раза, чтобы вывести остаточную кислоту из желудка и пищевода. После всех этих процедур необходимо срочно показаться врачу.
Если на кожу попало 10% или более концентрированной кислоты, кислоту необходимо быстро смыть под холодной проточной водой, а именно струей воды, затем промыть теплой водой и промокнуть туалетной бумагой. Вафельное или махровое полотенце — очень грубый материал, и если натереть им поврежденную кожу, истонченная кислотой кожа может порваться или полностью отслоиться. Если кислота успела разъесть кожу и образовалась обширная рана, рану следует закрыть стерильной медицинской салфеткой, смоченной перекисью водорода. очень важно не допустить высыхания раны или прилипания салфетки к меньшему количеству рубцов. Для того, чтобы салфетка дольше не высохла, ее можно накрыть пергаментом или калькой (не бумагой, бумага ее высушит быстрее), после чего рану забинтовать и срочно отправиться к врачу, чтобы он обработал рану специальными средствами (от гнойников, грибков и активизирующих заживление).
Если рана небольшая, ее необходимо смазать антисептическим или заживляющим составом, ни в коем случае нельзя мазать пораженные участки йодом или ярко-зеленым, а также использовать спиртосодержащие и спиртосодержащие препараты для промывания раны. Алкоголь вызывает ожог, затрудняя заживление, и может вызвать у пострадавшего болезненный шок.
При работе с оборудованием При работе с техническими весами: Убедившись, что розетка работает, поверхность чистая, возьмите весы и взвесьте вещества в стеклянной или бумажной капсуле. По окончании взвешивания выключите весы, затем выключите питание.При работе с электрической плитой: перед тем, как приступить к работе с плиткой, необходимо проверить исправность розетки, вилки и целостность изоляции провода. Не допускать соприкосновения провода с греющей поверхностью плитки. После окончания работы обязательно выключить плитку. Не выключенный прибор может привести к пожару.
2.2.5. Синтез вещества
На технических весах отвешивают 10,5 г карбоната магния, растворяют в 36,4 мл 30 серной кислоты. Происходит бурное пенообразование, поэтому нужно добавлять карбонат магния небольшими порциями при постоянном перемешивании и под вытяжкой. Раствор отфильтровать через складчатый фильтр. Во время фильтрации необходимо дополнительно нагреть раствор для растворения кристаллов, образующихся на стенках воронки и фильтра, чтобы избежать больших потерь вещества. Отфильтрованная проба жидкости не дала красного окрашивания с NH 4 SCN, что свидетельствует об отсутствии катионов железа. Раствор фильтруем и оставляем кристаллизоваться в шкафу. Слить маточный раствор с выпавших кристаллов в отдельную пробирку. Поместите полученные кристаллы между листами фильтровальной бумаги и просушите. После сушки полученные кристаллы перелили в бутыль для реактивов №2. 1, который мы будем использовать позже для дальнейшего анализа. Мы получили шести-водный сульфат магния MgSO4 *6H2 O. Оставшийся маточный раствор (V= 25 мл), который в связи с хорошей растворимостью сульфата магния при комнатной температуре (см. таблицу свойств) содержит его в растворенном состоянии, упариваем на водяной бане до появления пленки на поверхности жидкости и оставляем кристаллизоваться в шкафу. Просушите полученные кристаллы между листами фильтровальной бумаги, затем высушите в духовке при температуре 120 ° C. Полученные мелкие кристаллы поместить в ступку и растереть, после чего взвесить и пересыпать в банку для реактивов №2. Поскольку мы сушили при 120 ° C, мы получили смесь гидратов с 1, а может и с 2 молекулами воды.
Рассчитаем, какой получился выход вещества в банке для реактивов №1:
ω% (вещества) = mпр. * 100% / mтеор. Так как мы должны были получить безводный сульфат магния MgSO4 (M = 120,36 г/моль), а получили шестиводный MgSO4 *6H2 O (M = 228,458 г/моль), то необходимо сделать пересчет:mтеор = 15 *228,458/120,36 = 28,5 гω% (вещества) = 5,3 * 100% / 28,5 = 18,6%Практический выход в банке для реактивов №2:Так как мы должны были получить безводный сульфат магния MgSO4 (M = 120,36 г/моль), а получили смесь гидратов, то необходимо сделать пересчет:mтеор = 15 * 228,458/120,36 = 28,5 гω% (вещества) = 11,4 * 100% / 28,5 = 40% Практическая масса получилась много меньше, чем теоретическая, что связано с потерей вещества в результате фильтрования, так как в процессе фильтрования сульфат магния начал кристаллизоваться на стенках воронки и фильтра; так же в связи с его хорошей растворимостью в воде даже при комнатной температуре и большая часть вещества растворилась и перешла в в маточный раствор; много потерь было и при просушивании кристаллов между листами фильтровальной бумаги.
Анализ синтезированного соединения и возможных примесей , Подготовка к анализу:
1. оборудование и реактивы:
Оборудование:
- штатив с пробирками
- спиртовка
- держатель
- шпатель
- предметное стекло
- микроскоп
- стеклянная палочка
- универсальная индикаторная бумага
Реактивы (готовили лаборанты):
1. Гидроксид натрия –NaOH (2N);
2. гексацианоферрат (III) калия (красная кровяная соль) — К 3 [Fe(CN)6 ];
3. серная кислота — H 2 SO4 (2N);
4. карбонат калия — К 2 CO3 ;
5. азотная кислота — HNO 3 (2N);
6. перманганат калия – KMnO 4 ;
7. уксусная кислота — CH 3 COOН (2N);
8. хлорид кальция – CaCl 2 ;
9. медь- Cu;
10. этиловый спирт C 2 H5 OH;
11. сульфат аммония (NH 4 )2 SO4 ;
12. ацетат аммония CH 3 COONH4 ;
13. иодид калия KI;
14. сульфат калия K 2 SO4 ;
15. персульфат аммония NH 4 S2 O8 ;
16. нитрат серебра AgNO 3 ;
17. пероксид водорода H 2 O2 ;
18. гидрофосфат натрия Na 2 HPO4 ;
19. карбонат калия К 2 СО3 ;
20. дитизон C 13 H12 N4 S;
21. карбонат натрия Na 2 CO3 .
Оборудование:
- Весы технические
- Весы аналитические
- Колбы мерные на 50 и 100 мл
- Колба для титрования на 50 мл
- Стеклянная воронка
- Пробка резиновая для мерных колб
- Стеклянная палочка
- Ионообменные колонки с катионитом КУ-2 в Н – форме;
- Пипетки на 2, 5, 10 мл
- Пипетка глазная
- Шпатель
- Бутылки для хранения реактивов
- Универсальная индикаторная бумага
Реактивы:
1. Соляная кислота HCl конц (если есть, то 2 N);
2. Эриохром;
3. Сульфат магния MgSO 4 *7H2 Oкр ( если есть, то из фиксанал на сульфат магния);
4. ЭДТА кр (или из фиксанала);
5. Раствор аммиака NH3*H 2 O 25% и хлорид аммония NH4 Cl кр (если есть, то аммонийный буфер);
6. Эриохром;
7. Хлорид бария BaCl 2 кр;
8. хлорид магния MgCl 2 кр.
Все реактивы и растворы были приготовлены лаборантами.
2. Приготовление и стандартизация растворов для комплексонометрического определения Mg 2+ и SO4 2- .
Приготовить 50 мл 0,1N раствора MgSO 4
1) Расчет навески:
1. f э =1/2
2. М э = 120,36 * ½ = 60,18 г/моль
3. g т =CN *Vл *Mэ =0,1моль/л*0,050л*60,18г/моль=0,3009 г
m пуст.кап =0,3054 г
m кап.с в-вом теор. = 0,3054 + 0,3009= 0,6063 (г)
m кап.с в-вом = 0,6162 г
m кап.с ост. =0,3060 г
g практ. =0,3102 г
C N = gпракт / Vл *Mэ = 0,3102 г/0,05 л*60,18 г/моль=0,1030 моль/л
Nраствора MgSO 4 *7H2 O.
1 литр раствора):
1. Заполнить мерную колбу (V = 1 л) на 1/3 объема дистиллированной водой.
2. разбить капсулу фиксанала с навеской и высыпать ее в мерную колбу через сухую воронку. Промойте остатки образца из капсулы, воронки и горлышка колбы большим количеством воды.
3. Растворить соль. Если вещество плохо растворяется, слегка нагрейте колбу на горячей плите до полного растворения вещества.
4. Охладить колбу до комнатной температуры. Довести объем раствора в колбе дистиллированной водой до метки по нижней границе мениска (последнюю каплю воды добавлять глазной пипеткой).
5. Закрыть колбу пробкой и перемешать 15-20 раз. Содержимое колбы вылить в чистую посуду.
Nраствора ЭДТА.
1 литр раствора( метод описан в пункте 2.2.).
готовили лаборанты.
BaCl
N HCl : готовили лаборанты.
| № |
V уст.вещ-ва С N = 0,1 |
V ЭДТА | Условия титрования |
|
1 2 3 |
2 2 2 |
2 2 2 V ср = 2 |
1. Прямое, индикаторное титрование. 2.Титрант – ЭДТА. 3.В колбе для титрования 2 мл MgSO 4 ∙7H2 O+ 2мл аммонийного буфера + эриохром. 4. рН=10. 5. Титровать энергично перемешивая от винно-красной до синей окраски. Объем избыточной капли не вычитать. |
Расчеты:
1. C N (ЭДТА) = CN (MgSO4 ∙7H2 O)*V(MgSO4 ∙7H2 O)/V(ЭДТА) = 0,1моль/л * 2 мл / 2 мл = 0,1 (моль/л);
2. Т(ЭДТА) = C N (ЭДТА)*Мэ(ЭДТА)/1000 = 0,1моль/л * 186,12 г/моль / 1000 = 0,01861 (г/мл);
3. Т(ЭДТА/MgSO 4 ∙7H2 O) = CN (ЭДТА)*Мэ(MgSO4 ∙7H2 O)/1000 = 0,1моль/л * 123,235 г/моль / 1000 = 0,01232 (г/мл).
Качественный анализ сульфата магния и возможных примесей:
Анализ проводится согласно схемы 1по методике, описанной на стр 13 — 27.
Таблица 7
Качественный анализ сульфата магния
| № | исследуемое вещество | реагент | аналитический эффект | вывод |
| 1 | 2 | 3 | 4 | 5 |
| 1 | Сухая соль | Растворение в воде | Бесцветная прозрачная жидкость | Возможно присутствие только растворимых соединений |
| 2 | Раствор 1 | Дробно: H 2 SO4 +C2 H5 OH, |
Бесцветная однородная жидкость |
Ca 2+ — нет; Pb 2+ — нет |
| 3 | Раствор 1 | K 2 CO3 | Белый мутный осадок | Катионы тяжелых металлов |
| 1 | 2 | 3 | 4 | 5 |
| 4 | Раствор 5 |
Дробно: Cu + H 2 SO4 3 |
Бесцветная однородная жидкость |
NO 3 — — нет 5 |
| 5 |
Раствор 5 |
Дробно: CaCl 2 , микрокрист |
Белый осадок в виде игл (под микроскопом) | SO 4 2- — есть |
|
6 |
Раствор 5 |
Дробно: KMnO 4 + H2 SO4 , йодокрахмальная бумажка |
Бесцветная однородная жидкость |
Сl — — нет |
| 7 |
Осадок 9 |
HNO 3 |
Осадок растворяется, бесцветная однородная жидкость | Тяжелые металлы перешли в раствор |
| 8 | Раствор 10 |
H 2 SO4 + C2 H5 OH, центрифугируем |
Бесцветная однородная жидкость |
Ca 2+ — нет; Pb 2+ — нет; В растворе тяжелые металлы |
|
9 |
Раствор 11 |
Дробно: K 3 [Fe(CN)6 ] |
Бесцветная однородная жидкость | Fe 2+ — нет |
| 10 | Раствор 11 | NaOH изб | Белый мутный осадок | Катионы тяжелых Ме |
| 1 | 2 | 3 | 4 | 5 |
| 11 | Осадок 5.1. | H 2 O2 , t,центрифуг. |
Белый осадок |
Катионы тяжелых металлов |
| 12 | Осадок 6 |
NH 4 Cl насыщ, центрифуг. |
Бесцветная однородная жидкость | |
| 13 | Раствор 8 | Na 2 HPO4 + NH4 Cl |
Осадок |
Mg 2+ — есть |
По результатам качественного анализа обнаружены Mg 2+ и SO4 2- . В полученном веществе примесей обнаружено не было; сульфат магния химически чистый.
1.
Титрование анализируемого раствора. Таблица 8
| № | V соли | V ЭДТА | Условия титрования |
|
1 2 3 |
2 2 2 |
1,1 1,1 1,1 1,1 |
1. Прямое, индикаторное титрование. 2.Титрант – ЭДТА. 3.В колбе для титрования 2 мл MgSO 4 + 2 мл аммонийного буфера + сухой эриохром. 4. рН=10. 5. Титровать энергично перемешивая от винно-красной до синей окраски. Объем избыточной капли не вычитать. |
Расчеты:
1. C N (Mg2+ ) = CN (ЭДТА)*V(ЭДТА)/Vопр = 0,1*1,1 /2 = 0,0550 (моль/л);
- Полученная концентрация не согласуется с теоретической, что может указывать на то, что полученная соль представляет собой кристаллогидрат или что в соли присутствуют незначительные примеси.
2. Т(ЭДТА/Mg 2+ ) = CN (ЭДТА)*Мэ(Mg2+ )/1000 = 0,1*12,1525/1000 = 0,001215;
3. Т(ЭДТА/MgSO 4 ) = CN (ЭДТА)*Мэ(MgSO4 )/1000 = 0,1*60,18/1000 = 0,006018;
4.ω% пр (Mg2+ ) = [T(ЭДТА/ Mg2+ )*V(ЭДТА) * Vразв * 100] / [gпр. ( MgSO4 )*Vоп ] = [0,001215*1,1*50*100]/[0,3066*2] = 10,77%;
5. ω% теор (Mg2+ ) = М(Mg2+ )/М(MgSO4 ) = 24,305/120,36=0,2019 или 20,19%;
6. D абс = ωпр (Mg2+ ) — ωтеор (Mg2+ ) = 10,77% — 20,19% = 9,41%;
7. D отн. = Dабс *100% / ωтеор. ( Mg2+ ) = 9,41*100/20,19 = 46,65%;
8. ω% пр (MgSO4 ) = [T(ЭДТА/ MgSO4 ) *V(ЭДТА) *Vразв *100]/[gпр. (MgSO4 )*Vоп ] = [0,006018*1,1*50*100]/[0,3102*2] = 53,35%;
9. D абс = ωпр (MgSO4 ) — ωтеор (MgSO4 ) = 53,35% – 100% = -46,65%;
10. D отн. = Dабс *100% / ωтеор. ( MgSO4 ) = 46,65*100/100 = 46,65%.
Исходя из полученных расчетов, можно предположить, что анализируемое вещество кристаллогидрат, так как разница между ω % (MgSO4 ) теор и ω % (MgSO4 )практ существенна. Найдем процентное содержание воды в кристаллогидрате и выведем его формулу:
11. ω % расч (H2 O)= 100% — 53,35% = 46,65 %;
12. ω % теор (H2 O) =![]() ;
;
46,65 = ![]() ;
;
1801,53*n= 5615,17 + 840,42*n;
961,11*n= 5615,17;
- n=5,84~6.
Значит, получился гексагидрат MgSO 4 ∙ 6H2 O.
13. ω % (Mg2+ )теор =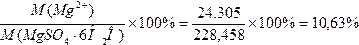 ;
;
14. D абс = ω теор. ( Mg2+ )- ω пр. (Mg2+ )=10,63 – 10,77 = -0,14 %;
15. D отн. = Dабс *100% / ω теор. ( Mg2+ )=0,14*100% /10,63 = 1,32 %.
| № | V опр | V ЭДТА | V ЭДТА хол. | Условия титрования |
|
1 2 |
20 20 |
1,05 1,05 V ЭДТАср 1,05 |
1,6 1,6 V ЭДТАср 1,6 |
1. Обратное, индикаторное титрование.. 2. Титрант – ЭДТА. 3. В колбе для титрования 10 мл анализируемого раствора + 5 мл ВаCl 2 + 5мл аммонийного буфера + эриохром. 4. рН=10. 5. Титровать энергично перемешивая от винно-красной до синей окраски. Объем избыточной капли не вычитать. |
2. Количественное определение SO 4 2- .
Определение сульфат — ионов Таблица 9
Расчеты:
1. С N (SO4 2- ) = CN (ЭДТА)*( V2 (ЭДТА) – V1 (ЭДТАхолл.оп ) )/ Vопр = 0,1 моль/л*(1,6 мл – 1,05 мл)/10 мл = 0,003000 (моль/л);
2. C N (SO4 2- ) исх. р-ра = CN (SO4 2- )разб. р-ра *10 = 0,00300*10 = 0,03000 (моль/л);
3. T(ЭДТА/SO 4 2- ) = CN (ЭДТА)*Mэ (SO4 2- ) /1000 = 0,1моль/л*48,031 г/моль/1000 = 0,004803 (г/мл);
4. T(ЭДТА/ (MgSO 4 )= CN (ЭДТА)*Mэ (MgSO4 )/1000 = 0,1 моль/л*60,18 г/моль/1000 = 0,006018 (г/мл);
Прежде чем рассчитывать ω % ( SO 4 2- )практ и ω % (MgSO4 ) практ нужно учесть, что для титрования использовалась не вся навеска. Рассчитаем её. Сначала навеску g= 0,3102 г растворили в мерной колбе на 50 мл, затем 10 мл пропустили через колонку, т.е. навеску, используемую для анализа можно рассчитать по формуле:
5. g’ = g *V опр /Vколбы = 0,3102*10 мл/50 мл = 0,06204 (г);
6. ω% (SO 4 2- )практ 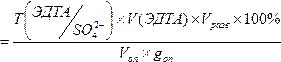 = 0,004803*0,55*100*100/(10*0,06204) = 42,57 %;
= 0,004803*0,55*100*100/(10*0,06204) = 42,57 %;
7. ω%(MgSO 4 )практ 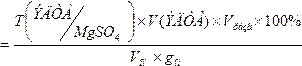 =
=
0,006018*0,55*100*100/(10*0,06204) = 53,35 %;
Исходя из полученных расчетов, можно сделать вывод, что анализируемое вещество кристаллогидрат, так как разница между ω % (MgSO4 )теор и ω% (MgSO4 )практ существенна.
8. ω % расч (H2 O)= 100% — 53,35% = 46,65 %;
9. ω % расч (H2 O) =![]() ;
;
46,65=![]() ;
;
1801,53*n= 5617,17 + 840,42*n;
961,11*n = 5615,7;
- n= 5,84~6.
Значит, получился гептагидрат MgSO 4 ∙ 6H2 O.
10. ω %( SO 4 2- ) теор =![]() ;
;
11. D абс = ω теор. ( SO4 2- )- ωпр . ( SO4 2- )= 42,10- 42,57 = -0,47%;
12. D отн . = Dабс *100% / ω теор. ( SO4 2- )=0,47*100 /42,10 = 1,12 ~ 1,1 %.
Можно рассчитать, сколько практически содержится воды:
13. ω% расч (H2 O) = 100% — ω% ( SO4 2- )практ — ω%( Mg2+ )практ = 100 – 42,57 – 10,77 = 46,66 %;
14. ω% расч (MgSO4 ) = (53,35+53,35)/2 = 53,35%;
15. ω% теор (MgSO4 ∙ 6H2 O) = 53,35 + 46,66 = 100,01 %;
16. D абс = ω теор. ( MgSO4 ∙ 6H2 O)- ω пр. ( MgSO4 ∙ 6H2 O)=100 – 100,01 = 0,01%;
17. D отн. = Dабс *100% / ω теор. ( Mg2+ ) = 0,01*100% /100 = 0,01%.
Итоговая таблица:
Таблица 10
|
W %. теор (MgSO 4 ∙ 6H2 O) |
W %.пр. | D абс. % | D отн. % | |
| Mg 2+ | 10,63 | 10,77 | 0,14 | 1,32 |
| SO 4 2- | 38,70 | 38,97 | 0,27 | 0,7 |
| MgSO 4 ∙ 6H2 O | 100 | 100,01 | 0,01 | 0,01 |
Результаты, полученные в ходе эксперимента, отличаются от рассчитанных теоретически. Следовательно, выбранные для анализа методы дают хорошие результаты. Но все равно имеется погрешность. Погрешности эксперимента могут иметь как систематический (несовпадение КТТ и ТЭ), так и случайный характер (связанны с тем, что не проводилась калибровка посуды, а также погрешности измерения объема и взвешивания).
Вероятно, источниками погрешностей могут быть: погрешности метода, или инструментальные погрешности, погрешности образцов сравнения, реактивная погрешность, т.к. все применяемые реактивы не могут быть абсолютно чистыми.
В ходе этой работы была выбрана методика синтеза соединения из литературы и разработана методика его качественного и количественного определения, а также любых примесей. проведен синтез этого соединения, его качественное и количественное определение. По результатам качественного анализа примесей не обнаружено, поэтому синтез прошел чисто. По результатам количественного анализа получено:
ω %пр (Mg2+ )= (10,77 ± 0,14)
ω %пр. (SO4 2- )= (38,97 ± 0,27)
ω %пр (MgSO4 *6H2 O)= (100,01 ± 0,01)
Погрешности могут быть как случайными, так и систематическими.
Методы, используемые в данной работе, не требуют специального оборудования, поэтому они достаточно распространены и часто используются в химической практике. Простота их использования и достаточная точность делают их оптимальными для наших условий, достаточная точность достигается точностью их исполнения. Сегодня существует огромное количество различных методов и приемов проведения анализов, которые имеют очень небольшую погрешность, но довольно сложны в использовании и требуют специальных знаний, а также, в большинстве случаев, дорогостоящего оборудования.
1. Корякин Ю.В., Ангелов И.И. Чистые химические вещества. 4-е изд., перераб. – М.: Химия, 1974. – 1575 с.
2. Лурье Ю.Ю. Справочник по аналитической химии. – М.: Химия, 1983. – 200 с.
3. Попова Л.Ф. Качественный анализ. Лаборатория аналитической химии: Методические разработки. 2-е изд., испр. – Архангельск: Изд-во ПГУ, 2005 – 146 с.
4. Попова Л.Ф. Количественный анализ. Лаборатория аналитической химии: Методические разработки. 2-е изд., испр. – Архангельск: Изд-во ПГУ, 2005 – 60 с.
5. Попова Л.Ф. Физико-химические методы анализа. Лаборатория аналитической химии: Методические разработки. 2-е изд., испр. – Архангельск: Изд-во ПГУ, 2005 – 105 с.
6.Ключников И.Р. Неорганический синтез. – М.: Просвещение, 1971. –320 с. с ил.
7. Справочник химика. Основные свойства неорганических и органических соединений. 2-е изд., перераб. и доп. – М.: Химия, 1964. – Т.2. – 1168 с.
8. Химические свойства неорганических веществ: Учеб. пособие для вузов. 3-е изд., испр./ Р.А. Лидин, В.А. Молочко, Л.Л. Андреева; Под ред. В.А. Лидина. – М.:Химия,2000. 480 с.: ил.
9. Химическая энциклопедия в пяти томах. /Под ред. И.Л.Кнунянц – М.: издательство «Советская энциклопедия »,1988, — Т.1. – 1250 с.
11.
12. http://www.chempack.ru/chemistry/details/magnesium_sulfate.html
Приложение 1
Сульфат магния
MgSO 4 *6H2 O№1
Приложение 2
Сульфат магния
MgSO 4 *6H2 O№2
