УКСУСНАЯ КИСЛОТА, CH3COOH, бесцветная горючая жидкость с резким запахом, хорошо растворимая в воде. Имеет характерный кислый вкус, проводит электрический ток.
Уксусная кислота была единственной, которую знали древние греки. Отсюда и ее название: «оксос» — кислое, кислый вкус. Уксусная кислота — это простейший вид органических кислот, которые являются неотъемлемой частью растительных и животных жиров. В небольших концентрациях она присутствует в продуктах питания и напитках и участвует в метаболических процессах при созревании фруктов. Уксусная кислота часто встречается в растениях, в выделениях животных. Соли и эфиры уксусной кислоты называются ацетатами.
Уксусная кислота — слабая (диссоциирует в водном растворе только частично).
Тем не менее, поскольку кислотная среда подавляет жизнедеятельность микроорганизмов, уксусную кислоту используют при консервировании пищевых продуктов, например, в составе маринадов.
Получают уксусную кислоту окислением ацетальдегида и другими методами, пищевую уксусную кислоту уксуснокислым брожением этанола. Применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов. Уксусная кислота участвует во многих процессах обмена веществ в живых организмах. Это одна из летучих кислот, присутствующая почти во всех продуктах питания, кислая на вкус и главная составляющая уксуса.
Цель данной работы: изучить свойства, производство и применение уксусной кислоты.
Задачи данного исследования:
1. Рассказать об истории открытия уксусной кислоты
2. Изучить свойства уксусной кислоты
3. Описать способы получения уксусной кислоты
4. Раскрыть особенности применения уксусной кислоты
1. Открытие уксусной кислоты
Строение уксусной кислоты заинтересовало химиков со времени открытия Дюма трихлоруксусной кислоты, так как этим открытием был нанесен удар господствовавшей тогда электрохимической теории Берцелиуса. Последний, распределяя элементы на электроположительные и электроотрицательные, не признавал возможности замещения в органических веществах, без глубокого изменения их химических свойств, водорода (элемента электроположительного) хлором (элементом электроотрицательным), а между тем по наблюдениям Дюма («Comptes rendus» Парижской академии, 1839) оказалось, что «введение хлора на место водорода не изменяет совершенно внешних свойств молекулы…», почему Дюма и задается вопросом «покоятся ли электрохимические воззрения и представления о полярности, приписываемой молекулам (атомам) простых тел, на столь ясных фактах, чтобы их можно было считать предметами безусловной веры; если же их должно рассматривать как гипотезы, то подходят ли эти гипотезы к фактам?… Должно признать, продолжает он, что дело обстоит иначе. В неорганической химии путеводной нитью нам служит изоморфизм, теория, основанная на фактах, как хорошо известно, мало согласных с электрохимическими теориями.
Производство уксусной кислоты
... 1 м3 древесины. Биохимический метод производства уксусной кислоты используют только для производства натурального пищевого уксуса. Появление синтетических методов производства уксусной кислоты связано с разработкой и промышленной ... вкус и главная составляющая уксуса. Строение уксусной кислоты заинтересовало химиков со времени открытия Дюма трихлоруксусной кислоты, так как этим открытием был нанесен ...
В органической химии ту же роль играет теория замещения… и может быть будущее покажет, что оба воззрения более тесно связаны между собою, что они вытекают из одних и тех же причин и могут быть обобщены под одним и тем же названием. Пока же на основании превращения У. кислоты в хлоруксусную и альдегида в хлоральдегид (хлорал) и из того обстоятельства, что в этих случаях весь водород может быть замещен равным ему объемом хлора без изменения основного химического характера вещества, можно вывести заключение, что в органической химии существуют типы, которые сохраняются и тогда, когда на место водорода мы вводим равные объемы хлора, брома и йода. А это значит, что теория замещения покоится на фактах и при том наиболее блестящих в органической химии». Приводя эту выдержку в своем годовом отчете шведской академии («Jahresbericht etc.», т. 19, 1840, стр. 370).
Берцелиус замечает: «Дюма приготовил соединение, которому он придает рациональную формулу C4Cl6O3+H2O (Атомные веса современные; трихлоруксусная кислота рассматривается, как соединение ангидрида с водою.); это наблюдение он причисляет к faits les plus eclatants de la Chimie organique; это — основание его теории замещения. которая, по его мнению, опрокинет электрохимические теории…, а между тем оказывается, что стоит только его формулу написать несколько иначе, чтобы иметь соединение щавелевой кисл. с соответственным хлоридом, C2Cl6+C2O4H2, который остается соединенным со щавелевой кислотою и в кислоте, и в солях. Мы, следовательно, имеем дело с таким родом соединения, примеров которого известно много; многие… как простые, так и сложные радикалы обладают тем свойством, что их кислородсодержащая часть может вступать в соединение с основаниями и их лишаться, не теряя связи с хлорсодержащей частью. Это воззрение не приведено Дюма и не подвергнуто им опытной проверке, а между тем, если оно верно, то у нового учения, несовместимого, по Дюма, с господствовавшими до сих пор теоретическими представлениями, вырвана из под ног почва и оно должно пасть». Перечислив затем некоторые неорганические соединения, подобные, по его мнению, хлоруксусной кислоте (Между ними Берцелиусом приведен и хлор ангидрид хромовой кислоты — CrO2Cl2, который он считал за соединение надхлорного хрома (неизвестного и по сие время) с хромовым ангидридом: 3CrO2Cl2=CrCl6+2CrO3), Берцелиус продолжает: «хлоруксусная кислота Дюма, очевидно, принадлежит к этому классу соединений; в ней радикал углерода соединен и с кислородом, и с хлором. Она может быть, следовательно, щавелевой кислотою, в которой половина кислорода замещена хлором, или же соединением 1 атома (молекулы) щавелевой кислоты с 1 атомом (молекулой) полуторохлористого углерода — C2Cl6. Первое предположение не может быть принято, потому что оно допускает возможность замещения хлором 11/2, атомов кислорода (По Берцелиусу щавелевая кислота была C2O3.).
Кислоты и основания с точки зрения различных теорий
... кислоты, которые не содержат кислород - синильную и сероводородную. Чуть позже Г. Дэви14 исследовал соляную и обнаружил там только хлор и . А первая теория кислот ... информация о кислотах и основаниях История кислот корнями уходит в далекое прошлое. Первой кислотой, которую человек ... сероводородную, мышьяковую, плавиковую, синильную, галловую и щавелевую кислоты. Первой в 1769 году он выделил винную ...
Дюма же держится третьего представления, совершенно несовместимого с двумя вышеизложенными, по которому хлор замещает не кислород, а электроположительный водород, образуя углеводород C4Cl6, обладающий теми же свойствами сложного радикала, как и C4H6 или ацетил, и способный якобы с 3 атомами кислорода давать кислоту, тожественную по свойствам с У., но, как видно из сравнения (их физических свойств), вполне от нее отличную». Насколько Берцелиус в то время был глубоко убежден в различной конституции уксусной и трихлоруксусной кислоты, видно хорошо из замечания, высказанного им в том же году («Jahresb.», 19, 1840, 558) по поводу статьи Жерара («Journ. f. pr. Ch.», XIV, 17): «Жерар, говорит он, высказал новый взгляд на состав спирта, эфира и их производных; он следующий: известное соединение хрома, кислорода и хлора имеет формулу = CrO2Cl2, хлор замещает в нем атом кислорода (Подразумевается Берцелиусом 1 атом кислорода хромового ангидрида — CrO3).
У. кислота C4H6+3O заключает в себе 2 атома (молекулы) щавелевой кислоты, из которых в одном весь кислород замещен водородом = C2O3+C2H6. И такой игрой в формулы заполнены 37 страниц. Но уже в следующем году Дюма, развивая далее идею типов , указал, что, говоря о тожестве свойств У. и трихлоруксусной кислоты, он подразумевал тожество их химических свойств, наглядно выражающееся, напр., в аналогии распадения их под влиянием щелочей: C2H3O2K + KOH = CH4 + K2CO8 и С2Cl3O2K + KOH = CHCl3 + K2CO8, так как CH4 и CHCl3 являются представителями одного и того же механического типа. С другой стороны, Либих и Греэм публично высказались за большую простоту, достигаемую на почве теории замещения, при рассмотрении хлоропроизводных обыкновенного эфира и эфиров муравьиной и У. кисл., полученных Малагутти, и Берцелиус, уступая давлению новых фактов, в 5-м изд. своего «Lehrbuch der Chemie» (Предисловие помечено ноябрем 1842 г.), позабыв свой резкий отзыв о Жераре, нашел возможным написать следующее: «Если мы припомним превращение (в тексте разложение) уксусной кислоты под влиянием хлора в хлорощавелевую кислоту (Хлорощавелевой — Chloroxalsaure — Берцелиус называет трихлоруксусную кисл. («Lehrbuch», 5 изд., стр. 629).), то представляется возможным еще другой взгляд на состав уксусной кислоты (уксусная кислота называется Берцелиусом Acetylsaure.), а именно — она может быть сочетанной щавелевой кислотой, в которой сочетающейся группой (Paarling) является C2H6, подобно тому, как сочетающейся группой в хлорощавелевой кислоте является C2Cl6, и тогда действие хлора на уксусную кислоту состояло бы только в превращении C2H6 в C2Cl6. Понятно, нельзя решить, является ли такое представление более правильным…, однако, полезно обратить внимание на возможность его».
Таким образом, Берцелиусу пришлось допустить возможность замещения водорода хлором без изменения химической функции первоначального тела, в котором происходить замещение. Не останавливаясь на приложении его воззрений к другим соединениям, перехожу к работам Кольбе, который для уксусной кислоты, а затем и для других предельных одноосновных кислот нашел ряд фактов, гармонировавших со взглядами Берцелиуса (Жерара).
Получение, свойства и применение кислот на основе хлора
... в настоящее время невелико. Растворы хлорноватой кислоты получают действием разбавленной серной кислоты на растворы солей например: В промышленности ... и фторирования. Для использования абгазной соляной кислоты взамен синтетической или ... хлором, а затем упаривают раствор до тех пор, пока его плотность не станет равной 1,35 г/см 3 . Процесс образования хлоратов при электролизе определяется влиянием ...
Исходной точкой для работ Кольбе послужило изучение кристаллического вещества, состава CCl4SO2, полученного ранее Берцелиусом и Марсэ при действии царской водки на CS2 и образовавшегося у Кольбе при действии на CS2 влажного хлора. Рядом превращений Кольбе (См. Kolbe, «Beitrage znr Kenntniss der gepaarten Verbindungen» («Ann. Ch. u. Ph.», 54, 1845, 145).) показал, что это тело представляет, выражаясь современным языком, хлор ангидрид трихлорометилсульфоновой кислоты, CCl4SO2 = CCl3.SO2Cl (Кольбе его назвал Schwefligsaures Kohlensuperchlorid), способный под влиянием щелочей давать соли соответственной кислоты — CCl3.SO2(OH) [по Кольбе НО + C2Cl3S2O5 — Chlorkohlenunterschwefelsaure] (Атомные веса: H=2, Cl=71, С=12 и О=16; а потому при современных атомных весах она — С4Сl6S2O6H2.) , которая под влиянием цинка замещает сначала один атом Сl водородом, образуя кислоту CHCl2.SO2(OH) [по Кольбе — wasserhaltige Chlorformylunterschwefelsaure (Берцелиус («Jahresb. » 25, 1846, 91) замечает, что правильные считать ее сочетанием дитионовой кислоты S2O5 с хлороформилом, почему он CCl3SO2(OH) называет Kohlensuperchlorur (C2Cl6) — Dithionsaure (S2O5).
Гидратная вода, по обыкновению, Берцелиусом не принимается во внимание.), а затем и другой, образуя кислоту CH2Cl.SO2(OH) [по Кольбе — Chlorelaylunterschwefelsaure], а, наконец, при восстановлении током или калиевой амальгамой (Реакция незадолго перед тем была применена Мельсансом для восстановления трихлоруксусной кислоты в уксусную.) замещает водородом и все три атома Сl, образуя метилсульфоновую кисл. CH3.SO2(OH) [по Кольбе — Methylunterschwefelsaure]. Аналогия этих соединений с хлороуксусными кислотами невольно бросалась в глаза; действительно, при тогдашних формулах получались два параллельных ряда, как видно из следующей таблички: H2O+C2Cl6.S2O5 H2O+C2Cl6.C2O3 H2O+C2H2Cl4.S2O5 H2O+C2H2Cl4.C2O3 H2O+C2H4Cl2.S2O5 H2O+C2H4Cl2.C2O3 H2O+C2H6.S2O5 H2O+C2H6.C2O3 Это и не ускользнуло от Кольбе, который замечает (I. с. стр. 181): «к описанным выше сочетанным сернистым кислотам и непосредственно в хлороуглеродсернистой кислоте (выше — H2O+C2Cl6.S2O5 ) примыкает хлорощавелевая кислота, известная еще под названием хлоруксусной кислоты. Жидкий хлороуглерод — ССl (Сl=71, С=12; теперь мы пишем C2Cl4 — это хлороэтилен.), как известно, превращается на свету под влиянием хлора в — гексахлорэтан (по тогдашней номенклатуре — Kohlensuperchlorur), и можно ожидать, что, если бы его одновременно подвергнуть действию воды, то он, подобно хлористому висмуту, хлорной сурьме и т. д., в момент образования, заместит хлор кислородом. Опыт подтвердил предположение». При действии света и хлора на C2Cl4, находившийся под водою, Кольбе получил на ряду с гексахлорэтаном и трихлоруксусную кислоту и выразил превращение таким уравнением: (Так как С2Сl4 может быть получен из CCl4 при пропускании его через накаленную) трубку, а ССl4 образуется при действии, при нагревании, Cl2 на CS2 то реакция Кольбе была первым по времени синтезом уксусной кислоты из элементов.) «Образуется ли одновременно и свободная щавелевая кисл., трудно решить, так как на свету хлор тотчас же окисляет ее в уксусную кислоту»… Воззрение Берцелиуса на хлоруксусную кислоту «удивительным образом (auf eine tiberraschende Weise) подтверждается существованием и параллелизмом свойств сочетанных сернистых кислот, и, как мне кажется (говорит Кольбе I. с. стр. 186), выходит из области гипотез и приобретает высокую степень вероятности. Ибо, если хлороуглещавелевая (Chlorkohlenoxalsaure так теперь Кольбе называет хлоруксусную кислоту.) имеет состав, подобный составу хлороуглесернистой кислоты, то мы должны считать и уксусную кислоту, отвечающую метилсернистой, за сочетанную кислоту и рассматривать ее, как метилщавелевую: C2H6.C2O3 (Это взгляд, высказанный ранее Жераром).
Не невероятно, что мы будем принуждены в будущем принять за сочетанные кислоты значительное число тех органических кислот, в которых в настоящее время, в силу ограниченности наших сведений — мы принимаем гипотетическиe радикалы… » «Что касается явлений замещения в этих сочетанных кислот, то они получают простое объяснение в том обстоятельстве, что различные, вероятно, изоморфные соединения способны замещать друг друга в роли сочетающихся групп (als Раarlinge, l. с. стр. 187), не изменяя существенно кислых свойств сочетанного с ними тела!» Дальнейшее экспериментальное подтверждение этого взгляда мы находим в статье Франкланда и Кольбе: «Ueber die chemische Constitution der Sauren der Reihe (CH2)2nO4 und der unter den Namen «Nitrile» bekannten Verbindungen» («Ann. Chem. n. Pharm. «, 65, 1848, 288).
Исходя из представления, что все кислоты ряда (CH2)2nO4, построены подобно метилщавелевой кислоте (Теперь мы пишем CnH2nO2 и называем метилщавелевую кислоту — уксусной.), они замечают следующее: «если формула H2O+H2.C2O3 представляет истинное выражение рационального состава муравьиной кислоты, т. е. если ее считать за щавелевую кислоту, сочетанную с одним эквивалентом водорода (Выражение не верно; вместо Н гг. Франкланд и Кольбе употребляют перечеркнутую букву, которая равноценна 2 Н.), то без труда объясняется превращение при высокой температуре муравьинокислого аммония в водную синильную кислоту, потому что известно, и найдено еще Доберейнером, что щавелевокислый аммоний распадается при нагревании на воду и циан. Сочетанный в муравьиной кислоте водород участвует в реакции только тем, что он, соединяясь с цианом, образует синильную кислоту: Обратное образование муравьиной кислоты из синильной под влиянием щелочей представляет не что иное, как повторение известного превращения растворенного в воде циана в щавелевую кислоту и аммиак, с тою лишь разницей; что в момент образования щавелевая кислота сочетается с водородом синильной кислоты». То, что цианистый бензол (С6H5CN), например, по Фелингу, не обладает кислыми свойствами и не образует берлинской лазури может быть, по мнению Кольбе и Франкланда, поставлено в параллель с неспособностью хлора хлористого этила к реакции с AgNO3, и правильность их наведения Кольбе и Франкланд доказывают синтезом по методу нитрилов (Нитрилы ими получались перегонкой серновинных кислот с KCN (методом Дюма и Малагутти с Лебланом): R’.SO3(OH)+KCN=R.CN+KHSO4) уксусной, пропионовой (по тогдашнему, мет-ацетоновой,) и капроновой кислоты, Затем, в следующем году Кольбе подверг электролизу щелочные соли одноосновных предельных кислот и, в согласии со своей схемой, наблюдал при этом, при электролизе уксусной кислоты, образование этана, угольной кислоты и водорода: H2O+C2H6.C2O3=H2+[2CO2+C2H6], а при электролизе валериановой — октана, угольной же кислоты и водорода: H2O+C8H18.C2O3=H2+[2CO2+C8H18] . Впрочем, нельзя не заметить, что Кольбе ожидал получить из уксусной кислоты метил (СН3 )’, соединенный с водородом, т. е. болотный газ, а из валериановой — бутил C4H9 , тоже соединенный с водородом, т. е. C4H10 (он называет C4H9 валлилом), но в этом ожидании надо видеть уступку получившим уже тогда значительные права гражданства формулам Жерара, который отказался от своего прежнего взгляда на уксусную кислоту и считал ее не за C4H8O4 каковой формулой, судя по криоскопическим данным, она обладает и на самом деле, а за C2H4O2 , как пишется во всех современных учебниках химии.
Работами Кольбе строение уксусной кислоты, а вместе с тем и всех других органических кислот было окончательно выяснено и роль последующих химиков свелась только к делению — в силу теоретических соображений и авторитета Жерара, формул Кольбе пополам и к переведению их на язык структурных воззрений, благодаря чему формула C2H6.C2O4H2 превратилась в CH3.CO(OH).
Свойства уксусной кислоты
Карбоновые кислоты — органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом.
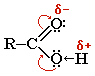 |
Карбоксильная группа сочетает в себе две функциональные группы — карбонил и гидроксил, взаимно влияющие друг на друга:
| |
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
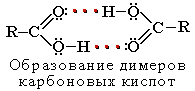 |
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
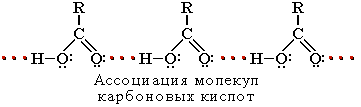 |
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
По числу карбоксильных групп кислоты подразделяются на одноосновные (монокарбоновые) и многоосновные (дикарбоновые, трикарбоновые и т.д.).
По характеру углеводородного радикала различают кислоты предельные, непредельные и ароматические .
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота . Часто используются также тривиальные названия.
Некоторые предельные одноосновные кислоты
| Формула | Название | |
| систематическое | тривиальное | |
| HCOOH | метановая | муравьиная |
| CH 3 COOH | этановая | уксусная |
| C 2 H5 COOH | пропановая | пропионовая |
| C 3 H7 COOH | бутановая | масляная |
| C 4 H9 COOH | пентановая | валерьяновая |
| C 5 H11 COOH | гексановая | капроновая |
| C 15 H31 COOH | пентадекановая | пальмитиновая |
| C 17 H35 COOH | гептадеканова | стеариновая |
функциональные производные
2.1Образование солей
а) при взаимодействии с металлами:
2RCOOH + Mg ® (RCOO) 2 Mg + H2
б) в реакциях с гидроксидами металлов:
2RCOOH + NaOH ® RCOONa + H 2 O
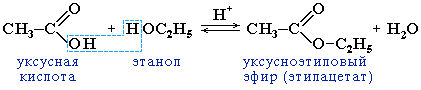 |
2.2 Образование сложных эфиров R’–COOR»:
Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации (от лат. ether — эфир).
2.3 Образование амидов:
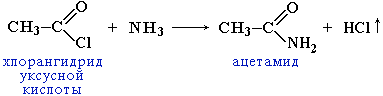 |
Вместо карбоновых кислот чаще используют их галогенангидриды:
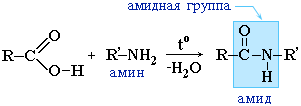 |
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из a-аминокислот с участием амидных групп — пептидных связей.
Уксусная (этановая кислота).
Формула: СН 3 – СООН; прозрачная бесцветная жидкость с резким запахом; ниже температуры плавления (т.пл. 16,6 градусов С) похожая на лед масса (поэтому концентрированную уксусную кислоту называют также ледяной уксусной кислотой).
Растворима в воде, этаноле .
Таблица 1. Физические свойства уксусной кислоты
| Название | Формула
кислоты |
tпл.
°C |
tкип.
°C |
r
г/см3 |
Раство-
римость (г/100мл H2O;25°C) |
Ka
(при 25°С) |
||
| кислоты | её соли
(эфиры) |
|||||||
| уксусная | этановая | ацетат | CH3COOH | 16,8 | 118 | 1,05 | ¥ | 1,7.10-5 |
Синтетическая пищевая уксусная кислота – бесцветная, прозрачная, легковоспламеняющаяся жидкость с резким запахом уксуса. Синтетическую пищевую уксусную кислоту получают из метанола и окиси углерода на родиевом катализаторе. Синтетическая пищевая уксусная кислота применяется в химической, фармацевтической и легкой промышленности, а также в пищевой промышленности в качестве консерванта. Формула СН 3 СООН.
Синтетическая пищевая уксусная кислота выпускается концентрированной (99.7 %) и в виде водного раствора (80 %).
По физико-химическим показателям синтетическая пищевая уксусная кислота должна соответствовать следующим нормам:
Таблица 2. Основные технические требования
| Наименование показателя | Норма |
| 1. Внешний вид | Бесцветная, прозрачная жидкость без механических примесей |
| 2. Растворимость в воде | Полная, раствор прозрачный |
| 3. Массовая доля уксусной кислоты, %, не менее | 99,5 |
| 4. Массовая доля уксусного альдегида, %, не более | 0,004 |
| 5. Массовая доля муравьиной кислоты, %, не более | 0,05 |
| 6. Массовая доля сульфатов (SO 4 ), %, не более | 0,0003 |
| 7. Массовая доля хлоридов (Cl),%, не более | 0,0004 |
| 8. Массовая доля тяжелых металлов осаждаемых сероводородом (Pb), %, не более | 0,0004 |
| 9. Массовая доля железа (Fe), %, не более | 0,0004 |
| 10. Массовая доля нелетучего остатка, %, не более | 0,004 |
| 11. Устойчивость окраски раствора марганцевокислого калия, мин, не менее | 60 |
| 12. Массовая доля веществ, окисляемых двухромовокислым калием, cm 3 раствора тиосульфата натрия, концентрация с (Na2 SO3 *5H2 O) = 0,1 моль/дм3 (0,1H), не более | 5,0 |
Синтетическая пищевая уксусная кислота – легковоспламеняющаяся жидкость, по степени воздействия на организм относится к веществам 3-го класса опасности. При работе с уксусной кислотой следует применять индивидуальные средства защиты (фильтрующие противогазы).
Первая помощь при ожогах — обильное промывание водой.
Синтетическую пищевую уксусную кислоту заливают в чистые железнодорожные цистерны, автоцистерны с внутренней поверхностью из нержавеющей стали, в контейнеры, емкости и бочки из нержавеющей стали вместимостью до 275 дм3, а также в стеклянные бутыли и полиэтиленовые бочки вместимостью до 50 дм3. Полимерная тара пригодна для залива и хранения уксусной кислоты в течение одного месяца. Синтетическую пищевую уксусную кислоту хранят в герметичных резервуарах из нержавеющей стали. Контейнеры, емкости, бочки, бутыли и полиэтиленовые фляги хранят в складских помещениях или под навесом. Не допускается совместное хранение с сильными окислителями (азотная кислота, серная кислота, перманганат калия и др.).
Транспортируется в ж/д цистернах, изготовленных из нержавеющей стали марки 12Х18H10Т или 10Х17H13М2Т, с верхним сливом.
3. Получение уксусной кислоты
Уксусная кислота — важнейший химический продукт, который широко используется в промышленности для получения сложных эфиров, мономеров (винилацетат), в пищевой промышленности и т.д. Мировое производство ее достигает 5 млн т в год. Получение уксусной кислоты до недавнего времени базировалось на нефтехимическом сырье . В Уокер-процессе этилен в мягких условиях окисляют кислородом воздуха до ацетальдегида в присутствии каталитической системы PdCl2 и CuCl2 . Далее ацетальдегид окисляется до уксусной кислоты:
CH2=CH2 + 1/2 O2 CH3CHO CH3COOH
По другому методу уксусную кислоту получают при окислении н-бутана при температуре 200 C и давлении 50 атм в присутствии кобальтового катализатора.
Изящный Уокер-процесс — один из символов развития нефтехимии — постепенно замещается новыми методами, основанными на использовании угольного сырья. Разработаны способы получения уксусной кислоты из метанола:
CH3OH + CO CH3COOH
Эта реакция, имеющая большое промышленное значение, является прекрасным примером, иллюстрирующим успехи гомогенного катализа. Поскольку оба компонента реакции — СН3ОН и СО — могут быть получены из угля, процесс карбонилирования должен стать более экономичным по мере роста цен на нефть. Существуют два промышленных процесса карбонилирования метанола. В более старом методе, разработанном на фирме BASF, использовали кобальтовый катализатор, условия реакции были жесткими: температура 250?С и давление 500-700 атм. В другом процессе, освоенном фирмой «Monsanto», применяли родиевый катализатор, реакцию проводили при более низких температурах (150-200 С) и давлении (1-40 атм).
Интересна история открытия этого процесса. Ученые компании исследовали гидроформилирование с использованием родийфосфиновых катализаторов. Технический директор нефтехимического отдела предложил использовать этот же катализатор для карбонилирования метанола. Результаты опытов оказались отрицательными, и это связали с трудностью образования связи металл-углерод. Однако, вспомнив лекцию консультанта компании о легком окислительном присоединении иодистого метила к металлокомплексам, исследователи решили добавить в реакционную смесь иодный промотор и получили блестящий результат, которому сперва не поверили. Подобное открытие было сделано также учеными конкурирующей компании «Union Carbide», те отстали всего на несколько месяцев. Команда по разработке технологии карбонилирования метанола всего через 5 месяцев интенсивной работы создала промышленный процесс Монсанто, с помощью которого в 1970 году было получено 150 тыс. т уксусной кислоты. Этот процесс стал предвестником той области науки, которая получила название С1-химии.
Механизм карбонилирования был тщательно исследован. Иодистый метил, необходимый для осуществления реакции, получается по уравнению
CH3OH + HI CH3I + H2O
Каталитический цикл может быть представлен так:
К плоскоквадратному комплексу [RhI2(CO)2]- (I) окислительно присоединяется иодистый метил с образованием шестикоординационного комплекса II, затем в результате внедрения СО по связи метил-родий образуется ацетилродиевый комплекс (III).
Восстановительное элиминирование иодангидрида уксусной кислоты регенерирует катализатор, а гидролиз иодангидрида дает уксусную кислоту.
Промышленный синтез уксусной кислоты:
a) каталитическое окисление бутана
2CH3–CH2–CH2–CH3 + 5O2 t 4CH3COOH + 2H2O
b) нагреванием смеси оксида углерода (II) и метанола на катализаторе под давлением
CH3OH + CO CH3COOH
Производство уксусной кислоты брожением (уксуснокислое брожение) .
Сырье: этанолсожержащие жидкости (вино, забродившие соки), кислород.
Вспомогательные вещества: ферменты уксуснокислых бактерий.
Химическая реакция: этанол биокаталитически окисляется до уксусной кислоты.
СН 2 – СН – ОН + О 2 СН 2 – СООН + Н 2 О
Основной продукт: уксусная кислота.
4. Применение уксусной кислоты
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов.
Водный раствор уксусной кислоты используют в качестве вкусового и консервирующего средства (приправа к пище, маринование грибов, овощей).
В состав уксуса входят такие кислоты, как яблочная, молочная, аскорбиновая, уксусная.
Яблочный уксус( 4% уксусной кислоты )
Яблочный уксус содержит 20 важнейших минеральных веществ и микроэлементов, а также уксусную, пропионовую, молочную и лимонную кислоты, целый ряд ферментов и аминокислот, ценные балластные вещества, такие, как поташ, пектин. Яблочный уксус широко применяется при приготовлении различных блюд и консервировании. Он прекрасно сочетается со всевозможными салатами, как из свежих овощей, так и мясными и рыбными. В нем можно мариновать мясо, огурцы, капусту, каперсы, портулак, а также трюфели. Однако, на Западе яблочный уксус известен больше своими лечебными свойствами. Он применяется при повышенном кровяном давлении, мигренях, астме, головной боли, алкоголизме, головокружении, артрите, болезнях почек, высокой температуре, ожогах, пролежнях и др.
Здоровым людям рекомендуется каждый день употреблять полезный и освежающий напиток: в стакане воды размешать ложку меда и добавить 1 ложку яблочного уксуса. Желающим похудеть, рекомендуем каждый раз во время еды выпивать стакан несладкой воды с двумя ложками яблочного уксуса.
Уксус широко используется в домашнем консервировании для приготовления маринадов различной крепости. В народной медицине уксус используется как неспецифическое жаропонижающее средство (путем протирания кожи раствором воды и уксуса в пропорции 3:1), а также при головных болях методом примочек. Распространено применение уксуса при укусах насекомых посредством компрессов.
Известно применение спиртового уксуса в косметологии. А именно для придания мягкости и блеска волосам после химической завивки и перманентной окраски. Для этого волосы рекомендуется ополаскивать теплой водой с добавлением спиртового уксуса (на 1 литр воды — 3-4 ложки уксуса).
Уксус виноградный ( 4% уксусной кислоты )
Виноградный уксус широко используется ведущими поварами не только Словении, но и всего мира. В Словении его традиционно используют при приготовлении различных овощных и сезонных салатов (2-3 ст. ложки на салатницу), т.к. он придает неповторимый и изысканный вкус блюду. Также виноградный уксус прекрасно сочетается с различными рыбными салатами и блюдами из морских продуктов. При приготовлении шашлыков из различных сортов мяса, но особенно из свинины, виноградный уксус просто незаменим.
Уксусная кислота применяется также для производства лекарственных средств.
Таблетки Аспирина (ЭС) содержат активный ингредиент ацетилсалициловую кислоту, которая представляет собой уксусный эфир салициловой кислоты.
Ацетилсалициловая кислота производится путём нагревания салициловой кислоты с безводной уксусной кислотой в присутствии небольшого количества серной кислоты (в качестве катализатора).
При нагревании с гидроксидом натрия (NaOH) в водном растворе ацетилсалициловая кислота гидролизуется до салицилата натрия и ацетата натрия. При закислении среды салициловая кислота выпадает в осадок и может быть идентифицирована по температуре плавления (156-1600С).
Другим методом идентификации салициловой кислоты, образующейся при гидролизе, является окрашивание её раствора в тёмно-фиолетовый цвет при добавлении хлорида железа (FeCl3).
Уксусная кислота, присутствующая в фильтрате, превращается при нагревании с этанолом и серной кислотой в этоксиэтанол, который можно легко распознать по его характерному запаху. Кроме того, ацетилсалициловая кислота может быть идентифицирована при помощи различных хроматографических методов.
Ацетилсалициловая кислота кристаллизуется с образованием бесцветных моноклинных многогранников или игл, немного кислых на вкус. Они стабильны в сухом воздухе, однако во влажной среде постепенно гидролизуются до салициловой кислоты и уксусной кислоты (Leeson и Mattocks, 1958; Stempel, 1961).
Чистое вещество представляет собой белый кристаллический порошок, почти не обладающий запахом. Запах уксусной кислоты свидетельствует о том, что вещество начало гидролизоваться. Ацетилсалициловая кислота подвергается эстерификации под действием щелочных гидроксидов, щелочных бикарбонатов, а также в кипящей воде.
Ацетилсалициловая кислота оказывает противовоспалительное, жаропонижающее, а также болеутоляющее действие, и ее широко применяют при лихорадочных состояниях, головной боли, невралгиях и др. и в качестве противоревматического средства.
Уксусная кислота используется в и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров), в производстве негорючих пленок, парфюмерных продуктов, растворителей, при синтезе красителей, лекарственных веществ, например, аспирина . Соли уксусной кислоты используют для борьбы с вредителями растений.
Заключение
Итак, уксусная кислота (CH3COOH), бесцветная горючая жидкость с резким запахом, хорошо растворимая в воде. Имеет характерный кислый вкус, проводит электрический ток. Применение уксусной кислоты в промышленности весьма велико.
Уксусная кислота, производимая в России, находится на уровне лучших мировых стандартов, пользуется высоким спросом на мировом рынке и экспортируется во многие страны мира.
Производство уксусной кислоты имеет ряд своих специфических требований, поэтому необходимы специалисты, имеющие широкий опыт не только в области автоматизации производства и управления процессами, но и четко понимающие специальные требования этой отрасли промышленности.
Список использованной литературы
[Электронный ресурс]//URL: https://drprom.ru/kursovaya/uksusnaya-kislota/
1. Артеменко, Александр Иванович. Справочное руководство по химии/ А.И. Артеменко, И.В. Тикунова, В.А. Малеванный. — 2-е изд., перераб. и доп. — М.: Высшая школа, 2002. — 367 с
2. Ахметов, Наиль Сибгатович. Общая и неорганическая химия: Учебник для студ. хим.-технол. спец. вузов/Ахметов Н.С.-4-е изд./ испр.- М. : Высшая школа, 2002.-743 с.
3. Березин, Борис Дмитриевич. Курс современной органической химии: Учеб. пособие для студ. вузов, обуч. по хим.-технол. спец./ Березин Б.Д., Березин Д.Б.-М.:Высшая школа,2001.-768 с.
4. И. Г. Болесов, Г. С. Зайцева. Карбоновые кислоты и их производные (синтез, реакционная способность, применение в органическом синтезе).
Методические материалы по общему курсу органической химии. Выпуск 5. Москва 1997 г.
5. Зоммер К. Аккумулятор знаний по химии. Пер. с нем., 2-е изд. – М.: Мир, 1985. – 294 с.
6. Караханов Э.А. Синтез-газ как альтернатива нефти. I. Процесс Фишера-Тропша и оксо-синтез // Соросовский Образовательный Журнал. 1997. № 3. С. 69-74.
7. Караваев М.М., Леонов Е.В., Попов И.Г., Шепелев Е.Т. Технология синтетического метанола. М., 1984. 239 с.
8. Катализ в С1-химии / Под ред. В. Кайма. М., 1983. 296 с.
9. Реутов, Олег Александрович. Органическая химия: Учебник для студ. вузов, обуч. по напр. и спец. «Химия»/Реутов О.А., Курц А.Л. Бутин К.П.-М.:Изд-во МГУ.-21 см. Ч. 1.-1999.-560 с.
10. Советский энциклопедический словарь, гл. ред. А.М. Прохоров — Москва, Советская энциклопедия, 1989
11. Химия: Справочное руководство, гл. ред. Н.Р. Либерман — Санкт Петербург, издательство «Химия», 1975
12. Химия: Органическая химия: Учебное издание для 10 кл. сред. шк. — Москва, Просвещение, 1993
Зоммер К. Аккумулятор знаний по химии. Пер. с нем., 2-е изд. – М.: Мир, 1985. С. 199.
И. Г. Болесов, Г. С. Зайцева. Карбоновые кислоты и их производные (синтез, реакционная способность, применение в органическом синтезе).
Методические материалы по общему курсу органической химии. Выпуск 5. Москва 1997 г. С. 23
Зоммер К. Аккумулятор знаний по химии. Пер. с нем., 2-е изд. – М.: Мир, 1985. С. 201
Караханов Э.А. Синтез-газ как альтернатива нефти. I. Процесс Фишера-Тропша и оксо-синтез // Соросовский Образовательный Журнал. 1997. № 3. С. 69
Зоммер К. Аккумулятор знаний по химии. Пер. с нем., 2-е изд. – М.: Мир, 1985. С. 258.
Зоммер К. Аккумулятор знаний по химии. Пер. с нем., 2-е изд. – М.: Мир, 1985. С. 264
