Коллигативные свойства разбавленных растворов, Коллигативные свойства
К коллигативным свойствам относят:
- повышение осмотического давления
- понижение давления насыщенного пара растворителя над раствором
- понижения температуры замерзания раствора (криоскопия)
- повышение температуры кипения раствора (эбуллиоскопия)
Осмос и осмотическое давление
Если разделить раствор и растворитель при помощи полупроницаемой перегородки ( мембраны ), пропускающей свободно молекулы растворителя и задерживающей молекулы растворенного вещества, то наблюдается односторонняя диффузия растворителя.
Такого рода диффузия обусловливается тем, что число молекул растворителя в единице объема больше, чем в таком же объеме раствора, так как в растворе часть объема занимают молекулы растворенного вещества. В результате молекулярного движения перемещение молекул растворителя через мембрану из растворителя в раствор преобладает над перемещением их в обратном направлении.
Односторонняя диффузия растворителя к раствору называется осмосом , а сила, обусловливающая осмос, отнесенная к единице поверхности полупроницаемой мембраны, называется осмотическим давлением .
В результате осмоса и диффузии выравнивается концентрация, причем способы, которыми достигается это выравнивание, принципиально различны. В процессе диффузии равенство концентраций достигается перемещением молекул растворенного вещества, а в случае осмоса — перемещением молекул растворителя.
Механизм осмоса нельзя объяснить только тем, что полупроницаемые мембраны играют роль сита с ячейками, через которые свободно проходят молекулы растворителя, но не проходят молекулы растворенного вещества.
По-видимому, механизм осмоса значительно сложнее. Здесь большую роль играют строение и состав мембраны.
В зависимости от природы мембраны механизм осмоса будет различен. В одних случаях через мембрану свободно проходят только те вещества, которые в ней растворяются, в других случаях мембрана взаимодействует с растворителем, образуя промежуточные непрочные соединения, которые легко распадаются, и, наконец, она может представлять и пористую перегородку с определенными размерами пор.
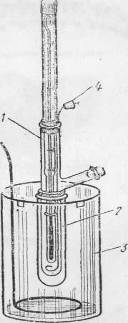
осмометром
Осмометр с раствором погружают в сосуд с растворителем. В начале процесса растворитель из наружного сосуда диффундирует в осмометр с большей скоростью, чем из него, поэтому уровень жидкости в трубке осмометра поднимается, что создает в ней гидростатическое давление, которое постепенно увеличивается. По мере увеличения гидростатического давления скорости диффузии растворителя в осмометр и из осмометра уравниваются, в результате чего наступает состояние динамического равновесия, подъем жидкости в трубке осмометра прекращается.
Обмен веществ и энергии. Теплообмен
... и межклеточных структур, входят в состав основного вещества хрящей, костей, кожи. Биосинтез белков определяет рост и развитие всего организма. 2.Ферментативная - могут ускорять химические процессы в организме. Все ферменты являются ...
Гидростатическое давление, установившееся в результате осмоса, служит мерой осмотического давления.
Измерение осмотического давления при помощи осмометра не всегда возможно с достаточной точностью, так как не существует мембран, способных задерживать все частицы растворенного вещества. Измеряемое значение осмотического давления для одного и того же раствора будет, следовательно, в какой-то мере зависеть от природы мембраны.
Осмотическое давление возникает лишь на границе между раствором и растворителем (или раствором другой концентрации), если эта граница образована полупроницаемой перегородкой. Раствор, содержащийся в обыкновенном сосуде, не оказывает на его стенки никакого иного давления, кроме обычного гидростатического. Поэтому осмотическое давление надо рассматривать не как свойство растворенного вещества, или растворителя, или самого раствора, а как свойство системы из растворителя и раствора с полупроницаемой перегородкой между ними.
Закон Вант-Гоффа для осмотического давления.
Росм ·V=n·R·T
где Росм — осмотическое давление в н/м 2 , V — объём раствора в м3
Закон Вант-Гоффа применим только к разбавленным «идеальным» растворам, в которых взаимодействие между молекулами растворенного вещества бесконечно мало.
Криоскопия, Температурой замерзания жидкости
Понижение температуры замерзания раствора связано с понижением давления пара над раствором по сравнению с чистым растворителем. Всякая жидкость начинает замерзать при той температуре, при которой она будет иметь такое же давление пара, каково оно над ее льдом.
Давление пара растворителя над раствором становится равным давлению пара над льдом, т.е. при более низкой температуре, чем Т о , и температура Т3 . отвечает точке замерзания данного раствора. Всегда Т3 .<То и понижение температуры замерзания ΔТ3 . = То — Т3 . растет с концентрацией
ΔТ 3 . = Е3 ·m,
где Е 3 — криоскопическая постоянная растворителя, m — моляльная концентрация.
Криоскопическая постоянная растворителя показывает понижение температуры замерзания, которое наблюдалось бы для раствора, содержащего на 1000 г растворителя 1 моль растворенного неэлектролита.
Криоскопическая постоянная не зависит от концентрации и природы растворенного вещества, а зависит только от природы растворителя.
криоскопией
Для Е 3 найдено
Е 3 = ![]()
где l -удельная теплота плавления растворителя, T — абсолютная температура его замерзания.
При смешивании соли со снегом или мелко раздробленным льдом происходит образование раствора, сопровождающееся сильным охлаждением вследствие большого поглощения теплоты льдом при его плавлении и солью при ее растворении. Охлаждающие смеси имеют большое практическое применение в лабораторной технике и промышленности.
Адсорбция паров летучих растворителей. Примеры конструкций адсорбционно-каталитических ...
... улавливание проводят компримированием паровоздушной смеси до небольшого давления с последующим ее пропусканием вначале через абсорбер, орошаемый растворителем, пары которого улавливают (при этом из паровоздушной ... введением в водный раствор до 25% порошкового активного угля с размером зерен до 100 мкм. 2.ПРИМЕРЫ КОНСТРУКЦИЙ АДСОРБЦИОННО-КАТАЛИТИЧЕСКИХ АППАРАТОВ 2.1 Адсорбционно-каталитический фильтр ...
антифризы
Из спиртов чаще всего используют этиловый спирт, глицерин и этиленгликоль. В зависимости от природы и отношений масс составных частей антифриз не замерзает при температуре от -15 до -55°С и ниже. Применяют антифризы для охлаждения цилиндров автомобильных, тракторных и авиационных двигателей при эксплуатации их в зимнее время, а также для заполнения противопожарных трубопроводов в не отапливаемых помещениях.
Эбуллиоскопия
Так как давление пара раствора всегда меньше давления пара растворителя, то раствор должен кипеть при более высокой температуре, чем растворитель. Для того чтобы раствор кипел, нужно достичь равенства между давлением пара над раствором и атмосферным давлением, а для этого он должен быть нагрет до более высокой температуры.
Повышение температуры кипения
ΔT К .=Tк .-То
ΔТ к , = Ек Т,
где ΔТ к — повышение температуры кипения, Ек — эбуллиоскопическая постоянная растворителя.
Эбуллиоскопическая постоянная растворителя показывает повышение температуры кипения, которое наблюдалось бы для раствора, содержащего на 1000 г растворителя 1 моль растворенного неэлектролита.
Эбуллиоскопическая постоянная не зависит от концентрации и природы растворенного неэлектролита, а зависит только от природы растворителя и имеет размерность град-моль.
эбуллиоскопией
Однако эбуллиоскопический метод из-за недостаточной точности и невозможности работать с веществами, разлагающимися при кипячении раствора, применяется реже криоскопического метода.
Понижение давления насыщенного пара растворителя
При испарении жидкости над ее поверхностью образуется пар. Процесс испарения обратим, одновременно с ним идет и конденсация пара. Когда скорость испарения и скорость конденсации сравняются, установится равновесие и насыщенный пар при данной температуре будет иметь постоянное давление.
нелетучего вещества
Давление насыщенного пара растворителя над раствором всегда меньше, чем над чистым растворителем.
Чем больше концентрация раствора, т.е. чем меньше молекул растворителя содержится в единице объёма, тем меньше давление насыщенного пара.
А) Давление насыщенного пара растворителя над раствором равно давлению его над чистым растворителем, умноженному на мольную долю растворителя.
Б) Относительное понижение давления насыщенного пара растворителя над разбавленным раствором нелетучего вещества равно молярной доле растворённого вещества.
А, Б — закон Рауля в разных формулировках.
Понижение давления насыщенного пара растворителя над раствором зависит не от природы растворителя и растворенного вещества, а определяется концентрацией последнего.
Оборудование для эбуллиоскопического и криоскопического определения молекулярных весов

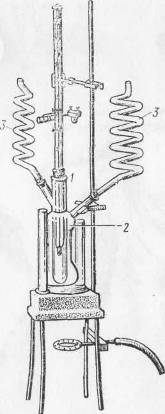
По физике «Влияние влажности воздуха и атмосферного давления ...
... и давление пара. Таким образом, плотность и давление насыщенного пара зависит от температуры: они увеличиваются с ростом температуры. Пар, ... человека и нарушает процесс теплообмена между человеческим организмом и окружающей средой. Большое значение имеет влажности воздуха, наряду с такими величинами, характеризующими состояние атмосферы, как давление, температура, ... оказаться на поверхности и, преодолев ...
Дифференциальный Аппарат для эбуллиоскопического определения
термометр Бекмана
Аппарат для криоскопического определения молекулярных весов молекулярных весов
Практическое значение осмоса
Осмос имеет большое значение в жизнедеятельности растительных и животных организмов. Известно, что все биологические ткани состоят из клеток. Каждая клетка имеет оболочку, внутри ее находится жидкость, которая представляет собой раствор различных веществ в воде. Оболочка клетки полупроницаема и через нее достаточно легко проходит вода.
Давлением, которое вызывается проникающей в клетки водой, объясняется упругость тканей растений, их плодов, листьев, стеблей, лепестков. Осмотическое давление в клетках зрелых плодов и овощей обычно колеблется от 0,49 до 0,98 МПа. В срезанных растениях, благодаря испарению воды объем внутриклеточной жидкости уменьшается, снижается давление и растение вянет. Увлажнение растений, погружение их в воду вызывает осмос и снова сообщает тканям упругость.
плазмолизом
Плазмолиз имеет большое значение при консервировании овощей и плодов в растворах поваренной соли или сахарозы.
При солении или квашении овощей поваренная соль является, во-первых, консервантом. Растворы соли (5-7 %) задерживают развитие большинства микроорганизмов, так как вызывают у них плазмолиз. Однако главное назначение поваренной соли заключается в том, что она вызывает плазмолиз растительных клеток, нарушает полупроницаемость клеточных оболочек. В результате происходит выделение клеточного сока, содержащего сахара. Эти сахара служат основой для молочнокислого брожения. Молочная кислота придает продукту специфический вкус и, являясь антисептиком, подавляет деятельность других микроорганизмов.
При варке плодов в концентрированном сахарном растворе (варка варенья) растительные клетки теряют воду, т. е. идет плазмолиз. Если скорость удаления воды больше, чем скорость диффузии сахара в плодовую ткань, то плоды после варки сморщиваются и становятся жесткими. Правильно выбранный режим варки предусматривает равенство скоростей этих процессов. В таком случае плоды сохраняют свой начальный объем и вид.
В данном случае сахар не только придает продукту вкусовые качества и питательность, но является и консервирующим веществом. В концентрированном сахарном растворе с высоким осмотическим давлением происходит плазмолиз клеток почти всех микроорганизмов.
изотоническими
физиологическим
обратного осмоса
Применение методов криоскопии и эбуллиоскопии
В лабораторной практике криоскопический метод нашёл значительно большее распространение по сравнению с методом эбуллиоскопии: измерять точки замерзания растворов значительно проще и безопаснее, чем их точки кипения. Но они являются основными методами для определения степени и константы диссоциации, а также коэффициента активности электролитов в растворах.
Хранение плодов и овощей
... химический состав плодов и овощей, классификацию и ассортимент плодов и овощей, процессы происходящие при хранении плодов и овощей. На примере плодоовощной базы «Гранд», рассмотреть, как происходит хранение плодов и овощей. 1.Состояние и ... полноте. С возрастом, даже при хорошем здоровье, наблюдается постепенное уменьшение физической активности человека: уже трудно так быстро бегать, так высоко ...
На понижении температуры замерзания жидкостей при растворении в них нелетучих веществ основано действие антифризов — веществ, добавление которых к охлаждающей воде в радиаторах автомобилей снижает температуру ее замерзания и предотвращает возможность «размораживания» двигателей.
Хладагенты, применяемые в химической технологии для доставки «холода» к теплообменникам, — обычно растворы каких-либо солей в воде.
В ряде случаев хладагенты готовят на специальных предприятиях и выпускаются под фирменными наименованиями, например, фреон, хладон, тосол. Используются такие хладагенты в бытовых и промышленных холодильниках, автомобилях, самолётах.
эбуллиоскопический криоскопический молекулярный растворитель
Использованная литература
[Электронный ресурс]//URL: https://drprom.ru/referat/zamerzanie-i-kipenie-rastvorov/
1. Б.В.Ахметов, Ю.П.Новиченко, В.И.Чапурин «Физическая и коллоидная химия»
— А.Б.Лукьянов «Физическая и коллоидная химия»
— К.И.Евстратова, Н.А.Кулина, Е.Е.Малахова «Физическая и коллоидная химия»
— М.И.Равич-Щербо, В.В.Новиков «Физическая и коллоидная химия»
— С.А.Балезин, Б.В.Ерофеев, Н.И.Подобаев «Основы физической и коллоидной химии»
