Становлення промислового органічного синтезу протікало в два етапи:
- Виділення органічних сполук з природного рослинного і тваринного сировини або його використання в процесах ферментативного синтезу;
- Виділення органічних речовин з кам’яновугільної смоли і організація на їх основі промислового виробництва (вуглехімічний синтез);
- Виділення органічних речовин з нафтової сировини і організація промислового виробництва на новій сировинній базі (нафтохімічний синтез).
Практично до середини 19 століття органічні речовини отримували, в основному, шляхом ферментації із сільськогосподарської сировини. Це такі продукти, як оцет, етиловий спирт, молочна і лимонна кислоти, гліцерин, ацетон та ін
Величезну роль у становленні промислового органічного синтезу зіграли досягнення і відкриття хіміків-синтетиків. Встановлення зв’язку між будовою речовини і його властивостями дозволяло планувати синтез сполук, що володіють певними споживчими властивостями. З іншого боку, зростала потреба розвивається капіталізму у збільшенні виробництва органічних продуктів, які не могла забезпечити сільськогосподарська сировинна база.
Новим великотоннажним джерелом органічних поєднанні стала кам’яновугільна смола-відхід виробництва металургійного коксу. У 1820-1850 рр.. в Німеччині почалося вивчення її складу та пошук способів виділення з неї таких компонентів, як бензол і його гомологи, нафталін і т.д. Спочатку було освоєно промислове отримання синтетичних барвників: алізарину, фуксину і індігоподобних речовин, раніше одержуваних з рослинної сировини. Паралельно було розпочато отримання вибухових речовин нитрованием кам’яновугільних толуолу (тол) і фенолу (пікринової кислота), а також покладено початок випуску таких лікарських речовин, як аспірин, салол, фенацитин та ін Створення власної вуглехімічній промисловості в США, Англії, Франції та Росії відноситься до початку 20 століття.
Сучасний промисловий органічний синтез можна умовно розділити на дві групи виробництв. Перша група включає основний (важкий) органічний синтез. Це великотоннажні, як правило, безперервні виробництва відносно більш простих органічних сполук, переважно використовуваних як напівпродуктів у більш складних синтезах. Процеси отримання органічних речовин різноманітні і засновані на реакціях окислення-відновлення, гідрування-дегідрування, гідратації-дегідратації, етерифікації, ізомеризації, сульфування, нітрування і т.д. Специфічні особливості деяких виробництв, заснованих на використанні певного виду сировини або типу реакцій, важливе значення цих виробництв в народному господарстві сприяли відділенню від основного органічного синтезу низки самостійних галузей. Прикладом можуть послужити виробництва пластичних мас, синтетичних каучуків і хімічних волокон.
Производство синтетического аммиака при среднем давлении. Расчёт колонны синтеза
... годов базировалось на дальнейшем совершенствовании технологических процессов и укрупнение агрегатов синтеза аммиака. По объёму производства синтетического аммиака азотная промышленность СССР вышла на второе место. В период с ... реакцию как гомогенную газовую реакцию, применять для синтеза водород “in statu nascendi”, найти катализаторы. Все эти работы не привели к положительным результатам и, более ...
До продуктів основного органічного синтезу відносяться спирти, альдегіди, кетони, карбонові кислоти та їх ефіри, галогенопохідні і нітропохідні аліфатичних і ароматичних вуглеводнів; олефіни, дієни та ін найважливішими з них є метанол, етанол, формальдегід, етилен, пропілен, бутадієн, ізопрен, окису етилену і пропилену, оцтовий альдегід і оцтова кислота, фенол, анілін і т.д.
Світове виробництво багатьох з цих продуктів перевищує 1млн. т на рік.
Друга група виробництв промислового органічного синтезу відноситься до так званого тонкого органічного синтезу. Це нерідко періодичні процеси, пов’язані з отриманням барвників, лікарських і запашних речовин більш складної структури, які виробляються в значно менших кількостях і базуються на використанні напівпродуктів, одержуваних промисловістю основного органічного синтезу.
Нафта, вугілля і газ як природні копалини складають основу сировинної бази промисловості органічного синтезу. У процесі переробки цих природних ресурсів отримують п’ять основних сировинних груп: парафіни, олефіни, ацетилен, ароматичні вуглеводні і синтез-газ. З цих джерел сировини отримують все різноманіття продуктів як основного, так і тонкого органічного синтезу. Ці ж джерела постачають сировину для стали самостійними галузей, що виробляють високомолекулярні сполуки, фармацевтичні препарати, барвники і т. п.
1. Загальні відомості
1.1. Фізичні властивості
Метанол (метиловий спирт) СН3ОН являє собою безбарвну легкорухливою рідина з температурою кипіння 64,65 оС, температурою кристалізації -97,9 оС і щільністю 0,792 т/м3. Критична температура метанолу дорівнює 239,65 оС.
Метанол змішується в усіх відношеннях з водою, спиртами, бензолом, ацетоном та іншими органічними розчинниками, утворюючи з деякими з них азеотропні суміші. Нерозчинний у аліфатичних вуглеводнях. У водних розчинах утворює евтектику, що містить 93,3% молекулярного метанолу.
Метанол добре розчиняє багато гази, у тому числі оксиди вуглецю, ацетилен, етилен і метан, внаслідок чого використовується в техніці для абсорбції домішок з технологічних газів.
Метиловий спирт у твердому стані існує у двох кристалічних формах, що переходять одна в іншу при -115,75 оС. Пари сухого метанолу утворюють з повітрям вибухові суміші з межами вибуховості: нижній 6% об’ємних і верхній 34,7% об’ємних. Метанол токсичний і дуже отруйний.
1.2. Хімічні властивості
Хімічні властивості метанолу типові для всіх одноатомних спиртів.
1. Реакції з розривом зв’язку О-Н:
а) реакції з лужними металами:
Производство метанола
... легкого каталитического крекинга) и твердого топлива (угля, сланцев). Исходный газ для синтеза метанола можно получить почти из всех видов сырья, которые используют при получении водорода, ... Выбор окислителя или их комбинации определяется назначением получаемого исходного газа (для синтеза метанола на цинк-хромовом или медьсодержащем катализаторах) и технико-экономическими факторами. В качестве ...
2СН 3 ОН +2 К? 2СН 3 ОК + Н 2?
Метанол більш слабка кислота, ніж вода. Його солі (алкоголяти) повністю гідролізуються:
СН 3 ОК + Н 2 О? СН 3 ОН + КОН
б) утворення складних ефірів під дією мінеральних і органічних кислот:
R-CO-OH + CH 3 OH? R-CO-O-CH 3 + Н 2 О
Атом водню відщеплюється від спирту, а група ОН — від кислоти.
2. Реакції з розривом зв’язку С-О.
а) слабкі основні властивості метанолу проявляються в оборотних реакціях з галогеноводородами:
CH 3 OH + HBr? CH 3 Br + H 2 O.
б) межмолекулярная дегідратація з утворенням простих ефірів:
2СН 3 ОН? СН 3-О-СН 3 + Н 2 О
3. Важлива промислова реакція — синтез формальдегіду:
СН 3 ОН +0,5 О 2? Н 2 СО + Н 2 О
2. Історичний нарис виробництва метанолу
Витоки вітчизняного основного органічного синтезу в нашій країні йдуть до 19 століття. Виробництво в той час велося примітивним способом на кубових батареях. Продукти виробництва мали обмежений попит.
Основна частина хімічної промисловості перебувала в руках іноземного капіталу. У 1917 році на частку іноземного капіталу припадало 56% всіх капіталовкладень в хімічну промисловість Росії.
Перша світова і громадянська війни завдали великої шкоди хімічної промисловості. Підприємства були зруйновані і розграбовані.
У 1925-27г.г. закінчився відновний період в хімічній промисловості і почалося інтенсивне будівництво нових заводів, створення нових виробництв. Таким чином вирішувалася основне завдання — задоволення внутрішньої потреби країни в хімічних продуктах.
У 30-х роках хімічна промисловість перетворилася на велику галузь народного господарства з добре розвиненою сировинною базою. У цей період було пущено багато нових хімічних підприємств
Розпочата незабаром друга світова війна завдала величезної шкоди хімічної промисловості. Після світової війни хімічна промисловість розвивалася прискореними темпами, що випереджають розвиток більшості інших галузей промисловості.
Вже до кінця 80-х років приріст виробництва хімічних продуктів склав 65% при загальному збільшенні виробництва промислової продукції на 35%.
Метанол вперше був виявлений Р. бойлер в 1661 році в продуктах сухої перегонки деревини (звідси назва метанолу — деревний спирт).
У чистому вигляді виділений в 1834 році Ж.Дюма і Е.Пеліго, що встановили його формулу, синтезований омиленням хлористого метилу М.Бертло в 1857 році.
Промислове виробництво метанолу синтезом з водню і оксиду вуглецю (II) вперше було здійснено в 1923 році і з тих пір безперервно удосконалюється. У нашій країні виробництво метанолу вперше організовано в 1934 році в обсязі 30 тонн на добу на Новомосковському хімічному комбінаті з водяного газу, одержуваного газифікацією коксу.
У нашій країні виробництво метанолу зросла в чотири рази в період з 1970 по 1985 роки.
3. Основні промислові способи виробництва метанолу
Сучасне виробництво метанолу представляє один з прикладів промислового органічного синтезу на основі синтез-газу (СО + Н 2) або оксиду вуглецю (II).
Численні технологічні схеми виробництва метанолу включають в себе три обов’язкові стадії:
- Очищення синтез-газу від сірчистих сполук, Карбоніли заліза і частинок компресорного масла,
- Власне синтез,
- Очищення і ректифікація метанолу-сирцю.
В іншому технологічні схеми розрізняються апаратурним оформленням і параметрами процесу. Всі вони можуть бути розділені на три групи.
1. Синтез при високому тиску проводиться на цинк-хромових каталізаторах при температурі 379-420 о С і тиску 20-35 МПа. В даний час цей процес застарів і витісняється синтезом при низькому тиску.
2. Синтез пери низькому тиску проводиться на цинк-мідь-аллюмінієвих каталізаторах або цинк-мідь-хромових каталізаторах при температурі 250-300 о С і тиску 5-10 МПа. Використання в цьому методі низькотемпературних каталізаторів, активних при більш низьких тисках, дозволяє знизити енерговитрати на стиснення газу і зменшити ступінь рециркуляції непрореагировавшего сировини, тобто збільшити ступінь його конверсії. Однак у цьому методі потрібне особливо тонке очищення вихідного газу від сполук, отруйних каталізатор.
3.Синтез в трифазній системі «газ — рідина — твердий каталізатор», що проводиться в суспензії з тонкодисперсного каталізатора та інертною рідини, через яку барботируют синтез-газ. Цим процес відрізняється від перших двох, які проводяться в двофазної системі «газ — твердий каталізатор». У трифазній системі може бути забезпечено більш сприятливий стан рівноважної системи, що дозволяє підвищити рівноважну концентрацію метанолу в реакційній суміші до 15% замість 5% при використанні двофазних систем, довівши ступінь конверсії вуглецю (II) до 35% замість 15% і ще більш зменшити рециркуляцію газу та енерговитрати.
Зросла потреба в метанолі викликала розробку нових перспективних методів його виробництва. Крім описаних вище методів трифазного синтезу до них відносяться:
- Синтез метанолу прямим окисленням метанолу повітрям на цинк-нікель-кадмієві каталізаторі, що дозволяє використовувати в якості сировини природний газ безпосередньо із свердловин;
- Спільне виробництво з синтез-газу метанолу і спиртів З 2-З 4 у вигляді так званої «спиртової композиції», використовуваної як добавка до моторного палива;
- Спільне виробництво метанолу та аміаку на основі конвертованого газу по маловідходних енерготехнологічна схемами, які забезпечують раціональне і комплексне використання сировини.
4. Застосування метанолу
Інтенсивний розвиток виробництво метанолу викликано різноманіттям і безперервним розширенням сфер його використання.
Метанол має широке і різнобічне застосування. Значна кількість його споживається у виробництві формальдегіду, він служить полупродуктом у виробництві метилацетату, фармацевтичних препаратів, запашних і інших речовин. У нафтопереробній промисловості його застосовують як розчинник лугу при очищенні бензинів від меркаптанів, а також при виділенні толуолу шляхом азеотропної ректифікації.
Метанол сировина для багатьох виробництв органічного синтезу. Основна кількість його витрачається на отримання формальдегіду Він служить проміжним продуктом в синтезі складних ефірів органічних і неорганічних речовин (диметилтерефталата, метилметакрилату, диметилсульфата), пентаежрітріта. Його застосовують як метіліруется кошти для отримання метиламіну і діметіланіліном, карбофосу, хлорофосу та інших продуктів. Метанол використовується також як розчинник і екстрагенту, в енергетичних цілях — як компонент моторних палив і для синтезу метил-трет-бутилового ефіру — високооктанової добавки до палива. Останнім часом намітилися нові перспективні напрями використання метанолу, такі як виробництво оцтової кислоти, очищення стічних вод, виробництво синтетичного протеїну, конверсія в вуглеводні з метою отримання палива. У таблиці 1 представлена структура споживання метанолу за основними напрямками в нашій країні і в Західній Європі (дані 1985 року).
Табл.1
|
Область застосування |
Наша країна |
Західна Європа |
|
1 |
2 |
3 |
|
Виробництво формальдегіду Виробництво СК Виробництво диметилтерефталата 1 |
34,6 12,6 1,8 2 |
42,4 — 4,3 3 |
|
Виробництво оцтової кислоти Компонент моторного палива Процеси метилування Інші напрямки використання |
2,0 1,0 4,7 43,3 |
6,0 6,3 10,7 30,3 |
Незважаючи але те, що частка метанолу використовуваного на виробництво моторного палива в даний час ще не велика, використання його для паливно-енергетичних цілей стало вельми перспективним. Це обумовлено можливістю отримання метанолу з будь-якого вуглецьвмісного сировини і необмеженими запасами його, що дозволяє використовувати метанол як напівпродукту у виробництві синтетичного моторного палива.
5. Вплив метанолу на навколишнє середовище, екологія при виробництві метанолу
Метанол — дуже токсична речовина (сильна отрута з яскраво вираженим кумулятивним дією).
При попаданні через органи дихання викликає важке отруєння. Метиловий спирт викликає тяжке подразнення шкіри, при попаданні на неї. При попаданні всередину отруйна діє на нервову і судинну системи. Гранично допустима концентрації становить 5 мг / м 3. Прийом всередину 5-10 мл приводить до важкого отруєння, доза 30 мл і більше може бути смертельною.
Найсерйознішої екологічною проблемою стали відходи промислового виробництва метанолу. Ви вже знаєте, якої шкоди вони завдають довкіллю. В даний час робляться спроби зменшити кількість відходів, що забруднюють навколишнє середовище. З цією метою розробляються і встановлюються найскладніші фільтри, будуються дорогі очисні споруди і відстійники. Але практика показує, що вони хоч і знижують небезпеку забруднення, все-таки не вирішують проблему. Відомо, що навіть при зробленому очищенні, включаючи біологічну, усі розчинені мінеральні речовини і до 10% органічних забруднюючих речовин залишаються в очищених стічних водах. Води такої якості можуть стати придатними для споживання тільки після багаторазового розведення чистою водою.
Очевидно, вирішення проблеми можливе при розробці та впровадженні у виробництво зовсім нових, замкнутих, безвідходних технологій. При їх застосуванні вода не буде скидатися, а буде багаторазово використовуватися в замкнутому циклі. Усі побічні продукти будуть не викидатися у вигляді відходів, а піддаватися глибокій переробці. Це створить умови для отримання додаткової потрібної людині продукції і убезпечить навколишнє середовище.
6. Техніка безпеки при виробництві метанолу
Технікою безпеки вважаються правила поведінки, які за умови їх неухильного дотримання збережуть життя і здоров’я людей від виникнення надзвичайних ситуацій.
Основними пунктами техніки безпеки при виробництві метанолу служать:
1) дотримання техніки протипожежної безпеки (повинні бути обладнані спеціальні кімнати для куріння і змонтована пожежна сигналізація);
2) робочі цехів повинні бути забезпечені спецодягом (гумові халати, гумові рукавички, прогумована взуття) і респіраторами;
3) проведення профілактичних заходів (за рахунок протипожежних і страхових фондів).
Небезпечними і шкідливими виробничими факторами є:
1) Можливість розгерметизації або руйнування використовуваного технологічного обладнання або апаратів з подальшим неконтрольованим закінченням горючих парів і газів з системи внаслідок: підвищення тиску в апаратах більше гранично допустимого значення, підвищення температур нагрівання метанолу, корозійного і механічного зносу.
2) Небезпека травмування обслуговуючого персоналу.
3) газонебезпечних. У низьких місцях, заглибленнях, де можуть утворитися вибухонебезпечні суміші газів з повітрям. Можливість удушення персоналу від браку кисню під час робіт. З метою виключення утворення вибухонебезпечних сумішей на майданчиках виробництва встановлюються сигналізатори довибухових концентрацій газів з подачею звукового і світлового сигналів.
4) електроопасності, обумовлена використанням в приводах холодильників і насосів електродвигунів напругою живлення 380В і вище, а також наявністю мереж автоматики та сигналізації.
7. Технологічна схема та короткий опис процесу виробництва метанолу
Реакція синтезу метанолу з синтез-газу являє гетерогенно-каталітичну оборотну екзотермічну реакцію, що протікає за рівнянням:
СО +2 Н 2? СН 3 ОН (а)
Тепловий ефект реакції зростає з підвищенням температури і тиску і для умов синтезу становить 110,8 кДж.
При синтезі метанолу паралельно з основною реакцією протікають побічні реакції:
СО +3 Н 2 = СН 4 + Н 2 О (б)
2СО +2 Н 2 = СН 4 + СО 2 (в)
СО + Н 2 = СН 2 О (г)
а також продукційна реакція утворення метанолу з міститься в синтез-газі оксиду вуглецю (IV):
СО 2 +3 Н 2 = СН 3 ОН + Н 2 О (д)
Крім цього, утворився метанол може піддаватися вторинним перетворенням по реакціях:
2СН 3 ОН = СН 3-О-СН 3 + Н 2 О
СН 3 ОН + nСО +2 NН 2 = СН 3 (СН 2) n-OH
СН 3 ОН + Н 2 = СН 4 + Н 2 О
Реакції (а-д) протікають з виділенням тепла і зменшенням обсягу, але розрізняються величиною теплового ефекту і ступенем контракції. Тому, хоча для всіх цих реакцій ступінь перетворення зростає із збільшенням тиску і зниженням температури, найбільшою мірою підвищення тиску впливає на рівновагу основної реакції синтезу (а), для якої ступінь контракції максимальна і становить 3:1.
Селективність процесу залежить від температури, тиску і властивостей каталізатора. Парогазова суміш, що виходить з контактного апарату, містить від 5 до 20% метанолу. Щоб змістити рівновагу в бік утворення метанолу, процес проводять з надлишком водню проти стехіометричного при співвідношенні СО: Н 2, рівному 1:4.
Схема синтезу метилового спирту представлена на рис.1. Суміш окису вуглецю і водню очищають від механічних домішок, від Н 2 S та інших сполук сірки, отруйних каталізатор. Очищений газ стискається в багатоступінчастому компресорі 1 до тиску 25 * 10 6 H / м 2. Після третього ступеня компресора газ очищується від двоокису вуглецю промиванням води, дожимается далі до робочого тиску синтезу і змішується з непрореагировавшего газами в змішувачі 2. У фільтрі 3, заповненому активованим вугіллям, газова суміш очищається від пентакарбоніла заліза Fe (CO) 5, що утворюється при взаємодії окису вуглецю зі сталевою апаратурою при високих тисках, і від машинного масла. Петакарбоніл заліза в колоні синтезу розкладається; на каталізаторі відкладається дисперсне залізо, що прискорюють побічні реакції утворення метану. Далі газ надходить у теплообмінник 4, де він у трубках нагрівається до 320 о С гарячими продуктами реакції, що проходять в міжтрубному просторі апарата. Нагрітий газ надходить у колону синтезу 5, де в шарі каталізатора утворюється метанол. Колона синтезу метанолу являє собою контактами апарат поличного типу. У верхній частині колони знаходиться катализаторная коробка з полицями для каталізатора і електродвигуном для підігріву газу в період пуску, у нижній частині — теплообмінник. Основний потік газової суміші, нагрітий у теплообміннику 4, вводиться у верхню частину колони 5 і надходить у шар каталізатора. Продукти реакції охолоджуються в трубках теплообмінника і виводяться через нижню частину колони. Продукти синтезу, що виходять з колони, охолоджуються до 100 о С в теплообміннику 4, а потім у холодильнику-конденсаторі 6 до 25-30 о С, де пари метанолу конденсуються. Утворилася рідкий метанол-сирець відділяється від непрореагировавших речовин в сепараторі 7 і збирається в збірнику 8, звідки направляється на ректифікацію. Прореагували продукти, що виходять з сепаратора 7, дотискати до робочого тиску 25 * 10 6 H / м 2 в циркуляційному компресорі 9 і надходять в змішувач 2.
Метанол-сирець піддається багаторазовій ректифікації, яка у поєднанні зі спеціальною очисткою дозволяє отримати чистий продукт.
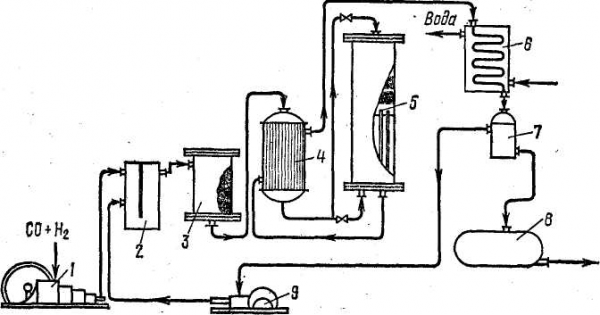
Рис.1 Схема виробництва метанолу
1-компресор, 2-змішувач, 3-фільтр, 4-теплообмінник, 5-колона синтезу, 6-холодильник-конденсатор, 7-сепаратор, 8-збірник, 9-циркуляційний компресор
8. Вихідні проектні дані
|
Вихідні проектні дані |
Варіант № 1 |
|
Продуктивність по спирту-сирцю, т / добу Склад спирту-сирцю,% мас СН 3 ОН (СН 3) 2 О Н 2 О Склад вступника синтез газу,% мас СО Н 2 СО 2 Вихід метанолу з даного СО,% |
10 94,5 1,5 4 19 76 5 15 |
Протікають реакції:
-
СО +2 Н 2 = СН 3 ОН + Q — основна
-
2CH 3 OH = (СН 3) 2 О + Н 2 О — побічна
9. Розрахунок і складання таблиці матеріального балансу
1
Метанол
(СН 3) 2 О
Н 2 О
СО 2
Непрореаг. СО
Н 2
- Будуємо діаграму матеріальних потоків:

Р
Е
А
До
Т
Про
Р
СО
Синтез-газ Н 2
СО 2
2. Молекулярні маси речовин:
М (СО) = 28 М (Н 2) = 2 М (СО 2) = 44 М (Н 2 О) = 18
М (СН 3 ОН) = 32 М ((СН 3) 2 О) = 46
3. Маса води в спирті сирці (кг / добу):
10000 * 0,04 = 400
4. Маса (СН 3) 2 О в спирті-сирці (кг / добу):
10000 * 0,015 = 150
5. Маса метанолу в спирті-сирці:
10000 * 0,945 = 9450
6. Маса метанолу в побічної реакції (кг / добу):
Х 150
2СН 3 ОН = (СН 3) 2 О + Н 2 О
Х-150
64-46
Х = 64 * 150/46 = 208,7
7. Загальна маса метанолу (кг / добу):
208,7 +9554,35 = 9763,05
8.Масса вступив у реакцію СО (кг / добу):
Х 9763,05
СО +2 Н 2 = СН 3 ОН
Х-9763, 05
28-32
Х = 28 * 9763,05 / 32 = 8542,67
9. Загальна маса СО 2 (кг / добу):
Х-100
8542,67-15
Х = 100 * 8542,67 / 15 = 56951,13
10. Маса синтез-газу:
56951,13-19
Х-100
Х = 100 * 56951,13 = 299742,79
11. Маса водню в синтез-газі (кг / добу):
299742,79 * 0,76 = 227804,52
12. Маса вуглекислого газу в синтез-газі (кг / добу):
299742,79 * 0,05 = 14987,14
13. Маса непрореагировавшего СО 2 (кг / добу):
56951,13-8542,67 = 48413,46
14. Маса води в побічної реакції (кг / добу):
208,7 Х
2СН 3 ОН = (СН 3) 2 О + Н 2 О
208,7-Х
64-18
Х = 208,7 * 18/64 = 58,7
15. Маса вступив у реакцію водню (кг / добу):
Х 9763,05
СО +2 Н 2 = СН 3 ОН
Х-9763, 05
4-32
Х = 9763,05 * 4/32 = 1220,38
16. Маса вступив у реакцію СО 2 (кг / добу):
Х 58,7
СО 2 +3 Н 2 = СН 3 ОН + Н 2 О
Х-58, 7
44-18
Х = 44 * 58,7 / 18 = 143,49
17. Маса вступив у реакцію Н 2 (кг / добу):
Х 58,7
СО 2 +3 Н 2 = СН 3 ОН + Н 2 О
Х-58, 7
6-18
Х = 6 * 58,7 / 18 = 19,57
18.Масса непрореагировавшего СО 2 (кг / добу):
14987,14-143,49 = 14843,65
19. Маса непрореагировавшего водню (кг / добу):
227804,52-1220,38-19,57 = 226564,37
20. Маса води на виході з реактора (кг / добу):
400-58,7 = 341,3
10. Таблиця матеріального балансу
|
№ |
Найменування |
Кг / добу |
% |
№ |
Найменування |
Кг / добу |
% |
|
1. |
Синтез-газ: СО 2 Н 2 СО |
14987,14 227804,52 56951,13 |
5 76 19 |
1. 2. 3. 4. 5. 6. |
Метанол (СН 3) 2 О Н 2 О СО 2 СО Н 2 |
9450 150 341,3 14843,65 48413,46 226564,37 |
3 0,05 0,1 5 16,25 75,6 |
|
Разом |
299742,79 |
100 |
Разом |
299742,79 |
100 |
11. Технологічні показники процесу
1. Загальна конверсія СО 2 і Н 2:
До СО2 і Н2 = m вих-m НеВсТа / m вих = 14987,14 +227804,52-226564,57-14843,65 / 14987,14 +227804,52 = 0,006 = 0,6%
2. Конверсія СО 2:
До СО2 = m вих-m НеВсТа / m вих = 14987,14-14843,65 / 14987,14 = 0,01 = 1%
3. Конверсія Н 2:
До СО2 і Н2 = m вих-m НеВсТа / m вих = 227804,52-226564,57 / 227804,52 = 0,005 = 0,5%
4. Витратні коефіцієнти по Н 2:
До т = М (Н 2) / М (СН 3 ОН) = 2/32 = 0,0625
До пр = m (Н 2) / m (СН 3 ОН) = 227804.52/9450 = 24,1
5. Витратні коефіцієнти по СО:
До т = М (СО) / М (СН 3 ОН) = 28/32 = 0,875
До пр = m (СО) / m (СН 3 ОН) = 56951,13 / 9450 = 6,02
12. Пропозиції щодо зниження собівартості цільового продукту
Собівартість — це сума витрат на виробництво і реалізацію продукції. Собівартість складається з вартості сировини і продуктів, вартості енергії і палива, зарплати персоналу, амортизації і цехових витрат.
У собівартість продукції включаються:
- Витрати безпосередньо пов’язані з випуском продукції, включаючи витрати на управління;
- Витрати на освоєння продукції нових видів;
- Витрати, пов’язані з поліпшенням якості продукції, з удосконаленням техніки і технології, організації виробництва, здійснювані в ході виробничого процесу (крім витрат, що здійснюються за рахунок капіталовкладень);
- Витрати на поліпшення умов праці, техніки безпеки, підвищення кваліфікації працівників;
- Витрати по збуту.
Розрізняють фабрично-заводську собівартість промислової продукції. Витрати, пов’язані з виробництвом продукції і наданням послуг, складають фабрично-заводську собівартість. До складу повної собівартості, крім цих витрат, включають позавиробничі витрати — на реалізацію продукції, підготовку кадрів, науково-дослідні і дослідні роботи.
У хімічній промисловості швидке зростання обсягів виробництва зумовив збільшення загальної суми витрат. Пошук шляхів зниження собівартості продукції залишається одним з найважливіших завдань хімічного виробництва.
Зниження собівартості продукції можна забезпечити скороченням витрат на сировину, енергію, реагенти, каталізатори, за рахунок збільшення обсягів виробництва на діючих установках, вдосконалення автоматизації, механізації та організації виробництва, а також ліквідації непродуктивних витрат і втрат всілякого роду.
З урахуванням структури собівартості продукції найбільше зниження її можна забезпечити поліпшенням використання сировини: за рахунок кращого підбору та підготовки сировини, стабілізації його складу, вдосконалення і стабілізації технологічного режиму, кращого підбору каталізаторів, застосування більш дешевої сировини.
Найважливіший джерело зниження собівартості продукції — підвищення інтенсивного та інтенсивного використання діючих виробничих потужностей. Інтенсивне використання діючих потужностей можна збільшити збільшенням потужності діючих установок. Екстенсивне використання діючих потужностей можна збільшити скороченням простоїв на ремонти, поліпшенням їх організації і зменшенням простоїв з організаційно-технічних причин (відсутність сировини, ємностей, перевантаження каталізаторів тощо)
В цілому по хімічній промисловості великі резерви зниження собівартості криються у вдосконаленні організаційної структури виробництва, методів управління і поліпшення матеріально-технічного постачання.
Для визначення найбільш істотних і раціональних шляхів зниження собівартості продукції в кожному конкретному випадку необхідний постійний детальний аналіз структури собівартості і її динаміки.
Література
1. Оганесян. Е.Т. Керівництво з хімії: довід. посібник. — М.: Вища. школа, 1987. — 399с., Мул.
2. Єрьоміна Є.О. та ін Довідник з хімії / Єрьоміна Є.О., Єрьомін В.В., Кузьменко Н.Є. — М.: Дрофа, 1996.-208с., Мул.
3. Мухленов І.П. Основи хімічної технології: підручник для студентів ВНЗ / Мухленов І, П,, Горштейн А.Є., Тумаркин Є.С., 4. Тамбовцева В.А. під ред Мухленова І.П. — 3-е вид. перераб. і доп. — М.: Вища. школа, 1983.,-335с, мул.
5. Соколов Р.С. Хімічна технологія: навчальний посібник для студентів ВНЗ: у 2 томах: Гуманит. Вид. центр ВЛАДОС, 2003.т.2.-368с., мул.
6. Максименко О. О. Хімія: навчальний посібник. — М.: Слово. 1999. — 638с.
7. Кузьменко Н.Є. Хімія для школярів. М.: Онікс 21 століття, 2002. — 544 с., Іл.
8. А.С. Єгоров. Хімія, посібник-репетитор. — М.: Фенікс, 2002. 767с., Мул.
9. Третьяков Ю.Д. Органічна хімія: підручник для студентів вузів. — 3-е вид. Перераб. -М.: Просвещение, 1997. — 287с.
10. Соколов К.П. Загальна хімічна технологія. М.: Просвещение, 1991. — 382 с.
11. Кондраков Н.П. Хімія. Підручник для шкіл. М.: Наука, 2004
Зміст
