Процессы гидролиза, гидратации, дегидратации, этерификации и амидирования имеют очень важное значение в промышленности основного органического и
синтеза. Гидролизом жиров, целлюлозы и углеводов давно получют мыло, глицерин, этанол и другие ценные продукты. В области органического синтеза рассматриваемые процессы используют главным образом для производства спиртов C2-C5, фенолов, простых эфиров, -оксидов, многих ненасыщенных соединений, карбоновых кислот и их производных (сложных эфиров, ангидридов, нитрилов, амидов) и других соединений.
Перечисленные вещества имеют очень важное применение в качестве промежуточных продуктов органического синтеза (спирты, кислоты и их производные, альдегиды, -оксиды), мономеров и исходных веществ для синтеза полимерных материалов (фенол, эфиры акриловой и метакриловой кислот, меламин, хлоролефины), пластификаторов и смазочных материалов (сложные эфиры), растворителей (спирты, простые и сложные эфиры, хлоролефины), пестицидов (эфиры карбаминовой и тиокарбаминовой кислот).
Очень часто рассматриваемые реакции являются промежуточным этапом в многостадийных синтезах других продуктов целевого назначения.
Производство перечисленных веществ имеет большие масштабы. Так, в США синтезируют по 500 тыс. т этанола и изопропанола, 900 тыс. т пропиленоксида, 200 тыс. т эпихлоргидрина, свыше 4 млн. т сложных эфиров, около 300 тыс. т изоцианатов.
1. Химия и теоретические основы процесса
Присоединение воды к олефинам всегда происходит по правилу Марковникова, вследствие чего из этилена образуется этанол, из пропилена и н-бутена – изопропанол и втор-бутанол, а из изобутена – трет-бутанол:
CH2=CH2 + H2O → CH3CH2OH
CH3CH=CH2 + H2O → CH3CHOHCH3
CH3CH2CH=CH2 + H2O → CH3CH2CHOHCH3
(CH3)2=CH2 + H2O → (CH3)3COH
Гидратация по тройным связям ацетилена и нитрилов дает карбонильные соединения – ацетальдегид и амид:
CH≡CH + H2O → CH3-CHO
RC≡N + H2O → RCONH2
Все эти превращения обратимы, однако отщепление воды от спиртов (и вообще от гидроксисодержащих соединений) может происходить в двух направлениях – как внутри — или межмолекулярное:
Уксусная кислота
... соединениям, перехожу к работам Кольбе, который для уксусной кислоты, а затем и для других предельных одноосновных кислот ... заключение, что в органической химии существуют типы, ... эфиры уксусной кислоты называются ацетатами. Уксусная кислота - слабая (диссоциирует в водном растворе только частично). Тем не менее, поскольку кислотная среда подавляет жизнедеятельность микроорганизмов, уксусную кислоту ...
C2H4 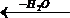 C2H5OH
C2H5OH 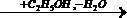 (C2H5)2O
(C2H5)2O
1. Термодинамика реакций
Рассмотрим равновесние основной реакции: гидратации — внутримолекулярной дегидратации:
RCH=CH2 + H2O ↔ RCHOH-CH3 
Она протекает с выделением тепла, следовательно, ее равновесие смещается вправо при понижении температуры. Дегидратации, наоборот, способствует нагревание. Изменение энергии Гиббса при гидратации этилена, пропилена и изобутена в зависимости от температуры представлено графически на рис. 1. Видно, что равновесие невыгодно для гидратации олефинов, так как при 150 – 3000С, когда катализаторы процесса достаточно активны, имеет большую положительную величину и равновесие смещено в сторону дегидратации. При этом для олефинов разного строения различия в термодинамике рассматриваемых реакций незначительны.
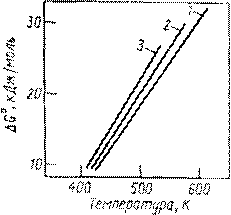
Рис. 1 Температурная зависимость изменения энергии Гиббса для гидратации этилена (1), пропилена (2) и изобутена (3)
Как показывает стехиометрия реакции, ни их равновесие можно влиять, изменяя давление. Внутримолекулярной дегидратации, идущей с увеличением числа молей веществ, способствует пониженное или обычное давление. Гидратации олефинов благоприятствует высокое давление, увеличивающее равновесную степень конверсии олефина. Так, последняя при 250 – 3000С и атмосферном давлении составляет всего 0,1 – 0,2%, что совершенно неприемлемо для практических целей, но при 7 – 8 МПа и тех же температурах она возрастает до 12 – 20%. Зависимость равновесной степени конверсии этилена при его гидратации от давления и температуры изображена на рис.2 причем аналогичные кривые характерны и для других олефинов. Очевидно, что гидратации способствуют одновременное снижение температуры и повышение давления.
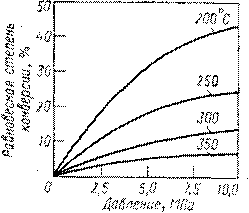
Рис. 2 Зависимость равновесной степени конверсии этилена в этанол от давления при разных температурах и соотношении C2H4 : H2O = 1 : 1
Рассмотрим теперь равновесие в системе межмолекулярная дегидратация спиртов – гидролиз простых эфиров:
2ROH ↔ ROR + H2O ![]()
В случае этанола ее равновесие описывается уравнением:
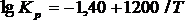
2. Механизм и кинетика реакций
Все рассмотренные реакции принадлежат к числу кислотно-каталитических процессов. Типичными катализаторами гидратации являются достаточно сильные протонные кислоты: фосфорная кислота на носителе, поливольфрамовая кислота, сульфокатионы. Для дегидратации используют фосфорную кислоту на носителе, оксид , серную кислоту, фосфаты (например, CaHPO4).
Роль катализаторов при гидратации состоит в протонировании олефина через промежуточное образование — и -комплексов, причем обратная реакция дегидратации идет через те же стадии, но в противоположном направлении:
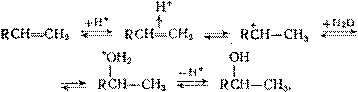
При межмолекулярной дегидратации карбокатион не отщепляет протон, а взаимодействует с другой молекулой спирта:
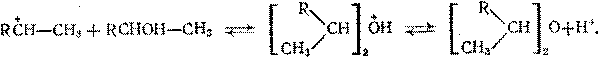
Электрофильный механизм гидратации олефинов определяет направление присоединения по правилу Марковникова, а также изменение реакционной способности олефинов в следующем ряду:
- CH3-CH=CH2 >
- CH3-CH2-CH=CH3 >
- CH3-CH=CH2 >
- CH2=CH2
CH3
определяемом сравнительной стабильностью промежуточных карбокатионов. Для разных условий и катализаторов отношение реакционных способностей олефинов меняется, составляя, например, для 80% серной кислоты 16000 : 1000 : 500 : 1 и увеличиваясь для выбора условий гидратации, особенно температуры: последняя может быть более низкой (и более благоприятной для равновесия) для изобутена по сравнению с пропиленом и особенно с этиленом.
Равновесие гидратации – дегидратации мало зависит от строения олефина и спирта, поэтому ряд реакционной способности олефинов к гидратации должен соответствовать аналогично ряду спиртов по их способности к дегидратации:
- Третичный >
- Вторичный >
- Первичный
Эта способность особенно растет у -кето — и -интроспиртов, электроакцепторные группы которых повышают кислотность атомов , находящихся при соседнем с ОН-группой углеродном атоме. Это нередко делает возможным некаталитическую дегидратацию или даже катализ реакции основаниями:
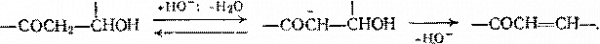
При гетерогенно-каталитической внутри — и межмолекулярной дегидратации в газовой фазе кинетика процесса описывается соответственно следующими уравнениями:
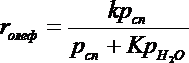
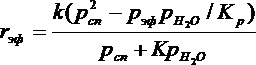
Они учитывают практическую необратимость внутримолекулярной дегидратации и тормозящее влияние спирта и воды, лучше адсорбирующихся на активных центрах катализатора.
При гидратации олефинов вода всегда находится в избытке, поэтому тормозящим влиянием спирта можно пренебречь:
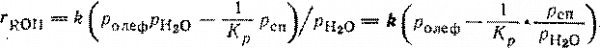
В ряде случаев роль воды более сложная. Так, фосфорная кислота, нанесенная на пористый носитель, образует на его поверхности жидкую пленку, которая абсорбирует воду из газовой фазы. При каждых данных температуре и парциальном давлении водяных паров в газовой фазе устанавливается фазовое равновесие, и фосфорная кислота в пленке имеет определенную концентрацию и соответствующую ей каталитическую активность. Последняя падает при снижении температуры и росте парциального давления воды, что ограничивает выбор этих параметров для каждого случая определенными рамками.
При катализе реакций гидратации – дегидратации при помощи сульфокатионов было найдено такое кинетическое уравнение:
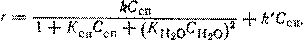
Первый его член соответствует катализу сульфогруппами катионита, а второй – специфическому катализу ионами гидроксония H3O+. Если количество воды в смеси мало, в уравнении преобладает первое слагаемое, сильно зависящее от концентрации воды; повышение этой величины ведет к преобладанию второго слагаемого.
3. Побочные реакции и селективность процесса
При гидратации олефинов наряду с основной реакцией протекают олигомеризация олефина (получение низкомолекулярных полимеров) и образование простого эфира. Все они идут через промежуточную стадию карбокатиона, что можно изобразить схемой:
H2O ![]() ROH
ROH ![]() ROR
ROR
R+ + Олефин ![]() Олигомеры
Олигомеры
Для состояния системы, далекого от равновесия, из этой схемы вытекает следующее уравнение селективности:
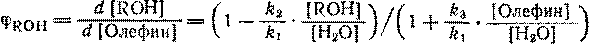
Из него видно, что селективность растет при наличии избытка воды по отношению к олефину и образующемуся спирту. Спирт более реакционно способен, чем вода [ ], по этому надо вести реакцию так, чтобы сохранился большой избыток воды по отношению к спирту (≈ 15:1).
], по этому надо вести реакцию так, чтобы сохранился большой избыток воды по отношению к спирту (≈ 15:1).
Выход олигомеров зависит от способности олефинов к полимеризации (изобутен > пропилен > этилен).
Образование олигомеров можно снизить, не только изменяя соотношение воды и олефина, но и уменьшая температуру, так как олигомеризация имеет более высокую энергию по сравнению с гидратацией. При приближении к равновесию скорость гидратации и селективность падают, что делает невыгодным проведение реакции до степеней конверсии, близких к равновесным. При этом для каждого олефина и катализатора имеется некоторый оптимум соотношения реагентов, степени конверсии и температуры, зависящей от производительности и селективности процесса.
Для дегидратации спиртов установлена схема превращений, по которой эфир способен к разложению на олефин и спирт:
ROH  R+
R+ 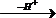 Олефин
Олефин
ROH 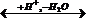 R+ ROR + H+ → ROH + Олефин + H+
R+ ROR + H+ → ROH + Олефин + H+
Внутримолекулярная дегидратация имеет более высокую энергию активации по сравнению с образованием простого эфира. По этой причине, а также из рассмотрения приведенной выше схемы следует, что дегидратацию с образованием ненасыщенной связи надо осуществлять при повышенной температуре и низком парциальном давлении или концентрации спирта. Дегидратацию с образованием простого эфира проводят при более низкой температуре, более высоких концентрации и парциальном давлении спирта и при неполной конверсии спирта в реакторе.
В результате рассматриваемых реакций нередко образуется еще один побочный продукт – альдегид или кетон, получающийся за счет дегидрирования спирта:
CH3CH2OH → CH3CHO
Протонные кислоты не катализируют эту реакцию, но она становится возможной при использовании некоторых носителей или оксидных катализаторов. Из последних наиболее селективны к дегидратации ThO2 и AI2O3, в то время как многие оксиды обладают смешанным, а другие – преимущественно дегидрирующим действием.
2. Гидратация олефинов и ацетилена
1. Гидратация олефинов
Гидратацией олефинов получают многие продукты.
Этанол C2H5OH является жидкостью, кипящей при 78,30С; с воздухом образует взрывоопасные смеси в пределах концентраций 3 – 20% (об.).
С водой дает азеотропную смесь, содержащую 95,6% спирта и кипящую при 78,10С. В виде такого ректификата этанол обычно и употребляют в технике.
Этанол принадлежит к числу многотонажных и широко применяемых продуктов органического синтеза. Он является хорошим, хотя и огнеопасным растворителем; в больших количествах используется в пищевой и ; служит горючим в жидкостных ракетных двигателях, антифризом и т. д. Как промежуточный продукт органического синтеза этанол имеет важное значение для получения сложных эфиров, хлороформа, хлораля, диэтиловго эфира, ацетальдегида и уксусной кислоты.
До недавнего времени производство этанола основывалось на пищевом сырье – сбраживание крахмала из некоторых зерновых культур и картофеля с помощью ферментов, вырабатываемых дрожжевыми грибками. Этот способ сохранился и до сих пор, но он связан с большими затратами пищевого сырья и не может удовлетворить промышленность. Другой метод, также основанный на переработке растительного сырья, заключается в гидролизе древесины (гидролизный спирт).
Древесина содержит до 50% целлюлозы, и при ее гидролизе водой в присутствии серной кислоты образуется глюкоза, которую подвергают затем спиртовому :
(C6H10O5)x + xH2O 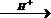 xC6H12O6
xC6H12O6
C6H12O6 → 2C2H5OH + 2 CO2
Синтетический этанол получают гидратацией этилена.
Диэтиловый эфир (серный эфир) (C2H5)2O – жидкость, кипящая при 34,60С. Он применяется главным образом как растворитель, но недостатком его является высокая пожароопасность. Ограниченные количества диэтилового эфира используют в медицине. Диэтиловый эфир образуется как побочный продукт при гидратации этилена, но эти количества не покрывают всей потребности, и его специально синтезируют из этанола:
2C2H5OH → (C2H5)2O + H2O
Изопропанол CH3CHOHCH3 – жидкость (т. кип. 82,50С), смешивающаяся с водой. Его пары дают с воздухом взрывоопасные смеси в пределах концентраций 2 – 12% (об.).
Образует с водой азеотропную смесь, содержащую 88% спирта и кипящую при 80,30С. Изопропанол нашел применение в качестве растворителя, заменяющего во многих случаях этанол. Кроме того, из него получают сложные эфиры, и т. д. Получают исключительно синтетическим путем, а именно гидратацией пропилена.
втор-Бутанол CH3CHOHCH2CH3 (т. кип. 99,50С) и трет-бутанол (CH3)3COH (т. кип. 82,80С) представляет собой бесцветные жидкости (первый ограниченно растворим в воде, второй смешивается с ней во всех отношениях).
Оба дают с водой азеотропные смеси соответственно с 68 до 78% спирта. Из этих спиртов большое значение имеет втор-бутанол. Он применяется как растворитель, а также для получения сложных эфиров и метилэтилкетона CH3COC2H5. Эти спирты получают гидратацией соответственно бутенов-1 и -2 или изобутена, в том числе фракции C4, освобожденной от бутадиена-1,3.
Простые эфиры изопропанола, втор — и трет-бутанола, получаемые побочно при гидратации соответствующих олефинов, нашли применение в качестве растворителей. Из них наибольшее значение имеет диизопропиловй эфир [(CH3)2CH]2O, менее огнеопасный во многих случаях заменить его в качестве растворителя.
1. Сернокислотная гидратация олефинов
Это был первый и сохранившийся в некоторых случаях метод гидратации олефинов. Он состоит в предварительной олефинов серной кислотой с образованием моно — и диалклсульфатов (эфиры серной кислоты) и их последующем гидролизе водой:
H2SO4 ![]() CH3CHR-OSO2OH
CH3CHR-OSO2OH ![]() (CH3RCH)2SO4
(CH3RCH)2SO4
CH3CHR-OSO2OH + H2O → RCHOHCH3 + H2SO4
(CH3RCH)2SO4 + H2O → CH3CHR-OSO2OH + RCHOHCH3
В зависимости от реакционной способности олефина и для подавления побочной полимеризации проводят абсорбцию при разных условиях: концентрация серной кислоты от 60 до 98%, температура от 0 до 700С, давление от 0,2 до 2 МПа. Соотношение серной кислоты и олефина берут таким, чтобы на 1 моль H2SO4 поглощалось 1,2 – 1,3 моль олефина, что сокращает расход кислоты. При этих условиях, а также за счет гидролиза сульфатов водой, содержащейся в серной кислоте, реакционная масса состоит из моно — и диалкилсульфатов, H2SO4, воды, спирта и побочных прдуктов – простого эфира и полимеров.
Для абсорбции этилена и пропилена серной кислотой применяют аппараты двух типов. Первый из них (рис. 3) является горизонтальным абсорбером с мешалкой, на валу которой укреплено большое число дисков. Внутреннее пространство абсорбера примерно на 1/3 заполнено серной кислотой, которая при вращении дисков образует туман, что повышает поверхность контакта фаз. Тепло реакции снимается водой, циркулирующей в рубашке. Этот аппарат работает периодически, но применение каскада из нескольких абсорберов позволяет перейти на непрерывный процесс.
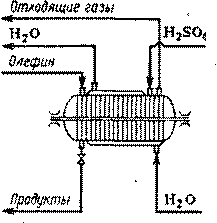
Рис. 3 Горизонтальный абсорбер с дисковой мешалкой
Более прогрессивны непрерывно действующие аппараты колонного типа с 20 – 25 колпачковыми тарелками с высоким уровнем жидкости на них (рис. 4).
На каждой тарелке в слое жидкости помещен трубчатый холодильник, через который циркулирует холодная вода, обеспечивающая отвод выделяющегося тепла. На верхнюю тарелку колонны подается свежая серная кислота необходимой концентрации, а из куба выходит реакционная масса заданного состава. Этилен (или пропилен) поступает снизу, противотоком к жидкости, барботирует через слой кислоты на каждой тарелке и выходит из колонны сверху, уже значительно разбавленным инертными примесями из исходного газа. В верхней части колонны имеется насадка, играющая роль брызгоуловителя.
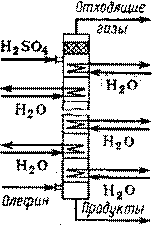
Рис. 4 Колонный тарельчатый абсорбер непрерывного действия
Полученная на первой стадии реакционная масса поступает затем на стадию гидролиза сульфатов. Жидкость разбавляют водой и нагревают острым паром, в токе которого отгоняют спирт, простой эфир и полимеры. Их разделяют отстаиванием и ректификацией, получая спирт с выходом 90%. Оставшаяся после гидролиза серная кислота имеет концентрацию 40 – 50%. Ее используют для получения сульфата или концентрируют, чтобы вернуть на абсорбцию и организовывать ее рециркуляцию. В наличии этой отработанной кислоты и необходимости ее утилизации состоит главный недостаток сернокислотной гидратации олефинов.
Разновидностью этого процесса является сернокислотный метод извлечения изобутена из C4-фракций. Он отличается тем, что спирт и алкилсульфат, содержащиеся в смеси, подвергают расщеплению с образованием не спирта, а изобутена, являющегося целевым продуктом.
2. Прямая гидратация олефинов
Прямая гидратация олефинов состоит в непосредственном присоединении воды по двойной связи в присутствии кислотных катализаторов. Их преимущества состоят в одностадийности процесса, отсутствии расхода серной кислоты или установок по ее регенерации, более высоком выходе спирта (≈ 95%), меньшей коррозии аппаратуры.
Наиболее распространенным катализатором для этого процесса является фосфорная кислота на твердом носителе (широкопористый силикагель, алюмосиликат).
Выбор параметров процесса обусловлен экономическими соображениями, особенно снижением энергетических затрат на получение пара и рециркуляцию непревращенных веществ. Температура противоположным образом влияет на равновесие и на скорость; кроме того, ее повышение ведет к усиленной полимеризации олефина и уносу фосфорной кислоты с носителя. Поэтому гидратацию этилена ведут при 260 – 3000С, когда для поддержания нужной концентрации H3PO4 в поверхностной пленке катализатора требуется высокое парциальное давление водяного пара (2,5 – 3,0 МПа).
Чтобы повысить степень конверсии водяного пара, получить не слишком разбавленный спирт и этим снизить расход энергии, работают при некотором избытке этилена – (1,4 – 1,6) : 1. Это предопределяет выбор общего давления 7 – 8 МПа, когда равновесная степень конверсии этилена равна 8 – 10%. Но фактическую степень конверсии поддерживают на уровне 4%, что позволяет работать при достаточно высоких объемной скорости (2000 ч-1) и удельной производительности катализатора по спирту (180-200 кг/(м3∙ч)), получая после конденсации 15% этанол.
Разбавление олефина инертными примесями неблагоприятно сказывается на равновесии и скорости реакции. Поэтому исходный олефин должен быть достаточно концентрированным (97 – 99%).
При его рециркуляции инертные примеси постепенно накапливаются, причем предельно допустимой считается 85% концентрация олефина в рециркулирующем газе. Для ее поддержания необходимо отдувать часть рециркуляционного газа.
Реакция проводится в аппарате непрерывного действия, который называют гидратором. Он представляет собой полую стальную колонну диаметром 1,5 и высотой 10 м. Во избежание коррозии под действием фосфорной кислоты выкладывают корпус и днище листами красной меди. Катализатор насыпают в реактор высоким слоем на опорный перфорированный конус. Смесь олефина и паров воды, предварительно нагретая до температуры реакции, поступает сверху, проходит слой катализатора и выводится из нижней части гидратора. Ввиду малой степени конверсии и небольшой теплоты реакции не нужно иметь в аппарате специальные устройства для охлаждения.
В процессе гидратации происходит постепенный унос фосфорной кислоты с поверхности носителя, и через 400 – 500 ч катализатор теряет активность. Для удлинения этого срока рекомендовано в процессе синтеза подпитывать катализатор фосфорной кислотой. Но и в этом случае катализатор со временем требуется заменять, так как на его поверхности появляются смолистые отложения, а носитель становится чрезмерно хрупким. Свежий катализатор готовят пропиткой носи– 65% фосфорной кислотой с последующей сушкой при 1000С. Он содержит 35% свободной фосфорной кислоты.
2. Гидратация ацетилена
Гидратация ацетилена по реакции Кучерова:
CH≡CH + H2O → CH3-CHO ![]()
долгое время была единственным промышленным методом получения ацетальдегида, но теперь имеется более эффективный способ его синтеза из менее дорогостоящего этилена. В связи с этим гидратация ацетилена стала малоперспективной.
Ацетальдегид является летучей жидкостью (т. кип. 20,80С), полностью смешивается с водой и дает с воздухом взрывоопасные смеси в пределах концентраций 4 – 57% (об.).
Применяют в крупных масштабах для производства уксусной кислоты, уксусного ангидрида, н-бутанола, пентаэритрита C(CH2OH)4 и других ценных продуктов. В присутствии кислот дает жидкий циклический триммер, называемый паральдегидом:
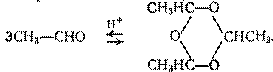
Реакция обратима, поэтому паральдегид можно во многих случаях использовать вместо ацетальдегида.
1. Гидратация с ртутным катализатором
Гидратация с ртутным катализатором, предложенным , проводится в жидкой фазе путем барботирования ацетилена через 10 – 20% серную кислоту, содержащую 0,5 – 0,6% HgO, который находится в растворе в виде HgSO4.
Реакция практически необратима и имеет не такой механизм, как гидратация олефинов. Считают, что образуется комплекс ацетилена с Hg2+, дальнейшие превращения которго ведут к получению ацетальдегида:
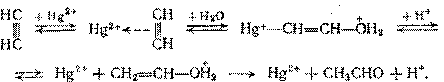
В указанных условиях наряду с гидратацией ацетилена протекают два побочных процесса – конденсация ацетальдегида с образованием кротонового альдегида и смол и восстановление ацетальдегидом солей ртути с превращением их в неактивную форму:
2CH3CHO → CH3CH=CHCHO + H2O → Смолы
CH3CHO + 2Hg2+ + H2O → CH3COOH + 2Hg+ + 2H+
Развитие побочных реакций можно в значительной степени уменьшить, снижая концентрацию альдегида в реакционной жидкости. Это достигают путем непрерывной отдувки образовавшегося ацетальдегида в токе непревращенного ацетилена, который подают на реакцию в 2 – 2,5-кратном избытке.
Ввиду крайней нежелательности восстановления ртутных солей и их быстрого дезактивирования на практике применяют еще один способ увеличения срока службы катализатора. В реакционный раствор добавляют соль трехвалентного железа, которая способна окислять восстановленную форму ртути снова в двухвалентное состояние:
Fe3+ + Hg+ → Fe2+ + Hg2+
Соль железа добавляют в избытке по отношению к ртути (4% в расчете на Fe2O3), поэтому катализаторный раствор работает достаточно длительное время. Но в нем постепенно накапливаются соли двухвалентного железа, и раствор направляют на регенерацию, состоящую в окислении кислотой. Несмотря на все эти мероприятия, ртуть все же теряется в виде шлама вместе с продуктами осмоления. Ее расход составляет 1,0 – 1,5 кг на 1 т ацетальдегида.
Схема реакционного узла жидкофазной гидратации ацетилена изображена на рис. 5. Реактором служит пустотелая колонна, футерованная кислотоупорными плитками и имеющая в верхней расширенной части слой насадки, играющей роль брызгоуловителя. Реактор заполнен катализаторной жидкостью описанного состава, через которую барботирует ацетилен, вводимый из колонны. Реактор не имеет поверхностей теплообмена и работает при 900С автоматически: выделяющееся тепло отводится за счет испарения воды, которая конденсируется в обратном холодильнике и возвращается в реактор. Часть катализаторного раствора непрерывно отводят на регенерацию и заменяют регенерированным раствором. Из газофазной смеси, выходящей из реакционного узла, абсорбируют водой ацетальдегид, возвращают ацетилен на реакцию, а водный раствор ацетальдегида подвергают ректификации.
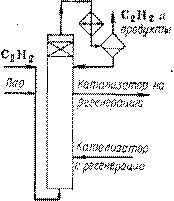
Рис. 5 Реакционный узел для гидратации ацетилена (жидкофазный процесс с ртутным катализатором)
2. Гидратация с нертутными катализаторами
Длительное время велись поиски нертутных катализаторов, которыми являются фосфорная кислота, фосфаты магния, цинка и кадимя. Все они менее активны по сравнению с ртутными солями и работают лишь при высоких температурах как гетерогенные катализаторы. Из них нашла практическое применение смесь состава CdHPO4∙Ca3(PO4)2, обладающая кислотными свойствами и содержащая кислотными свойствами и содержащая металл той же группы периодической системы, что и ртуть. Эта смесь активна при 350 – 4000С.
При газофазной гидратации ацетилена невозможно удалять ацетальдегид по мере его образования, вследствие чего побочная реакция кротоновой конденсации становится опасной. Она имеет более высокую энергию активности по сравнению с гидратацией, поэтому один из способов повышения селективности состоит в устранении перегрева и организации оптимального теплового режима процесса. Другой способ – применение большого избытка водяного пара и поддержание неполной конверсии ацетилена в реакторе, что ускоряет гидратацию, замедляя в то же время кротоновую конденсацию альдегида. При объемном соотношении водяного пара и ацетилена, равном (7 – 10) : 2, и 40 – 50% степени конверсии ацетилена выход ацетальдегида составляет 89%, а побочно образуется 6 – 7% кротонового альдегида, 0,5 – 1% уксусной кислоты и 0,3% ацетона.
Газофазную гидратацию ацетилена проводят в колонном аппарате с несколькими сплошными слоями катализатора (рис. 6).
Предварительно нагретую смесь водяных паров и ацетилена вводят в верхнюю часть реактора, а снизу отводят реакционные газы на конденсацию и разделение. Аппарат не имеет поверхностей теплообмена – съем выделяющегося тепла осуществляют за счет испарения водного конденсата, вбрызгиваемого в пространство между слоями катализатора. Они разделены, кроме того, колпачковыми тарелками, препятствующими попаданию брызг в последующие слои катализатора.
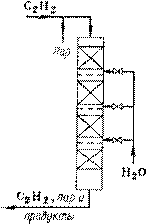
Рис. 6 Реакционный узел для гидратации ацетилена (газофазный процесс с гетерогенным нертутным катализатором)
Кроме сравнительно низкого выхода ацетальдегида, существенным недостатком газофазного процесса является небольшой срок службы катализатора – его приходится регенерировать каждые 100 ч. С учетом этого общий срок службы катализатора составляет 2500 ч.
3. Технология процесса получения этанола
Из-за малой степени конверсии реагентов и высоких температуры и давления при прямой гидратации этилена важнейшее значение имеют вопросы рециркуляции веществ и экономии энергии. Существующие схемы процессов заметно различаются, в особенности происхождением водяного пара, требуемого для синтеза, и степенью очистки целевого продукта. Водяной пар соответствующих параметров нередко берут со стороны или получают на этой же установке в трубчатой печи. В последнем случае можно организовать водооборот технологической воды. Схема такого процесса представлена на рис. 7.
Свежий и рециркулирующий этилен сжимают до 8 МПа в компрессоре 1 и циркуляционном компрессоре 2, смешивают с рециркулирующим водным конденсатом и нагревают в теплообменнике 4 горячими реакционными газами. Затем смесь дополнительно нагревают до 280 – 3300С в трубчатой печи 3 и подают в реактор 5. Реакционные газы содержат пары фосфорной кислоты, и их, прежде всего, нейтрализуют, впрыскивая водный раствор NaOH. Образующиеся фосфаты отделяют в солеотделиТепло газов утилизируют в теплообменник 4 и после дополнительного охлаждения в водяном холодильнике 7 разделяют жидкую и газовую фазы в сепараторе 8 высокого давления.
Газы еще содержат пары спирта, которые улавливают водой в абсорбере 9. Освобожденный от спирта газ рециркулируют с помощью компрессора 2, но часть его сбрасывают в линию топливного газа, чтобы избежать чрезмерного накопления инертных примесей. Водный конденсат после сепаратора 8 и жидкость из абсорбера 9 дросселируют и в сепараторе 10 низкого давления отделяют от растворенных газов, которые используют как топливо. Из сепаратора 10 вытекает 15% водный раствор этанола, содержащий диэтиловый эфир, ацетальдегид и низкомолекулярные полимеры этилена. Этот раствор подвергают ректификации в колоннах 11 и 12. В первой отгоняют наиболее летучие диэтиловый эфир и ацетальдегид, а во второй – этанол (в виде азеотропной смеси, содержащей 95% спирта и 5% воды), причем обогрев осуществляют острым паром. В кубе колонны 12 остается вода, которую очищают на ионообменной установке 13 от солей и возвращают на смешение с этиленом и гидратацию, организуя замкнутый водооборот технологической воды.
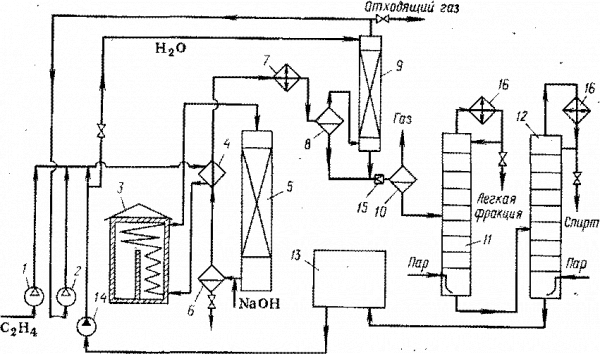
Рис. 7 Технологическая схема получения этанола
1,2. Компрессоры, 3. Трубчатая печь, 4. Теплообменник, 5. Реактор, 6. Солеотделитель, 7. Холодильник, 8, 10. Сепараторы, 9. Абсорбер, 11. Колонна отгонки легкой фракции, 12. Колонна отгонки этанола, 13. Установка ионообменной очистки оборотной воды, 14. Насос, 15. Дроссельный , 16. Конденсаторы
Список литературы
[Электронный ресурс]//URL: https://drprom.ru/kursovaya/etilovyiy-spirt-v-farmatsevticheskoy-tehnologii/
1. , Остроумов . М., Дрофа, 2008;
2. Чичибабин начала органической химии. М., Госхимиздат, 1963. – 922 с.;
3. Лебедев и технология основного органического и нефтехимического синтеза. М., Химия. 1988. – 592 с.;
4. , , Вишнякова нефтехимического синтеза. М., 1973. – 448 с.;
5. Юкельсон основного органического синтеза. М., «Химия», 1968.
