отравление углерод угарный газ токсикологическое
Угарный газ очень коварен, он совершенно не имеет запаха. Образоваться он может везде, где есть процесс горения, даже в духовке. Основная причина его образования — недостаток кислорода в зоне горения. И тогда вместо совершенно безобидного углекислого газа — продукта полноценного прогорания топлива — образуется тот самый угарный газ.
Отравление оксидом углерода может произойти очень незаметно. О присутствии газа нельзя узнать, пока не почувствуешь недомогание, а для отравления достаточно небольшого его количества.
Острые отравления СО могут иметь место на производстве, особенно в химической промышленности, при коксовании угля, в каменноугольных разработках, литейных цехах, когда в процессе производства образуется большое количество окиси углерода. Так, например, каменноугольный светильный газ содержит 4- 11 % СО, коксовый — 70 %, сланцевый -17 %, генераторный из угля и кокса — 27 %, доменный — до 30 %. Выхлопные газы автомобилей содержат в среднем 6,3%, а иногда до 13,5% СО. В кабинах автомашин концентрация СО может достигать О,05 мг на 1 л воздуха и более, на улицах городов в зависимости от загруженности их транспортом — от 0,004 до 0,21 мг/л, а вблизи автомашин — 1,5-7,1 мг/л. Опасность отравления СО в гаражах велика, если не соблюдать меры предосторожности (вентиляция).
Так, мотор мощностью 20 л. с. может выделить до 28 л СО в минуту, создав через 5 мин смертельную концентрацию газа в воздухе.
Физико-химические свойства и токсикологическое значение оксида углерода (II)
Оксид углерода(II) — монооксид углерода, угарный газ. Это газ без цвета и запаха, горит синим пламенем с образованием С02. В смеси с воздухом взрывается при зажигании. Он образуется при неполном сгорании топлива, в процессе выплавки и переработки черных и цветных металлов. Оксид углерода(II) содержится в выхлопных газах двигателей внутреннего сгорания, образуется при взрывных работах, при пожарах.
![]()
Окись углерода обладает выраженными свойствами восстановителя, ее молекула включает 2 ненасыщенные валентности ( ) и потому может присоединять ряд химических элементов. В этой связи должны быть упомянуты токсичные карбонилы металлов, например соединения окиси углерода с никелем и железом, которые используются в химической промышленности. Поступая в организм, карбонилы выделяют окись углерода:
Ы отравления угарным газом
... безобидного углекислого газа – продукта полноценного прогорания топлива — образуется тот самый угарный газ. Отравление оксидом углерода может произойти очень незаметно. О присутствии газа нельзя ... отравлений угарным газом. Отравление от вдыхания угарного газа все еще часто становится причиной смерти, несмотря на то, что общество осведомлено об этой опасности. Процесс отравления окисью углерода ...
(СО)4 → Ni + 4CO.
Тeтракарбонил никеля
Подобная реакция может протекать и при нагревании карбонилов, в особенности на активированном угле и других пористых материалах, а также при воздействии сильных окислителей, например хлора:
(CO)5 + Cl2 → 5CO + FeCl2.
Пентакарбонил железа
Как это на первый взгляд ни парадоксально, одним из источников окиси углерода является сам человек, организм которого производит я выделяет во внешнюю среду (с выдыхаемым воздухом) за сутки около 10 мл СО. Это так называемая эндогенная, т. е. образующаяся во внутренних средах организма, окись углерода. Многими исследователями было показано, что она отщепляется от молекул гемоглобина при его превращении в желчный пигмент билирубин. Поскольку билирубин образуется не только из гемоглобина, но и из других металлопротеидов (цитохромов, миоглобина, порфирина и др.), постольку последние также могут быть источником эндогенной СО. Таким образом, окись углерода является продуктом нормального метаболизма и ее выделение человеком в окружающую среду подобно удалению из организма углекислоты, аммиака и других образующихся в процессе обмена веществ химических соединений.
Хотя первые сведения о существовании эндогенной СО появились в литературе около 85 лет назад, только в последние десятилетия этому факту начали придавать существенное значение, что связано прежде всего с необходимостью обеспечения нормальной воздушной среды для специалистов, длительно находящихся в герметизированных помещениях (кабина самолета и космического корабля, кессон и т. п.).
Именно в таких условиях человек вынужден вдыхать воздух, в котором накапливается эндогенная окись углерода, и это может стать причиной аутоинтоксикации. Чтобы предупредить такое опасное явление, необходимо использовать специальные приспособления для поглощения окиси углерода.
Отравления оксидом углерода составляют более 17% среди общего числа отравлений. Основными их видами являются:
Отравления оксидом углерода(II), содержащимся в выхлопных газах автомобилей и других транспортных средств. Наблюдаются у лиц, длительно находящихся в закрытых гаражах и автомобилях с работающим двигателем (чаще всего в зимнее время).
Отравления от угорания в быту в помещениях с неисправным отоплением, в котельных бытовых и производственных зданий.
Отравления при пожарах лиц, находящихся в задымленных зданиях и помещениях (закрытые комнаты, квартиры), в вагонах транспорта и в лифтах.
Чувствительность людей разных возрастных групп к оксиду углерода различна. Новорожденные более выносливы и переносят такие концентрации оксида углерода(II) в воздухе, которые являются смертельными для взрослых.
Механизм токсического действия оксида углерода (II)
Проникая с атмосферным воздухом в легкие, окись углерода быстро преодолевает альвеолярно-капиллярную мембрану, растворяется в плазме крови, диффундирует в эритроциты и вступает в обратимое химическое взаимодействие как с окисленным, так и восстановленным гемоглобином по схеме:
Hb2 + CO HbCO + O2
или Hb + СО HbСО.
Образующийся патологический комплекс карбоксигемоглобин (НbСО) не способен присоединять к себе кислород. При этом в молекуле гемоглобина СО соединяется с атомами железа (карбонил), вытесняя кислород. Понятно, что одна молекула гемоглобина (точнее, 4 ее гема) может присоединить до 4 молекул СО.
Газовый состав крови
... растворимости. Коэффициенты растворимости для наиболее важных для дыхания газов при температуре тела таковы: кислород — 0,024: углекислый газ — 0,57; окись углерода — 0,018; азот — 0,012; гелий — ... капиллярного сплетения движение крови возле альвеол описывается как "сплошной лист" протекающей крови. Мембрана, через которую осуществляется газообмен между альвеолярным воздухом и кровью, известна как ...
Кровь весьма интенсивно поглощает окись углерода из-за высокого ее химического сродства к гемоглобину. Оказалось, что окись углерода примерно в 250 раз более активно связывается с гемоглобином, чем кислород. Иными словами, в конкуренции за гемоглобин окись углерода имеет выраженное преимущество перед кислородом. Расчет показывает, что при содержании в воздухе 0,07% СО и 21% О2 количество образующегося в крови НbO2 становится равным количеству НbСО. Такое равновесие может установиться, если во вдыхаемом человеком воздухе концентрация окиси углерода, близкая к 0,07% будет поддерживаться в течение многих часов (по некоторым данным, нескольких суток).
Вот почему небольшие количества окиси углерода, в том числе эндогенной, могут оказаться опасными при длительном воздействии на организм в замкнутых пространствах. Надо еще иметь в виду, что диссоциация карбоксигемоглобина происходит очень медленно (в 3500 раз медленнее, чем диссоциация оксигемоглобина), и это также способствует его накоплению в крови.
Чем выше концентрация СО в воздухе, тем быстрее достигается опасное для жизни содержание карбоксигемоглобина в крови, составляющее 50% и более по отношению ко всему гемоглобину (рис. 1).
Соотношение между количеством в крови НbСО и НbО2, с одной стороны, и концентрациями СО и О2 во вдыхаемом воздухе — с другой, принято оценивать с помощью константы Дугласа:
![]()
Эта величина, которая получила также название коэффициента отравления, показывает, что количество образующегося карбоксигемоглобина прямо пропорционально парциальному давлению окиси углерода и обратно пропорционально парциальному давлению кислорода. С другой стороны, чем больше во вдыхаемом воздухе (и, следовательно, в кровеносном русле) кислорода, тем меньше образуется НbСО и тем быстрее он диссоциирует.
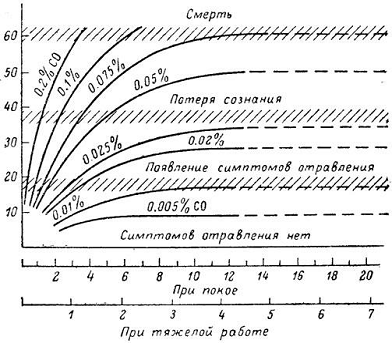
Рис. 1. График токсичности окиси углерода (Франке, 1973).
По оси ординат — содержание HbCO в крови, об. %; по оси абсцисс — время, ч
По данным различных авторов, величина К для крови человека колеблется от 204 до 279, т. е. во столько раз скорость образования НbСО превосходит скорость образования оксигемоглобина НbO2. Однако помимо парциального давления интенсивность поглощения кровью окиси углерода зависит также от длительности ее воздействия на организм и величины легочной вентиляции (минутного объема дыхания).
В этой связи определенный интерес представляет формула, предложенная Лилиенталем (1946 г.):
% НbСО = pCO•t•v•0,05,
где рСО — парциальное давление окиси углерода в мм рт. ст.; t — время воздействия в минутах; v — минутный объем дыхания, т. е. произведение глубины вдоха в литрах на число вдохов за 1 мин.
![]()
Очистка газов от оксидов азота
... положена задача создания такого способа очистки отходящих газов от оксида азота (I), который позволил бы добиться полной утилизации N2О (независимо от концентрации N2О в исходной смеси) ... углеводородами и оксидами азота на 30%, оксидами углерода на 90%. При неблагоприятных условиях в приземных слоях атмосферы образуются ядовитые туманы (смоги). В отработавших газах автомобильных двигателей ...
Итак, механизм действия окиси углерода определяется блокированием дыхательной функции гемоглобина и развитием вследствие этого гемического, или кровяного, типа кислородной недостаточности. Но степень интоксикации окисью углерода возрастает в связи с тем, что образовавшийся НbСО тормозит кислородную функцию нормального гемоглобина: в присутствии НbСО реакция диссоциации оксигемоглобина (НbO2 Hb+O2) замедляется и потому еще больше снижается поступление кислорода к клеткам. Вот почему НbСО, уменьшая поглощение кровью кислорода в легких, в то же время затрудняет разгрузку HbO2 в тканях. По-видимому, в этом следует искать объяснение случаев развития тяжелых интоксикаций при сравнительно небольшом количестве НbСО в крови (до 30%).
Поскольку химическое сродство к двухвалентному железу является основной причиной взаимодействия окиси углерода с гемоглобином, можно полагать, что и другие хромопротеиды, содержащие в своих молекулах ионы Fe2+, должны реагировать с этим ядом. Теперь уже не вызывает сомнений, что такого рода реакции могут в значительной степени влиять на течение интоксикаций. Имеется много экспериментальных данных, показывающих, что острые тяжелые отравления окисью углерода сопровождаются нарушением процессов потребления кислорода клетками. В основе этих нарушений лежит прежде всего блокирование ядом железосодержащих ферментов — цитохромов и цитохромоксидазы. Следовательно, при воздействии СО к гипоксии кровяного типа присоединяется тканевая гипоксия, в еще большей степени отягчающая течение интоксикации угарным газом. У отравленного отмечаются признаки нарастающего поражения центральной нервной системы: головная боль, головокружение, нарушение координации движений и рефлекторной сферы, а также ряд сдвигов психической деятельности, напоминающих алкогольное опьянение (эйфория, утрата самоконтроля, нецелесообразные поступки и т. п.).
Характерно покраснение кожи пораженных. Когда количество НbСО в крови превышает 50-60%, развиваются судороги, утрачивается сознание и, если не принять экстренные меры, человек может погибнуть вследствие остановки дыхания и работы сердца.
Симптомы отравления при различных концентрациях карбоксигемоглобина (НbСО) в крови приведены в таблице 1.
Таблица 1

На течение отравления оксидом углерода (II) оказывают влияние следующие факторы:
Этиловый спирт сдерживает насыщение крови оксидом углерода(II), и чем больше спирта в крови, тем меньше процент образования НbСО.
Синильная кислота способна усилить токсическое действие оксида углерода(II).
Синильная кислота выделяется при сгорании шерсти, полимеров, синтетических материалов (на пожарах).
Оксиды азота(II и IV) усиливают токсическое действие оксида углерода(II).
При отравлении наибольшие количества оксида углерода(II) обнаруживаются в синусах мозговых оболочек, сосудах бедра и плеча. Оксид углерода(II) выводится из организма через дыхательные пути за 1 ч на 60-70%, за 4 ч — на 90-96%.
Объекты исследования: кровь, мышцы (редко).
Обнаружение и определение оксида углерода(II)
Обнаружение и определение оксида углерода(II) проводится непосредственно в крови. С этой целью используются газохроматографический, химический, спектроскопический и спектрофотометрический методы анализа.
Основные методы анализа загрязнений воздуха
... загрязнений воздуха являются тепловые электростанции (ТЭС), работающие на каменном угле и выбрасывающие в атмосферу сажу, золу и диоксид серы; металлургические заводы, выбросы которых содержат сажу, пыль, оксид ... выбросов в атмосферу преобладают оксид углерода, углеводороды, оксиды азота, диоксид серы. Значительная часть поступающих в атмосферу оксида углерода и оксидов азота обусловлена работой ...
Газохроматографический метод
Данный метод основан на определении оксида углерода(II) с помощью парофазного анализа. Обнаружение проводят непосредственно в газовой фазе или после восстановления до метана или окисления до оксида углерода(IV).
— й вариант метода. К крови добавляют карбонат или гидрокарбонат натрия. Оксид углерода(II) переходит в газовую фазу. Ее отбирают шприцом и вводят в хроматограф. Используют детектор по теплопроводности (катарометр).
Обнаружение проводят по времени удерживания. Концентрацию оксида углерода(II) рассчитывают по калибровочному графику, выражающему зависимость площади пика от концентрации оксида углерода(II).
В таком варианте определение оксида углерода(II) в крови возможно при его содержании 30-100%. Ошибка метода составляет 10%.
-й вариант метода. Выделение оксида углерода(II) из крови проводят, как и в первом варианте. Газовую фазу вводят в дозатор прибора. В качестве газа-носителя рекомендован гелий, который вытесняет СО из дозатора и переносит в хроматографическую колонку с никелевым катализатором на ИНЗ-600. Под действием водорода СО восстанавливается до метана (СH4), появление которого в системе регистрируется пламенно — ионизационным детектором (ПИД).
Преимущество метода в высокой чувствительности и возможности проведения анализа с малыми навесками крови (0,1 мл).
3-й вариант метода основан также на применении парофазного анализа. В парогазовой фазе содержится смесь СО и С02 эндогенного происхождения. Используется колонка с силикагелем, на которой разделяются оксид углерода(IV) и оксид углерода(II).
Это разделение фиксируется детектором. Затем оксид углерода(II) в специальной ячейке окисляется оксидом йода(V) до оксида углерода(IV), и регистрируется общее количество С02. Концентрацию оксида углерода(II) определяют по разнице полученных пиков эндогенного С02 и суммарного количества С02.
Метод микродиффузии
Во внешнюю камеру прибора вносят 1 мл крови и 1 мл 10% раствора серной кислоты. Во внутреннюю камеру помещают 2 мл 0,1% раствора хлорида палладия в 0,1 М растворе хлороводородной кислоты. Прибор закрывают крышкой и оставляют на 1 ч при комнатной температуре. При наличии в крови оксида углерода(II) во внутренней камере появляется серебристая пленка металлического палладия.
![]()
Химический метод
Этот метод основан на том, что оксид углерода(II) образует с гемоглобином довольно прочное химическое соединение, которое плохо реагирует с другими реактивами.
Обнаружение карбоксигемоглобина химическим методом при отравлениях проводят непосредственно в крови с использованием различных реактивов. Для сравнения используют кровь животных или доноров (контрольная проба), с которой проводят те же испытания (табл. 2).
Таблица 2
Изменение окраски наблюдают путем сравнения контрольного и испытуемого образца после добавления различных реактивов. Кровь, содержащая карбоксигемоглобин, от прибавления химических реагентов не изменяет или незначительно изменяет окраску.
Заключение об обнаружении карбоксигемоглобина в крови дается, если с большинством реактивов будут получены указанные в таблице результаты.
Углерод и его основные неорганические соединения
... из углерода. Адсорбцией называют поглощение поверхностью твёрдых веществ газов и растворённых ... На долю углерода приходится 0,1% земной коры. В виде оксида углерода (IV) СО 2 углерод ... углерода связаны так же, как в графите. 4. Уголь – тонко измельчённый графит. Образуется при термическом разложении углеродсодержащих соединений ... форм углерода, уголь вступает в реакции легче, чем графит и тем более ...
Следует учитывать, что при легкой степени отравления и незначительном содержании карбоксигемоглобина возможно получение отрицательного результата.
Спектроскопический метод
Еще один метод, который используется для обнаружения в крови карбоксигемоглобина при отравлении оксидом углерода(II).
В практике химико-токсикологического анализа для этих целей используют микроспектроскоп — это спектроскоп, соединенный с окуляром. В основе метода — способность гемоглобина и его производных поглощать световое излучение определенной длины волны. Если луч света проходит через раствор, содержащий гемоглобин и его производные, в спектре появляются темные полосы поглощения.
Разбавленная кровь, не содержащая карбоксигемоглобина, при наблюдении в спектроскопе обнаруживает две полосы поглощения. Они располагаются между линиями Фраунгофера Д и Е в желтой и зеленой частях спектра, которые соответствуют оксигемоглобину. Если к крови добавить восстановитель (NH4)2S, оксигемоглобин восстанавливается в гемоглобин. При этом вместо 2 полос поглощения будет наблюдаться одна широкая полоса в той же области спектра. В разбавленной крови, направленной на химико- токсикологический анализ с подозрением на отравление оксидом углерода(II), также будут наблюдаться две темные полосы поглощения (рис. 2).

Рис. 2. Обнаружение карбоксигемоглобина методом спектроскопии
При добавлении к этой крови (NH4)2S восстановления не происходит. Две полосы поглощения не исчезают. Это говорит о высокой химической стойкости карбоксигемоглобина. Однако между этими четко выраженными полосами часто появляется небольшое затемнение за счет того, что несвязанный с оксидом углерода(II) оксигемоглобин восстанавливается до гемоглобина.
Спектрофотометрическое определение карбоксигемоглобина
По своей сущности этот метод можно отнести к дифференциальной фотометрии.
В крови людей и животных гемоглобин содержится в виде дезоксигемоглобина (Нb) и оксигемоглобина (Нb02) — продукта взаимодействия гемоглобина с кислородом. В крови может содержаться также небольшое количество метгемоглобина (MtHb).
При поступлении в организм оксида углерода(II) происходит образование карбоксигемоглобина за счет оксигемоглобина и дезоксигемоглобина. Метгемоглобин с оксидом углерода(II) не связывается. Все указанные соединения имеют характерные спектры поглощения в области 450-620 нм.
Метод определения карбоксигемоглобина основан на том, что при взаимодействии с восстановителями (дитионатом натрия, сульфидом аммония) все соединения гемоглобина (MtHb, Нb02) за исключением карбоксигемоглобина (СОНb) восстанавливаются до дезоксигемоглобина.
Спектр поглощения дезоксигемоглобина имеет одну полосу поглощения с максимумом при 557 нм. Карбоксигемоглобин не восстанавливается, и его спектр поглощения сохраняется. Это видно из представленных спектров поглощения проб крови (см. рис. 3).
Поглощение бурового раствора
... потерей циркуляции бурового раствора в процессе бурения. Поглощение промывочной жидкости объясняется, во-первых, превышением давления столба жидкости в скважине на пластовым давлением (чем больше эта разность, тем интенсивнее поглощение) и, ...
Методика определения карбоксигемоглобина (ВОЗ, Женева, 1998) заключается в следующем. Для анализа исследуемую кровь делят на 3 части. Одну часть (А) оставляют без изменения, вторую часть (В) насыщают оксидом углерода до 100% содержания СОНb и используют в качестве стандарта, третью часть (С) насыщают кислородом до полного вытеснения СО, т.е. получают 100% оксигемоглобина.
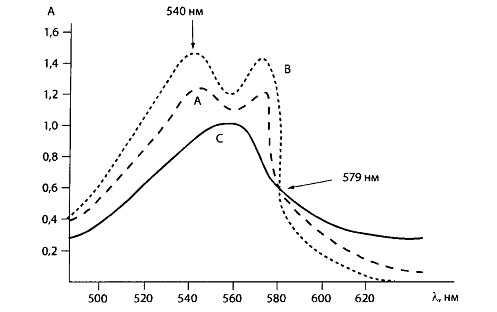
Рис. 3. Спектры поглощения проб крови: А — исследуемая кровь, содержащая дезокси- и карбоксигемоглобин; В — проба крови, содержащая 100% НbСО; С — проба крови, содержащая дезоксигемоглобин.
К каждой из трех проб добавляют восстановитель дитионат натрия — Na2S2O4•2Н20. Регистрируют спектры поглощения всех трех растворов в области 500-620 нм и измеряют значение оптической плотности А при 540 и 579 нм (изобестическая точка).
Расчет содержания карбоксигемоглобина ведут по величине отношения оптической плотности А540/А579. Находят отношение А540/А579 для растворов А, В и С. Эти отношения подставляют в формулу:
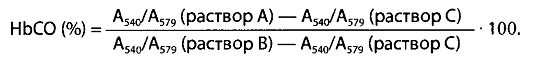
Этот метод эффективен при исследовании крови, содержащей более 10% карбоксигемоглобина. Физиологическая норма содержания карбоксигемоглобина в крови составляет от 1,5 до 3,1%, для курильщиков — <10%. Смертельная концентрация карбоксигемоглобина в крови составляет в среднем -60% и может колебаться в зависимости от внешних условий и особенностей организма от 40 до 80%.
Определение оксида углерода(II) в воздухе
-й способ. Для обнаружения оксида углерода(II) в воздухе используют его способность поглощаться кровью животного. С этой целью 20 л воздуха прокачивают при помощи аспиратора сначала через ряд склянок Тищенко с суспензией гидроксида железа(II) с целью связывания кислорода, а затем через 5 мл разведенной крови животного. Полученную кровь анализируют спектрофотометрическим методом.
- й способ. Метод основан на окислении оксида углерода(II) оксидом йода(V) до оксида углерода(IV).
Исследуемый объем воздуха (20 л) прокачивают через раствор, содержащий оксид йода(V).
![]()
Образовавшийся оксид углерода(IV) пропускают через раствор гидроксида бария.
![]()
Избыток гидроксида бария оттитровывают (микротитрование) хлороводородной кислотой.
![]()
Помощь при отравлении оксидом углерода (II)
Первые симптомы отравления могут развиваться через 2 — 6 ч пребывания в атмосфере, содержащей 0,22-0,23 мг СО на 1 л воздуха; тяжелое отравление с потерей сознания и смертельным исходом может развиваться через 20- 30 мин при концентрации СО 3,4- 5,7 мг/л и через 1-3 мин при концентрации яда 14 мг/л.
Первыми симптомами отравления являются головная боль, тяжесть в голове, шум в ушах, тошнота, головокружение и сердцебиение.
При дальнейшем пребывании в помещении, воздух которого насыщен оксидом углерода, у пострадавшего начинается рвота, нарастает общая слабость, появляются выраженная сонливость и одышка. Кожные покровы бледнеют. Если человек продолжает вдыхать угарный газ, его дыхание становится поверхностным, возникают судороги. Смерть наступает от остановки дыхания вследствие паралича дыхательного центра.
Качество атмосферного воздуха
... углеводородов и оксидов углерода выделяется в воздух в результате лесных пожаров[16]. 1.2 Классификация загрязнителей и стандарты качества атмосферного воздуха По условиям образования все вещества, загрязняющие атмосферный воздух, делятся на примеси ...
Первая помощь при отравлении угарным газом
Прежде всего необходимо вынести пострадавшего на свежий воздух (в теплое время года на улицу, в холодное — в проветриваемую комнату, на лестничную клетку).
Человека укладывают на спину и снимают тесную стягивающую одежду;
- Все тело пострадавшего растирается энергичными движениями;
- На голову и грудь кладется холодный компресс;
- Если пострадавший в сознании, рекомендуется напоить его теплым чаем;
- Если человек без сознания, нужно поднести к его носу ватку, смоченную нашатырным спиртом;
- При отсутствии дыхания необходимо начать искусственную вентиляцию легких и немедленно вызвать «Скорую помощь».
Для предупреждения отравления рекомендуется соблюдать меры предосторожности на производстве, устанавливать в гаражах отлаженную систему вентиляции, а в домах с печью закрывать заслонку только после того, как в золе не останется синих огоньков.
Лечение отравлений угарным газом
При отравлении СО необходимы скорейшее удаление яда из организма и специфическая терапия. Пострадавшего выносят на свежий воздух, а по прибытии медицинских работников проводят ингаляции увлажненного кислорода (в условиях скорой помощи при помощи аппаратов КИ-З-М, АН-8).
В первые часы для ингаляции используют чистый кислород, затем переходят на ингаляцию смеси воздуха и 40-50% кислорода. В специализированных стационарах применяют ингаляцию кислорода под давлением 1-2 атм в барокамере (гипербарическая оксигенация).
При расстройствах дыхания перед ингаляцией кислорода необходимо восстановить проходимость дыхательных путей (туалет полости рта, введение воздуховода), провести искусственное дыхание вплоть до интубации трахеи и искусственной вентиляции легких.
При нарушениях гемодинамики (гипотония, коллапс), чаще всего возникающих вследствие поражения центральной нервной системы, помимо внутривенного введения (струйно) аналептиков (2 мл кордиамина, 2 мл 5% раствора эфедрина), следует вводить внутривенно капельно реополиглюкин (400 мл) в сочетании с преднизолоном (60-90 мг) или гидрокортизоном (125-250 мг).
Большое внимание при отравлении СО необходимо уделять профилактике и лечению отека мозга, так как тяжесть состояния больных, особенно при длительном расстройстве сознания, определяется отеком мозга, развившимся вследствие гипоксии.
На догоспитальном этапе больным внутривенно вводят 20-30 мл 40% раствора глюкозы с 5 мл 5% раствора аскорбиновой кислоты, 10 мл 2,4% раствора эуфиллина, 40 мг лазикса (фуросемид), внутримышечно — 10 мл 25 % раствора сернокислой магнезии.
Очень важно устранить ацидоз, для чего, помимо мероприятий по восстановлению и поддержанию адекватного дыхания, необходимо вводить внутривенно капельно 4% раствор бикарбоната натрия (не менее 600 мл).
В условиях стационара при выраженной симптоматике отека мозга (ригидность затылочных мышц, судороги, гипертермия) специалист-невропатолог проводит повторные люмбальные пункции, необходима краниоцеребральная гипотермия, при отсутствии специального аппарата — лед на голову. С целью улучшения обменных процессов в центральной нервной системе больным, особенно с тяжелым отравлением, назначают витамины, особенно аскорбиновую кислоту (по 5-10 мл 5% раствора внутривенно 2-3 раза в сутки), витамины В1, (по 3-5 мл 6% раствора внутривенно), В6 (по 3-5 мл 5% раствора 2-3 раза в сутки внутривенно).
Коррозия меди в 5М изопропанольных растворах НС
... свойства меди. («водородная болезнь»). Гидроксид меди (II) выпадает в виде объемистого голубого осадка при действии щелочей на растворы солей двухвалентной меди. ... 2 С uCO3 . С u(OH)2 . Физические и химические свойства. Медь - металл красного, в изломе розоватого цвета, в тонких слоях ... ® 1/2 O 2 + H 2 O Коррозионное и электрохимическое поведение меди. В атмосферных условиях в отличие от многих других ...
Для профилактики и лечения пневмонии следует вводить антибиотики, сульфаниламиды. Тяжелые больные с отравлением СО нуждаются в тщательном уходе; необходимы туалет кожи тела, особенно спины и крестца, перемена положения тела (повороты на бок), тяжелая перкуссия грудной клетки (поколачивания боковой поверхностью ладони), вибромассаж, ультрафиолетовые облучения грудной клетки эритемными дозами (по сегментам).
В ряде случаев отравление СО может сочетаться с другими тяжелыми состояниями, значительно осложняющими течение интоксикации и часто оказывающими решающее влияние на исход заболевания. Чаще всего это ожог дыхательных путей, возникающий при вдыхании горячего воздуха, дыма во время пожара.
Как правило, в этих случаях тяжесть состояния больных обусловлена не столько отравлением угарным газом (которое может быть легким или средней тяжести), сколько ожогом дыхательных путей. Последний опасен тем, что в остром периоде может развиться острая дыхательная недостаточность вследствие длительного, некупирующегося ларингобронхоспазма, а в последующие сутки развивается тяжелая пневмония.
Больного беспокоят сухой кашель, першение в горле, удушье. Объективно отмечаются одышка (как при приступе бронхиальной астмы), сухие хрипы в легких, цианоз губ, лица, беспокойство. При возникновении токсического отека легких, пневмонии состояние больных еще более ухудшается, усиливается одышка, дыхание частое, до 40-50 в минуту, в легких обилие сухих и влажных разнокалиберных хрипов. Летальность в этой группе больных высокая.
Лечение в основном симптоматическое: внутривенное введение бронхолитиков (10 мл 2,4% раствора эуфиллина с 10 мл физиологического раствора, 1 мл 5% раствора эфедрина, по 60-90 мг преднизолона 3-4 раза или 250 мг гидрокортизона 1 раз в сутки, по 1 мл 5 % раствора аскорбиновой кислоты 3 раза в сутки).
Большое значение имеет местная терапия в виде масляных ингаляций (оливковое, абрикосовое масло), ингаляций антибиотиков (пенициллина 500 тыс. ЕД в 10 мл физиологического раствора), витаминов (1- 2 мл 5 % раствора аскорбиновой кислоты с 10 мл физиологического раствора); при выраженном ларингобронхоспазме -10 мл 2,4% раствора эуфиллина, 1 мл 5 % раствора эфедрина, 125 мг гидрокортизона в 10 мл физиологического раствора. При сильном кашле применяют кодеин с содой (по 1 таблетке 3 раза в день).
Вторым тяжелым осложнением интоксикации СО является травма положением (синдром сдавления), развивающаяся в тех случаях, когда пострадавший лежит без сознания (или сидит) в одной позе длительное время, касаясь участками тела (чаще всего конечностями) жесткой поверхности (угол кровати, пол) либо придавив конечность тяжестью собственного туловища. В участках, подвергающихся сдавлению, создаются неблагоприятные условия для крово- и лимфообращения. При этом резко нарушается питание мышечной и нервной ткани, кожи, что ведет к их гибели. У пострадавшего появляются очаги покраснения кожи, иногда с образованием пузырей, наполненных жидкостью (по типу ожоговых), уплотнения мягких тканей, которые в дальнейшем усиливаются за счет развивающегося отека. Пораженные участки становятся резко болезненными, увеличенными в объеме, плотными (вплоть, до каменной плотности).
В результате распада мышечной ткани в кровь поступает миоглобин (белок, входящий в состав мышечной ткани), если зона травмы обширна, большое количество миоглобина поражает почки: развивается миоглобинурийный нефроз.
Таким образом, у больного формируется так называемый миоренальный синдром, характеризующийся сочетанием травмы положением с почечной недостаточностью.
Лечение больных с миоренальным синдромом длительное и проводится в специализированных стационарах, так как требует применения различных специальных методов (гемодиализ, лимфодренаж и др.).
При наличии сильных болей можно ввести обезболивающие препараты — 1 мл 2 % раствора промедола и 2 мл 50% раствора анальгина подкожно или внутривенно.
Список использованной литературы:
[Электронный ресурс]//URL: https://drprom.ru/kursovaya/na-temu-otravlenie-uglekislyim-gazom/
Токсикологическая химия: учебник для вузов/ под ред. Т.В. Плетеневой. — 2-е изд., испр. — М.: ГЭОТАР — Медиа, 2006. — 512 с.
Оксенгендлер Г.И. Яды и противоядия: человек и окружающая среда. — Л.: Наука, 1982. — 192 с.
Швайкова М. Д. Токсикологическая химия.- М.: Медицина, 1975.-376 с
Вергейчик Т.Х. Токсикологическая химия: учебник / под ред. проф. Е.Н. Вергейчика. — М.: МЕДпресс-информ, 2009. — 400с.: илл.
Линг Луис, Кларк Ричард. Секреты токсикологии/Пер. с англ. — М. — Спб.: «Издательство БИНОМ» — «Издательство Диалект», 2006. — 376 с., илл.
Калетина Н.И. Токсикологическая химия. Метаболизм и анализ токсикантов: учебное пособие для ВУЗов/ под ред. проф. Н.И. Калетиной. — М.: ГЭОТАР-Медиа, 2007. — 1008 с.
Крамаренко В.Ф. Токсикологическая химия. — К.: Выща школа. Головное изд-во, 1989. — 447 с.
