Основная часть: 4-6 страницы
Вывод: 7 страница
Библиография: 8 страница
История
Алессандро Вольта опытным путём установил ряд напряжений металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. Сила гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга члены ряда. Но причина этого в те годы была неизвестна. Правда, ещё в 1797 г. немецкий учёный Иоганн Вильгельм Риттер (1776-1810), прославившийся открытием ультрафиолетовых лучей, предсказал, что в ряду напряжений металлы должны стоять в порядке уменьшения их способности соединяться с кислородом. В случае цинка и золота этот вывод не вызывал сомнений; что же касается других металлов, то надо отметить, что их чистота была не очень высока. В 1853 г. русский учёный, один из основоположников физической химии Николай Николаевич Бекетов (1827-1911) сделал в Париже сообщение на тему «Исследование над явлениями вытеснения одних элементов другими» (через шесть лет эта работа была напечатана в Харькове на русском языке).
В этой работе Бекетов обобщил исследования относительно способности одних металлов вытеснять другие из растворов их солей. Самый известный пример такой реакции — вытеснение из раствора ионов меди железом (восстановление меди железом) — ещё в Средние века использовали шарлатаны, публично показывавшие «превращение» железного гвоздя в красное «золото». Давно знали и о вытеснении из раствора свинца цинком и кадмием (восстановление свинца), вытеснении (восстановлении) железа цинком и т. д. Так был составлен «вытеснительный ряд», или ряд активности, в котором каждый металл вытесняет (восстанавливает) из растворов солей все последующие, но ни один из предыдущих. Водород тоже поместили в этот ряд — он оказался перед медью; однако сам водород металлы, как правило, из раствора не вытесняет. Все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород. Сначала Бекетов решил, что основная закономерность такова: более лёгкие металлы способны вытеснять из растворов солей металлы с большей плотностью. Но это не всегда согласовывалось с опытными данными.
Металлы в периодической системе Д.И. Менделеева
... помещен один неметалл — водород, поскольку это позволяет определить, будет ли данный металл реагировать с кислотами - неокислителями в водном растворе (точнее — окисляться катионами водорода Н + ). Например, ... заряженные ионы. Поэтомц металлы являются восстановителями. В этом, собственно, и состоит их главное и наиболее общее химическое свойство. Очевидно, металлы как восстановители будут ...
Непонятно было и то, как связан «вытеснительный ряд» с рядом напряжений Вольта. Со временем накапливалось всё больше свидетельств того, что некоторые «правила вытеснения» могут нарушаться. Как обнаружил Бекетов, водород под давлением 10 атм. вытесняет серебро из раствора AgNO 3 . Английский химик Уильям Одлинг (1829-1921) описал множество случаев подобного «обращения активности». Например, медь вытесняет олово из концентрированного подкисленного раствора SnCl 2 и свинец — из кислого раствора PbCl 2 . Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора CdCl 2 .Теоретическую основу ряда активности (и ряда напряжений) заложил немецкий физикохимик Вальтер Нернст (1864-1941).
Вместо качественной характеристики — «склонности» металла и его иона к тем или иным реакциям — появилась точная количественная величина, характеризующая способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла на электроде. Такой величиной является стандартный электродный потенциал металла, а соответствующий ряд, выстроенный в порядке изменения потенциалов, называется рядом стандартных электродных потен
3
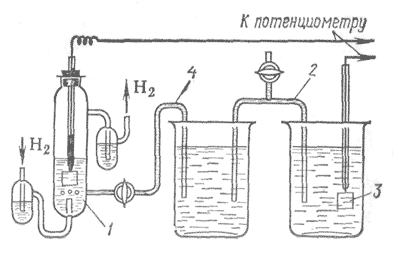
Если определенным образом соединить два электрода, то получится гальванический элемент. Напряжение этого элемента равно разности электродных потенциалов двух составляющих его электродов. Если известен электродный потенциал одного электрода, мы можем определить электродный потенциал другого. Обратите внимание на это «если»: мы, действительно, должны знать электродный потенциал одного из электродов. Но так как абсолютное значение было не известно, приняли электродный потенциал одного из электродов равным нулю, тогда можно определить значение другого электродного потенциала. Нулевое значение дали водородному электроду. Чтобы определить стандартный электродный потенциал металла, измеряют электродвижущую силу гальванического элемента, один из электродов которого — исследуемый металл, погружённый в раствор его соли (при концентрации 1 моль/л), а второй электрод — эталонный (его ещё называют водородным).
Водородный электрод изготовлен из очень пористой губчатой платины (поверхность электрода шероховатая) и опущен в раствор кислоты (концентрация ионов Н + также равна 1 моль/л).
Платиновый электрод непрерывно омывается газообразным водородом, который частично растворяется в платине. Давление водорода также должно быть стандартным — 1,013•10 5 Па (1 атм), а температура ровна 25 °С. Устанавливается равновесие между осажденными на платине атомами водорода и ионами водорода в растворе. На границе металл — раствор возникает разность потенциалов, которую электрохимики принимают равной нулю. Конечно, в действительности этот потенциал не равен нулю, но его значение нам неизвестно. Поэтому определение потенциала любого электрода с помощью стандартного водородного электрода имеет относительный характер; мы определяем его по отношению к условно принятому за нуль значению стандартного водородного потенциала. Стандартный электродный потенциал — основная характеристика электрода — измерен и отражен в справочной литературе. Электродные потенциалы наиболее активных металлов, реагирующих с водой, получены косвенным путём.
Металлы и их свойства
... ионы кислот или основной элемент, образующий кислородосодержащую кислоту. В первом случае кислоты (соляная, разбавленная серная, уксусная и некоторые другие) растворяют почти все металлы, имеющие отрицательные значения стандартного электродного потенциала ...
 Обычно электродные потенциалы записывают как потенциалы восстановления ионов металлов. Самый отрицательный потенциал (-3,04 В) — у реакции Li + + е → Li один из самых положительных (+1,68 В) — у реакции Au + + е → Au. Это значит, что ЭДС гальванической пары литий — золото (если бы такая пара могла работать в водной среде) равнялась бы 4,72 В; для распространённой пары медь — цинк ЭДС
Обычно электродные потенциалы записывают как потенциалы восстановления ионов металлов. Самый отрицательный потенциал (-3,04 В) — у реакции Li + + е → Li один из самых положительных (+1,68 В) — у реакции Au + + е → Au. Это значит, что ЭДС гальванической пары литий — золото (если бы такая пара могла работать в водной среде) равнялась бы 4,72 В; для распространённой пары медь — цинк ЭДС
4
значительно меньше и составляет 1,10 В (соответствующие потенциалы металлов равны -0,76 и +0,34 В).Для неводных электролитов можно использовать и щелочные металлы; так устроены литиевые элементы — они дают ЭДС до 3,5 В. Конечно, потенциалы для неводных растворов другие.
Стандартные электродные потенциалы увеличиваются в ряду: Li < K < Rb < Cs < Ba < Ca < Na < Mg < Al < Mn < Cr < Zn < Fe < Cd < Co < Ni < Sn < Pb < H 2 < Cu < Ag < Hg < Pt < Au. Как видно, литий «обогнал» значительно более активные щелочные металлы. В чём тут дело? Объясняется это тем, что значение стандартного электродного потенциала зависит от нескольких процессов: атомизации металла с полным разрушением его кристаллической структуры, ионизации атомов металла в газовой фазе, перехода ионов металла в водный раствор. И здесь, как у многоборцев, побеждает тот, кто наберёт наибольшую сумму баллов, а она зависит как от размера иона, так и от его заряда. Сравним, например, литий и натрий. По энергии атомизации (159 и 108 кДж/моль соответственно) впереди — натрий: для его испарения требуется меньше энергетических затрат. Меньше энергии необходимо и для ионизации натрия — 496 кДж/моль (для лития — 521 кДж/моль).
Но зато при гидратации маленький ион лития резко вырывается вперёд: при гидратации ионов Li + выделяется 531 кДж/моль, а ионов Na + — «всего» 423 кДж/моль. По сумме «троеборья» литий занимает первое место: его растворение в воде энергетически более выгодно (на 32 кДж/моль), чем растворение натрия.
Реферат металл литий
... также сплавы на основе магния, алюминия, цинка, свинца и некоторых других металлов. Мелкодисперсный элементарный литий намного ускоряет реакцию полимеризации изопрена. Расплавленный металлический литий-7, ... моль на килограмм NH 3 , соответственно). В таком растворе литий медленно реагирует с аммиаком с выделением водорода и образованием амида LiNH2 . Потенциал восстановления для лития (–3,045 В) на ...
Рассмотрим конкретный пример. Пусть это будут пары 2I
2I
2
Значения восстановительно-окислительных потенциалов показывают, что ионы Cu
E = E° + ((R•T)/(2,3•n•F)) •lg([Ox]/[Red])
где [Ox] — концентрация окисленной формы; [Red] — концентрация восстановленной формы; n — число обмененных электронов.
Например, для восстановительно-окислительного потенциала пары Fe
E = 0,75 — 0,059
- lg( Fe
а для пары (Mn
5
E = 1,51 + 0,059/5
- lg( [MnO
Теперь вы видите, в какой степени электродный потенциал, а значит, и окислительные свойства иона перманганата зависят от кислотности среды. Мы должны пользоваться таблицей восстановительно-окислительных потенциалов, но никогда не следует забывать и уравнения Нернста и Петерса.
6
Вывод.
Таким образом, количественным критерием оценки возможности протекания той или иной окислительно-восстановительной реакции является положительное значение разности стандартных окислительно-восстановительных потенциалов полуреакций окисления и восстановления.
7
Библиография
Энциклопедия для детей. Том 17. Химия. / гл. ред. В.А. Володин. — М.: Авонта+, 2000. — 640с.
Варыпаев В.Н., Дасоян М.А., Никольский В.А. Химические источники тока. — М.: Высшая Школа, 1990. — 240с.
