потенциометрическое титрование вода электрод
В аналитической химии для определения параметров и свойств растворов широко используются потенциометрический метод, основанный на измерении ЭДС обратимых гальванических элементов. Важно заметить, что раздел «потенциометрия» состоит из двух больших равноправных разделов — ионометрия и редоксометрия (от англ. Redox — окислительно-восстановительный потенциал).
Соответственно разнятся и принципы работы приборов, и измеряемые параметры, однако, на современном этапе развития промышленности возможно изготовление устройств сочетающих в себе оба этих метода.
Потенциометрическое титрование широко используется в лабораторной практике, оно применяется в тех случаях, когда надо провести экспресс-анализ вещества, а необходимых реактивов и оборудования нет или оно недоступно в данное время. Более того, с использованием электронных приборов стало возможным получение более точных результатов, с трудом достижимых с использованием классических методов. Создание новых моделей рН-метров, более компактных, надежных и удобных, только повышает востребованность данного метода измерений.
Потенциометрическое титрование позволяет решать как аналитические задачи — определение концентрации веществ, так и физико-химические — определение произведений растворимости, константу устойчивости, степени диссоциации.
1.Понятие потенциометрического титрования
Потенциометрический метод — это метод качественного и количественного анализа, основанный на измерении потенциалов, возникающих между испытуемым раствором и погруженным в него электродом. Данный метод рекомендуется для проведения анализов окрашенных растворов или малых концентраций веществ, для количественного анализа некоторых препаратов. Используя потенциометрическое титрование, можно более объективно устанавливать точку эквивалентности, поэтому метод находит широкое практическое применение, особенно в заводских лабораториях и экспресс-анализе. Помимо аналитических целей метод может быть использован для изучения кинетики химических процессов.
Потенциометрическое титрование основано на определении точки эквивалентности по результатам потенциометрических измерений. Вблизи точки эквивалентности происходит резкое изменение (скачок) потенциала индикаторного электрода. Это наблюдается, конечно, лишь тогда когда хотя бы один из участников реакции титрования является участником электродного процесса. Так, например, титрование по методу кислотно-основного взаимодействия может быть выполнено со стеклянным электродом. Определение хлорида — с хлорсеребряным и т.д. Так же, как и в других титриметрических методах, реакции потенциометрического титрования должны протекать строго стехиометрически, иметь высокую скорость и идти до конца.
Спектральные методы анализа
... Это - общая закономерность, поэтому спектральный анализ можно проводить как по спектру испускания, так и по спектру поглощения. Первый способ удобен для анализа материалов, в которых легко возбуждается ... видимом и ИК диапазоне называют оптическими. Они больше всего применяются в спектральных методах вследствие сравнительной простоты оборудования для получения и регистрации спектра. Спектры ...
2. Принцип работы pH-метра
Действие pH-метра основано на измерении величины ЭДС электродной системы, показатели которой пропорциональны активности ионов водорода в растворе — pH (его водородному показателю).
Измерительная схема по сути своей представляет собой не более чем получение и использование показаний вольтметра, преобразованных в иные эквивалентные — в данном случае, выраженные в единицах pH, а не в вольтах.
Схема проста: pH-метр обычно состоит из операционных усилителей обращения конфигурации, дающих напряжение в цепи около 17 в. Входное сопротивление прибора должно быть очень высоким — примерно от 20 до 1000 МОм, что обусловлено высоким сопротивлением зонда — стеклянного электрода, являющегося наиболее ответственным и важным элементом всех pH-метров. Инвертирующий датчик-усилитель преобразует малое напряжение зонда (0,059 вольт / pH) пропорционально единицам pH, которые затем вновь преобразуются до необходимого напряжения для активизации вольтметра, отображающего показания на шкале pH. Эти методические и схемотехнические приемы дают возможность проводить измерения ЭДС с высокой точностью вне зависимости от влияния внешних электростатических и электромагнитных помех, при любых, даже очень малых, значениях удельной электропроводности (УЭП) среды, вплоть до теоретически чистой воды. Для контроля и настройки режимов pH-метра используется пульт, соединённый с блоком электронного преобразования.
2.1 Пример измерений
При нейтральном pH (pH = 7) напряжение на выходе датчика равно 0 вольт.
* 17 + 7 = 7.
При основном pH, напряжение на выходе датчика варьируется от 0 до 0,41 вольт (7 * 0,059 = 0,41).
Например, приpH = 10 (на 3 ед. выше нейтрального):
* 0,059 = 0,18 вольт, выход усилителя — 0,18 * 17 + 7 = 10.
При кислотном pH, напряжение на выходе датчика колеблется от −0,41 вольт до −0.
Так, например,pH 4 (3 ед. ниже нейтрального):
−3 * 0,059 = −0,18 вольт, выход усилителя — −0,18 * 17 + 7 = 4.
2.2 Использование различных электродов
Главной особенностью потенциометрического титрования есть использование различных видов электродов от выбора которых напрямую зависит точность проведенных исследований. Поэтому при проведении титрования надо учитывать некоторые особенности электродов:
- Если есть возможность выбора — предпочтениеследует отдавать электродам с наименьшим электрическим сопротивлением, т.к. это позволит снизить электростатические наводки и сделать измерения более точными, быстрыми и комфортными;
- При анализе щелочных растворов с высоким содержанием ионов натрия следует применять высокоомные электроды;
- Для метод анализа">анализа растворов имеющих повышенную температуру (>50°С) предпочтительны высокоомные электроды, т.к.
в этих условиях их сопротивление значительно снижается, и они приобретают все положительные свойства низкоомных электродов, но при этом имеют более широкий диапазон измерений и больший ресурс работы.
Оптимальный материал для изготовления индикаторного электрода
... по отношению к электродным реакциям (1) и (2), чем объемные образцы. индикаторный электрод материал перекись Исходя из этих соображений, было сделано следующее. Из индифферентного ... методов контроля концентрации Н2О2 лимитируется в основном подбором материала индикаторного электрода. Нам нужно было разработать такой электрод, который наиболее полно удовлетворял уравнению Нернста: Е=Е0+ln[ ] ( ...
2.3 Принцип работы дифференциального (автоматического) титрометра
Для начала рассмотрим принцип работы ручного дифференциального титрометра. Для проведения дифференциального титрования используются два идентичных индикаторных электрода, один из которых экранирован от массыраствора. Типичная установка для дифференциального титрования показана на Рис. 1:
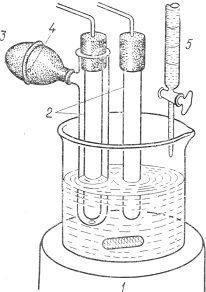
Рис 1. Установка для дифференциального потенциометрического титрирования.
- магнитная мешалка;
- идентичные индикаторныеэлектроды;
- резиноваягруша;
- отверстие;
- бюретка.
Здесь один из электродов помещен в пробирку с боковымсмесителем. Контакт с массой раствора осуществляется черезмаленькое отверстие (~1 мм) в дне пробирки. Вследствие этого состав раствора, окружающего экранированный электрод, после добавления титранта к основной массераствора будет изменяться постепенно. Различие в составе растворов приводит к появлению разности потенциалов ΔΕ между электродами. После каждого измерения потенциала раствор гомогенизируют, сжимая в течение некоторого времени резиновую грушу, и поэтому ΔЕ опять становится равной нулю. Если объем раствора в пробирке, экранирующей электрод, будет небольшим (скажем, 1 — 5 мл), то ошибка, возникающая из-за того, что последняя порция титранта не сможет прореагировать с этой частьюраствора, будет пренебрежимо мала.
Для окислительно-восстановительного титрования можно использовать два проволочных платиновых электрода, один из которых помещен в обычный медицинский шприц.
Главное достоинство метода дифференциального титров состоит в отсутствии электродасравнения и солевогомостика.
В автоматических титраторах обычно применяют систему бюреток с электромагнитными клапанами для контроля потока реагента или шприц, плунжер которого приводится в рабочее состояние электродвигателем, соединенным с микрометром. В обоих случаях скорость добавления реагента в течение всего времени титрования во избежание перетитровывания должна быть мала или по мере приближения конечной точки необходимо любыми способами уменьшать объем порций реагента.
3.Основные параметры серийно выпускаемых pH-метров
Ниже приведены основные параметры серийно выпускаемых ph — метров. В скобках показан примерный диапазон возможных значений того или иного параметра.
1) Диапазон измеряемогоpH (0-14)ph
2) Точность (обычно 0.1 — 0.01)
Диапазон измерения температуры (необходимо для температурной компенсации, ручной или автоматической), (0 — 70)C
Точность измеряемой температуры (0.1 — 1)
Наличие функции температурной автокомпенсации
Наличие функции автокалибровки
Сопротивление входа. Зависит от типа используемого электрода, варьируется от 1 МОм (низкоомный электрод) до 700 МОм (высокоомный электрод)
Также необходимо отметить, что большей частью данные параметры зависят от используемого электрода, и, обычно, используя более чувствительный (и дорогостоящий) электрод можно добиться более точных результатов на одном и том же приборе.
.1 Обзор серийно выпускаемыхpH-метров и их характеристик;
1. Карманный Ph-метр «Checker».
Главным достоинством устройства являются маленький размер и вес, что позволяет легко проводить измерения в полевых условиях. В приборе используется жидкокристаллический дисплей для лёгкого считывания информации.

Тонкий электрод позволяет проводить измерения в труднодоступных местах.
Характеристики устройства:
|
Размеры, мм |
60 x 50 x 25 мм |
|
Вес, г |
50 г |
|
Диапазон измерения, pH |
0 — 14 |
|
Разрешающая способность, pH |
0.01 |
|
Точность (с комплектным элктродом), pH |
±0.2 |
|
Возможность измерения температуры |
|
|
Термокомпенсация |
Ручная |
|
Калибровка |
Ручная |
2. Карманный Ph-метр «Piccolo+».
Данный pH-метр отличается от предыдущей модели меньшими размерами, большей точностю и возможностью измерения температуры, что позволило реальизовать в нём функции температурной автокомпенсации.

Характеристики устройства:
|
Размеры, мм |
40 x 50 x 15 мм |
|
Вес, г |
30 г |
|
Диапазон измерения, pH |
1 — 13 |
|
Диапазон измерения температуры, С |
0 — 70 |
|
Разрешающая способность, pH |
0.01 |
|
Точность (с комплектным электродом), pH |
±0.02 |
|
Точность измерения температуры, С |
±1 |
|
Термокомпенсация |
Автоматическая |
|
Калибровка |
Ручная |
3. Лабораторный Ph-метр «pH-211».

Микропроцессорный pH — метр с автоматической калибровкой и автоматической температурной компенсацией. Обеспечивает недостижимую для карманных устройств точность. Обладает функцией измерения окислительно-восстановительного потенциала (Redox).
Автоматическая калибровка производится по трём растворам с известнымиpH.
Характеристики устройства:
|
Размеры, мм |
240 x 182 x 74 мм |
|
Вес, кг |
1,1г |
|
Диапазон измерения, pH |
0 — 14 |
|
Диапазон измерения температуры, С |
9,9 — 120,0 |
|
Диапазон измерения ОВП, мВ |
±399,9 — ±2000 |
|
Разрешающая способность, pH |
0.01 |
|
Точность (с комплектным электродом), pH |
±0.01 |
|
Точность измерения температуры, С |
±0,4 |
|
Точность измерения ОВП, мВ |
±0,3 |
|
Термокомпенсация |
Автоматическая |
|
Калибровка |
Автоматическая |
Список использованнойлитературы
[Электронный ресурс]//URL: https://drprom.ru/referat/izmerenie-ph/
1. «Direct Measurement of Water Minerals Concentrations by using potentiometric methods». B. Paul,* C. P. Collier, and R. J. Saykallyof Chemistry, University of California at Berkeley.
2. «Титриметрический анализ», http://en.wikipedia.org/wiki/Titration , Wikipedia, CCLicense
— Васильев В. П. «Аналитическая химия», «Физико-химические методы анализа: Учебник для студентов ВУЗов, обучающихся по химико-технологическим специальностям» — 2-е изд., перераб. и доп. — М.:Дрофа, 2002. — 384 с., ил. — С. 202-207.
