С электропроводностью растворов солей в воде (электролитов) связано очень многое в нашей жизни. С первого удара сердца («живое» электричество в теле человека, на 80% состоящем из воды) до автомобилей на улице, плееров и мобильных телефонов (неотъемлимой частью этих устройств являются «батарейки» – электрохимические элменты питания и различные аккумуляторы – от свинцово-кислотных в автомобилях до литий-полимерных в самых дорогих мобильных телефонах).
В огромных, дымящихся ядовитыми парами чанах из расплавленного при огромной температуре боксита электролизом получают алюминий – «крылатый» металл для самолётов и банок для «Фанты». Все вокруг – от хромированной решетки радиатора иномарки до посеребрённой серёжки в ухе когда-либо сталкивалось с раствором или расплавом солей, а следовательно и с электротоком в жидкостях. Не зря это явление изучает целая наука – электрохимия. Но нас сейчас больше интересуют физические основы этого явления.
Из уроков физики в 8 классе нам известно, что заряд в проводниках (металлах) переносят отрицательно заряженные электроны.
Упорядоченное движение заряженных частиц называется электрическим током.
Но если мы соберем прибор (с электродами из графита):
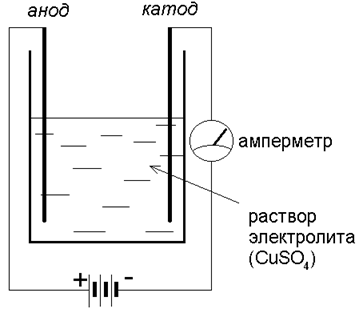
то убедимся, что стрелка амперметра отклоняется – через раствор идет ток! Какие же заряженные частицы есть в растворе?
Ещё в 1877 году шведский ученый Сванте Аррениус, изучая электропроводность растворов различных веществ, пришел к выводу, что её причиной являются ионы, которые образуются при растворении соли в воде. При растворении в воде молекула CuSO 4 распадается (диссоциирует) на два разнозаряженных иона – Cu2+ и SO4 2- . Упрощенно происходящие процессы можно отразить следующей формулой:
CuSO 4 ÞCu2+ +SO4 2-
- Проводят электрический ток растворы солей, щелочей, кислот.
- Вещества, растворы которых проводят электрический ток, называются электролитами.
- Растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
- Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
Электролитическая диссоциация , Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него русские химики И. А. Каблуков и В. А. Кистяковский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворённого вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, то есть «одетые в шубку» из молекул воды. Следовательно, диссоциация молекул электролитов происходит в следующей последовательности:
Измерение концентрации растворов. Концентратомеры кислоты, щелочей и солей
... электрический способ измерения. При погружении в раствор электродов из определенных материалов на границе между электродом и раствором возникает электрический потенциал, зависящий от температуры и концентрации водородных ионов в растворе. ... что предотвращает чрезмерное накопление газов в холодильнике и ограничивает их растворение в конденсате. При выходе из холодильника в расширитель температура ...
а) ориентация молекул воды вокруг полюсов молекулы электролита
б) гидратация молекулы электролита
в) её ионизация
г) распад её на гидратированные ионы
По отношению к степени электролитической диссоциации электролиты делятся на сильные и слабые.
Сильные электролиты
У них значение степени диссоциации стремится к единице.
Слабые электролиты
гидратированные ионы
Температурная зависимость сопротивления электролита , При повышении температуры
Катод и анод. Катионы и анионы
А что же происходит с ионами под воздействием электрического тока?
Вернёмся к нашему прибору:
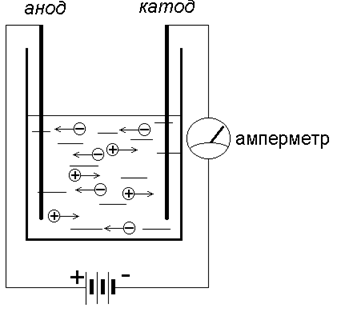
Положительно заряженный ион
Первый закон Фарадея
А можем ли мы узнать сколько меди выделилось? Взвешивая катод до и после опыта, можно точно определить массу осадившегося металла. Измерения показывают, что масса вещества, выделевшегося на электродах, зависит от силы тока и времени электролиза:
m=K´I´t
электрохимическим эквивалентом
Следовательно, масса выделевшегося вещества прямо пропорциональна силе тока и времени электролиза. Но ток за время (согласно формуле):
q=I´t
есть заряд.
Итак, масса вещества, выделевшегося на электроде, пропорциональна заряду, или количеству электричества, прошедшему через электролит.
M=K´q
первый закон Фарадея
Второй закон Фарадея
А что такое и от чего зависит электрохимический эквивалент? На этот вопрос тоже дал ответ Майкл Фарадей.
На основании многочисленных опытов он пришёл к выводу, что эта величина является характерной для каждого вещества. Так, например при электролизе раствора ляписа (азотнокислого серебра AgNO 3 ) 1 кулон выделяет 1,1180 мг серебра; точно такое же количество серебра выделяется при электролизе зарядом в 1 кулон любой серебряной соли. При электролизе соли другого металла 1 кулон выделяет другое количество данного металла. Таким образом, электрохимическим эквивалентом какого-либо вещества называется масса этого вещества, выделяемая при электролизе 1кулоном протекшего через раствор электричества . Приведем его значения для некоторых веществ:
|
Вещество |
K в мг/к |
|
|
Ag (серебро) |
1,118 |
|
|
H (водород) |
0,01045 |
|
|
Cu (медь) |
0,3294 |
|
|
Zn (цинк) |
0,3388 |
|
второй закон Фарадея
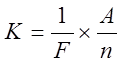
Электрохимические эквиваленты различных веществ пропорциональны их атомным весам и обратно пропорциональны числам, выражающим их химическую валентность.
Где:
n – валентность
A – атомный вес
![]() – называют химическим эквивалентом данного вещества
– называют химическим эквивалентом данного вещества
![]() – коэффициент пропорциональности, который является уже универсальной постоянной, то есть имеет одинаковое значение для всех веществ. Если измерить электрохимический эквивалент в г/к то найдем, что он равен 1,037´10-5 г/к .
– коэффициент пропорциональности, который является уже универсальной постоянной, то есть имеет одинаковое значение для всех веществ. Если измерить электрохимический эквивалент в г/к то найдем, что он равен 1,037´10-5 г/к .
Обьединяя первый и второй законы Фарадея получаем:
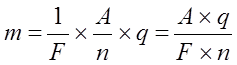
Эта формула имеет простой физический смысл: F численно равно заряду, котоый надо пропустить через любой электролит, чтобы выделить на электродах вещество в количестве, равном одному химическому эквиваленту. F называют числом Фарадея и оно равно 96400 к/г.
Моль и количество молекул в нем. Число Авогадро
Из курса химии за 8й класс мы знаем, что для измерения количеств веществ, участвующих в химических реакциях, была выбрана особая еденица – моль. Чтобы отмерять один моль вещества, нужно взять столько граммов его, какова относительная молекулярная масса его.
содержит одинаковое число молекул
Моль – это такое количество вещества, в котором содержится 6
В честь итальянского ученого А. Авогадро это число ( N ) называется постоянной Авогадро или числом Авогадро .
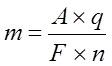
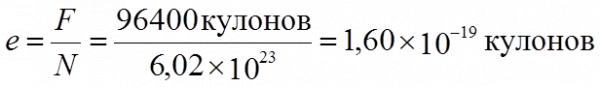
Применение электролиза
Электролитический метод получения чистых металлов (рафинирование, аффинаж).
Электролиз, сопровождающийся растворением анода
Хорошим примером является электролитическое очищение (рафинирование) меди. Полученная непосредственно из руды медь отливается в виде пластин и помещается в качестве анода в раствор CuSO 4 . Подбирая напряжение на электродах ванны (0,20-0,25в), можно добиться, чтобы на катоде выделялась только металлическая медь. При этом посторонние примеси либо переходят в раствор (без выделения на катоде), либо выпадают на дно ванны в виде осадка («анодный шлам»).
Катионы вещества анода соединяются с анионом SO4 2- , а на катоде при этом напряжении выделяется только металлическая медь. Анод как бы «растворяется». Такая очистка позволяет добится чистоты 99,99% («четыре девятки»).
Аналогично (аффинаж) очищают и драгоценные металлы (золото Au, серебро Ag).
В настоящее время весь алюминий (Al) добывается электролитически (из расплава бокситов).
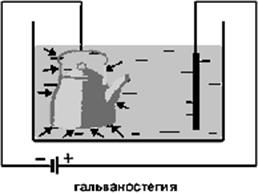
Гальванотехника
Гальванотехника
гальваностегией
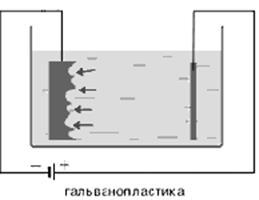
гальванопластикой
Кроме указанных выше, электролиз нашел применение и в других областях:
- получение оксидных защитных пленок на металлах (анодирование);
- электрохимическая обработка поверхности металлического изделия (полировка);
- электрохимическое окрашивание металлов (например, меди, латуни, цинка, хрома и др.);
- очистка воды – удаление из нее растворимых примесей. В результате получается так называемая мягкая вода (по своим свойствам приближающаяся к дистиллированной);
- электрохимическая заточка режущих инструментов (например, хирургических ножей, бритв и т.д.).
Список использованной литературы:
[Электронный ресурс]//URL: https://drprom.ru/referat/na-temu-elektricheskiy-tok-v-rastvorah-i-rasplavah-elektrolitov/
1. Гуревич А. Е. «Физика. Электромагнитные явления. 8 класс» Москва, Издательский дом «Дрофа». 1999 год.
2. Габриэлян О. С. «Химия. 8 класс» Москва, Издательский дом «Дрофа». 1997 год.
3. «Элементарный учебник физики под редакцией академика Г. С. Ландсберга — Том II – электричество и магнетизм». Москва, «Наука» 1972 год.
4. Eric M. Rogers. «Physics for the Inquiring Mind (the methods, nature and phylosophy of physical science)». «Prinseton University press» 1966. Том III – электричество и магнетизм. Перевод Москва, «Мир» 1971 год.
5. А. Н. Ремизов «Курс физики, электроники и кибернетики для медицинских институтов». Москва, «Высшая школа» 1982 год.
