На данном уроке мы изучим понятие «удельная теплота плавления». Эта величина характеризует количество теплоты, которое необходимо сообщить 1 кг вещества при температуре плавления, чтобы оно из твердого состояния перешло в жидкое (или наоборот).
Мы изучим формулу для нахождения количества теплоты, которое необходимо для плавления (или выделяется при кристаллизации) вещества.
Тема: Агрегатные состояния вещества, Урок: Удельная теплота плавления
Данный урок посвящён основной характеристике плавления (кристаллизации) вещества — удельной теплоте плавления.
На прошлом уроке мы затрагивали вопрос: как изменяется внутренняя энергия тела при плавлении?
Мы выяснили, что при подведении теплоты внутренняя энергия тела возрастает. Вместе с тем, мы знаем, что внутренняя энергия тела может характеризоваться таким понятием, как температура. Как нам уже известно, при плавлении температура не меняется. Поэтому может возникнуть подозрение, что мы имеем дело с парадоксом: внутренняя энергия увеличивается, а температура не меняется.
Объяснение этого факта довольно простое: вся энергия тратится на разрушение кристаллической решётки. Аналогично и в обратном процессе: при кристаллизации молекулы вещества объединяются в единую систему, при этом избыток энергии отдаётся и поглощается внешней средой.
В результате различных экспериментов удалось установить, что для одного и того же вещества требуется различное количество теплоты, чтобы перевести его из твёрдого состояния в жидкое.
Тогда было решено сравнить эти количества теплоты при одинаковой массе вещества. Это привело к появлению такой характеристики, как удельная теплота плавления.
Определение, Удельная теплота плавления
Такая же величина выделяется и при кристаллизации 1 кг вещества.
Обозначается удельная теплота плавления (греческая буква, читается как «лямбда» или «ламбда»).
Единицы измерения: . В данном случае в размерности отсутствует температура, так как при плавлении (кристаллизации) температура не меняется.
Для вычисления количества теплоты, необходимого для плавления вещества, используется формула:
- Количество теплоты (Дж);
- Удельная теплота плавления (, которая ищется по таблице;
- Масса вещества.
Когда тело кристаллизуется, пишется со знаком «-», так как тепло выделяется.
Реферат плавление тел
... состояниям вещества. Плавление Рис. 1. Состояние чистого вещества (диаграмма) Рис. 2. Температура плавления кристаллического тела Рис. 3. Температура плавления щелочных металлов Плавление - переход вещества из кристаллического (твёрдого) состояния в жидкое; происходит с поглощением теплоты ...
В качестве примера можно привести удельную теплоту плавления льда:
![]() . Или удельную теплоту плавления железа:
. Или удельную теплоту плавления железа:
![]() .
.
То, что удельная теплота плавления льда получилась больше удельной теплоты плавления железа, не должно удивлять. Количество теплоты, которое необходимо тому или иному веществу для плавления, зависит от характеристик вещества, в частности, от энергии связей между частицами данного вещества.
На этом уроке мы рассмотрели понятие удельной теплоты плавления.
На следующем уроке мы научимся решать задачи на нагревание и плавление кристаллических тел.
Список литературы
[Электронный ресурс]//URL: https://drprom.ru/referat/na-temu-udelnaya-teplota-plavleniya/
- Генденштейн Л. Э, Кайдалов А. Б., Кожевников В. Б. Физика 8 / Под ред. Орлова В. А., Ройзена И. И. — М.: Мнемозина.
- Перышкин А. В. Физика 8. — М.: Дрофа, 2010.
- Фадеева А. А., Засов А. В., Киселев Д. Ф. Физика 8. — М.: Просвещение.
- Физика, механика и т. п. ().
- Классная физика ().
- Интернет-портал Kaf-fiz-1586.narod.ru ().
Домашнее задание
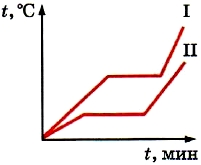
В предыдущем параграфе мы рассматривали график плавления и отвердевания льда. Из графика видно, что, пока лёд плавится, температура его не меняется (см. рис. 18).
И лишь после того, как весь лёд расплавится, температура образовавшейся жидкости начинает повышаться. Но ведь и во время процесса плавления лёд получает энергию от сгорающего в нагревателе топлива. А из закона сохранения энергии следует, что она не может исчезнуть. На что же расходуется энергия топлива во время плавления?
Мы знаем, что в кристаллах молекулы (или атомы) расположены в строгом порядке. Однако и в кристаллах они находятся в тепловом движении (колеблются).
При нагревании тела средняя скорость движения молекул возрастает. Следовательно, возрастает и их средняя кинетическая энергия и температура. На графике это участок АВ (см. рис. 18).
Вследствие этого размах колебаний молекул (или атомов) увеличивается. Когда тело нагреется до температуры плавления, то нарушится порядок в расположении частиц в кристаллах. Кристаллы теряют свою форму. Вещество плавится, переходя из твёрдого состояния в жидкое.
Следовательно, вся энергия, которую получает кристаллическое тело после того, как оно уже нагрето до температуры плавления, расходуется на разрушение кристалла. В связи с этим температура тела перестаёт повышаться. На графике (см. рис. 18) это участок ВС.
Опыты показывают, что для превращения различных кристаллических веществ одной и той же массы в жидкость при температуре плавления требуется разное количество теплоты.
Физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1 кг, чтобы при температуре плавления полностью перевести его в жидкое состояние, называется удельной теплотой плавления.
Удельную теплоту плавления обозначают λ (греч. буква «лямбда»).
Её единица — 1 Дж / кг.
Определяют удельную теплоту плавления на опыте. Так, было установлено, что удельная теплота плавления льда равна 3,4 10 5 — . Это означает, что для превращения куска льда массой 1 кг, взятого при 0 °С, в воду такой же температуры требуется затратить 3,4 10 5 Дж энергии. А чтобы расплавить брусок из свинца массой 1 кг, взятого при его температуре плавления, потребуется затратить 2,5 10 4 Дж энергии.
Измерение теплоты и температуры
... измерений. Для неё надо было уметь точно воспроизводить как условия плавления льда, так и условия кипения воды. Проще было обойтись одной опорной точкой, например точкой плавления льда, и измерять температуру ... и притом довольная точная шкала теплоты тела. Они очень давно заметили, ... к единице массы тела, называется удельной теплоёмкостью. Абсолютная шкала температур Единица температуры возникла ...
Следовательно, при температуре плавления внутренняя энергия вещества в жидком состоянии больше внутренней энергии такой же массы вещества в твёрдом состоянии.
Чтобы вычислить количество теплоты Q, необходимое для плавления кристаллического тела массой т, взятого при его температуре плавления и нормальном атмосферном давлении, нужно удельную теплоту плавления λ умножить на массу тела m:
Из этой формулы можно определить, что
λ = Q / m, m = Q / λ
Опыты показывают, что при отвердевании кристаллического вещества выделяется точно такое же количество теплоты, которое поглощается при его плавлении. Так, при отвердевании воды массой 1 кг при температуре 0 °С выделяется количество теплоты, равное 3,4 10 5 Дж. Точно такое же количество теплоты требуется и для плавления льда массой 1 кг при температуре 0 °С.

При отвердевании вещества всё происходит в обратном порядке. Скорость, а значит, и средняя кинетическая энергия молекул в охлаждённом расплавленном веществе уменьшаются. Силы притяжения теперь могут удерживать медленно движущиеся молекулы друг около друга. Вследствие этого расположение частиц становится упорядоченным — образуется кристалл. Выделяющаяся при кристаллизации энергия расходуется на поддержание постоянной температуры. На графике это участок EF (см. рис. 18).
Кристаллизация облегчается, если в жидкости с самого начала присутствуют какие-либо посторонние частицы, например пылинки. Они становятся центрами кристаллизации. В обычных условиях в жидкости имеется множество центров кристаллизации, около которых и происходит образование кристалликов.
Таблица 4.
Удельная теплота плавления некоторых веществ (при нормальном атмосферном давлении)

При кристаллизации происходит выделение энергии и передача её окружающим телам.
Количество теплоты, выделяющееся при кристаллизации тела массой т, определяется также по формуле
Внутренняя энергия тела при этом уменьшается.
Пример . Для приготовления чая турист положил в котелок лёд массой 2 кг, имеющий температуру 0 °С. Какое количество теплоты необходимо для превращения этого льда в кипяток при температуре 100 °С? Энергию, израсходованную на нагревание котелка, не учитывать.

Какое количество теплоты понадобилось бы, если вместо льда турист взял из проруби воду той же массы при той же температуре?
Запишем условие задачи и решим её.

Вопросы
- Как объяснить процесс плавления тела на основе учения о строении вещества?
- На что расходуется энергия топлива при плавлении кристаллического тела, нагретого до температуры плавления?
- Что называется удельной теплотой плавления?
- Как объяснить процесс отвердевания на основе учения о строении вещества?
- Как вычисляют количество теплоты, необходимое для плавления кристаллического тела, взятого при температуре плавления?
- Как вычислить количество теплоты, выделяющееся при кристаллизации тела, имеющего температуру плавления?
Упражнение 12
Задание
- Поставьте на плиту две одинаковые жестяные банки. В одну налейте воду массой 0,5 кг, в другую положите несколько кубиков льда той же массы. Заметьте, сколько времени потребуется, чтобы вода в обеих банках закипела. Напишите краткий отчёт о вашем опыте и объясните его результаты.
- Прочитайте параграф «Аморфные тела. Плавление аморфных тел». Подготовьте по нему доклад.
Плавление — переход тела из кристаллического твёрдого состояния в жидкое. Плавление происходит с поглощением удельной теплоты плавления и является фазовым переходом первого рода.
Способность плавиться относится к физическим свойствам вещества
При нормальном давлении, наибольшей температурой плавления среди металлов обладает вольфрам (3422 °C), простых веществ вообще — углерод (по разным данным 3500 — 4500 °C) а среди произвольных веществ — карбид гафния HfC (3890 °C).
Можно считать, что самой низкой температурой плавления обладает гелий: при нормальном давлении он остаётся жидким при сколь угодно низких температурах.
Многие вещества при нормальном давлении не имеют жидкой фазы. При нагревании они путем сублимации сразу переходят в газообразное состояние.
Рисунок 9 — Плавление льда
Кристаллизация — процесс фазового перехода вещества из жидкого состояния в твёрдое кристаллическое с образованием кристаллов.
Фазой называется однородная часть термодинамической системы отделённая от других частей системы (других фаз) поверхностью раздела, при переходе через которую химический состав, структура и свойства вещества изменяются скачками.

Рисунок 10 — Кристаллизация воды с образованием льда
Кристаллизация — это процесс выделения твёрдой фазы в виде кристаллов из растворов или расплавов, в химической промышленности процесс кристаллизации используется для получения веществ в чистом виде.
Кристаллизация начинается при достижении некоторого предельного условия, например, переохлаждения жидкости или перенасыщения пара, когда практически мгновенно возникает множество мелких кристалликов — центров кристаллизации. Кристаллики растут, присоединяя атомы или молекулы из жидкости или пара. Рост граней кристалла происходит послойно, края незавершённых атомных слоев (ступени) при росте движутся вдоль грани. Зависимость скорости роста от условий кристаллизации приводит к разнообразию форм роста и структуры кристаллов (многогранные, пластинчатые, игольчатые, скелетные, дендритные и другие формы, карандашные структуры и т. д.).
В процессе кристаллизации неизбежно возникают различные дефекты.
На число центров кристаллизации и скорость роста значительно влияет степень переохлаждения.
Степень переохлаждения — уровень охлаждения жидкого металла ниже температуры перехода его в кристаллическую (твердую) модификацию. Она необходима для компенсации энергии скрытой теплоты кристаллизации. Первичной кристаллизацией называется образование кристаллов в металлах (и сплавах) при переходе из жидкого состояния в твердое.
Удельная теплота плавления (также: энтальпия плавления; также существует равнозначное понятие удельная теплота кристаллизации) — количество теплоты, которое необходимо сообщить одной единице массы кристаллического вещества в равновесном изобарно-изотермическом процессе, чтобы перевести его из твёрдого (кристаллического) состояния в жидкое (то же количество теплоты выделяется при кристаллизации вещества).
Количество теплоты при плавлении или кристаллизации: Q=mл
Испарение и кипение. Удельная теплота парообразования
Испарение — процесс перехода вещества из жидкого состояния в газообразное (пар).
Процесс испарения является обратным процессу конденсации (переход из парообразного состояния в жидкое. Испарение (парообразование), переход вещества из конденсированной (твердой или жидкой) фазы в газообразную (пар); фазовый переход первого рода.
Существует более развёрнутое понятие испарения в высшей физике
Испарение — это процесс, при котором с поверхности жидкости или твёрдого тела вылетают (отрываются) частицы (молекулы, атомы), при этом Ek > Eп.

Рисунок 11 — Испарение над кружкой чая
Удельная теплота испарения (парообразования) (L) — физическая величина, показывающая количество теплоты, которое необходимо сообщить 1 кг вещества, взятому при температуре кипения, чтобы перевести его из жидкого состояния в газообразное. Удельная теплота испарения измеряется в Дж/кг.
Кипение — процесс парообразования в жидкости (переход вещества из жидкого в газообразное состояние), с возникновением границ разделения фаз. Температура кипения при атмосферном давлении приводится обычно как одна из основных физико-химических характеристик химически чистого вещества.
Кипение является фазовым переходом первого рода. Кипение происходит гораздо более интенсивно, чем испарение с поверхности, из-за образования очагов парообразования, обусловленных как достигнутой температурой кипения, так и наличием примесей.
На процесс образования пузырьков можно влиять с помощью давления, звуковых волн, ионизации. В частности, именно на принципе вскипания микрообъёмов жидкости от ионизации при прохождении заряженных частиц работает пузырьковая камера.

Рисунок 12 — Кипящая вода
Количество теплоты при кипении, испарении жидкости и конденсации пара: Q=mL
Энергия, которую тело получает или теряет при теплопередаче, называется количеством теплоты. Обозначается буквой Q и измеряется в джоулях (Дж).
Количество теплоты, необходимое для нагревания тела (или выделяемое им при остывании),
зависит от рода вещества, из которого оно состоит, от массы этого тела и от изменения его температуры.
Чтобы подсчитать количество теплоты, необходимое для нагревания тела или выделяемое им при охлаждении, нужно удельную теплоемкость вещества умножить на массу тела и на разность между большей и меньшей его температурами.
Где с – удельная теплоемкость данного вещества, m – его масса, t 1 -начальная температура тела, t 2 — его конечная температура.
Физическая величина, показывающая, какое количество теплоты требуется для изменения температуры тела из данного вещества массой 1 кг на 1 °С, называется удельной теплоемкость. Измеряется в Дж/(кг·ºС).
Как правило, металлы обладают низкой удельной теплоемкость, поэтому они быстро нагреваются и также быстро остывают.
Переход вещества из твердого состояния в жидкое, называют плавлением. Температуру, при которой вещество плавится, называют температурой плавления вещества. Переход вещества из жидкого состояния в твердое, называют отвердеванием или кристаллизацией. Температуру, при которой вещество отвердевает (кристаллизуется), называют температурой отвердевания или кристаллизации. Вещества отвердевают при той же температуре, при которой плавятся. Температура плавления и кристаллизации зависит от атмосферного давления: чем выше давление, тем выше температура плавления. Поэтому в таблице значения температуры плавления представлены при нормальном атмосферном давлении.
Физическая величина, показывающая, какое количество теплоты необходимо сообщить кристаллическому телу массой 1 кг, чтобы при температуре плавления полностью перевести его в жидкое состояние, называется удельной теплотой плавления. Обозначается буквой λ и измеряется в Дж/кг.
Количество теплоты, необходимое для плавления вещества массы m, взятого при температуре плавления, рассчитывается по формуле: Q=λ·m.
Для расчета количества теплоты в данных процессах значения удельных величин даны в таблицах.
Процесс плавления всегда протекает при поглощении энергии, обратный процесс идет с выделением энергии. При этом, так как в процессе плавления температура остается постоянной, средняя кинетическая энергия хаотического движения молекул не изменяется, меняется потенциальная энергия их взаимодействия.
молекулярного взаимодействия.
В нагреваемом сосуде одновременно присутствует и лед и вода – два агрегатных состояния одного и того же вещества, до тех пор, пока не растает весь лед. Далее, нагревается образовавшаяся вода. Так как удельная теплоемкость воды больше, чем удельная теплоемкость льда, вода нагревается медленнее, угол наклона линии меньше.
плавлением
отвердеванием ,
Опыт показывает, что любое вещество кристаллизуется и плавится при одной и той же температуре.
На рисунке представлен график зависимости температуры кристаллического тела (льда) от времени нагревания (от точки А до точки D) и времени охлаждения (от точки D до точки K ). На нем по горизонтальной оси отложено время, а по вертикальной — температура.
Из графика видно, что наблюдение за процессом началось с момента, когда температура льда была -40 °С, или, как принято говорить, температура в начальный момент времени t нач = -40 °С (точка А на графике).
При дальнейшем нагревании температура льда растет (на графике это участок АВ ).
Увеличение температуры происходит до 0 °С — температуры плавления льда. При 0°С лед начинает плавиться, а его температура перестает расти. В течение всего времени плавления (т.е. пока весь лед не расплавится) температура льда не меняется, хотя горелка продолжает го-реть и тепло, следовательно, подводится. Процессу плавления соответствует горизонтальный учас-ток графика ВС. Только после того как весь лед расплавится и превратится в воду , температура снова начинает подниматься (участок CD ).
После того, как температура воды достигнет +40 °С, горелку гасят и воду начинают охлаждать, т. е. тепло отводят (для этого можно сосуд с водой по-местить в другой, больший сосуд со льдом).
Температура воды начинает снижаться (участок DE ).
При достижении температуры 0 °С температура воды перестает снижаться, несмотря на то, что тепло по-прежнему отводится. Это идет процесс кристаллизации воды — образования льда (гори-зонтальный участок EF ). Пока вся вода не превратится в лед, температура не изменится. Лишь после этого начинает уменьшаться температура льда (участок FK ).
Вид рассмотренного графика объясняется следующим образом. На участке АВ благодаря подводимому теплу средняя кинетическая энергия молекул льда увеличивается, и температура его повышается. На участке ВС вся энергия, получаемая содержимым колбы, тратится на разрушение кристаллической решетки льда: упорядоченное пространственное расположение его молекул сменяется неупорядоченным, меняется расстояние между молекулами, т.е. происходит перестройка молекул таким образом, что вещество становится жидким. Средняя кинетическая энергия моле-кул при этом не меняется, поэтому неизменной остается и температура. Дальнейшее увеличение температуры расплавленного льда-воды (на участке CD ) означает увеличение кинетической энер-гии молекул воды вследствие подводимого горелкой тепла.
При охлаждении воды (участок DE ) часть энергии у нее отбирается, молекулы воды движутся с меньшими скоростями, их средняя кинетическая энергия падает — температура уменьшается, вода охлаждается. При 0°С (горизонтальный участок EF ) молекулы начинают выстраиваться в определенном порядке, образуя кристаллическую решетку. Пока этот процесс не завершится, температура вещества не изменится, несмотря на отводимое тепло, а это означает, что при отвер-девании жидкость (вода) выделяет энергию. Это как раз та энергия, которую поглотил лед, пре-вращаясь в жидкость (участок ВС ).
Внутренняя энергия у жидкости больше, чем у твердого тела. При плавлении (и кристаллизации) внутренняя энергия тела меняется скачком.
тугоплавкими
Подчеркнем еще раз, что при плавлении вещество поглощает энергию. При кристаллизации оно, наоборот, отдает ее в окружающую среду. Получая определенное количество теплоты, выделяющееся при кристаллизации, среда нагревается. Это хорошо известно многим птицам. Неда-ром их можно заметить зимой в морозную погоду сидящими на льду, который покрывает реки и озера. Из-за выделения энергии при образовании льда воздух над ним оказывается на несколько градусов теплее, чем в лесу на деревьях, и птицы этим пользуются.
Плавление аморфных веществ.
точки плавления
Аморфные вещества
Причины этого лежат в коренном отличии строения аморфных тел от строения кристаллических. Атомы в аморфных телах расположены беспорядочно. Аморфные тела по своему строению напоминают жидкости. Уже в твердом стекле атомы расположены беспорядочно. Значит, повы-шение температуры стекла лишь увеличивает размах колебаний его молекул, дает им постепенно все большую и большую свободу перемещения. Поэтому стекло размягчается постепенно и не обнаруживает резкого перехода «твердое—жидкое», характерного для перехода от расположения молекул в строгом порядке к беспорядочному.
Теплота плавления. , Теплота плавления
Изучая на опыте плавление различных веществ одной и той же массы, можно заметить, что для превращения их в жидкость требуется разное количество теплоты. Например, для того чтобы расплавить один килограмм льда, нужно затратить 332 Дж энергии, а для того чтобы расплавить 1 кг свинца — 25 кДж .
Количество теплоты, выделяемое телом, считается отрицательным. Поэтому при расчете количества теплоты, выделяющегося при кристаллизации вещества массой m , следует пользоваться той же формулой, но со знаком «минус»:
Теплота сгорания. , Теплота сгорания
Для нагревания тел часто используют энергию, выделяющуюся при сгорании топлива. Обыч-ное топливо (уголь, нефть, бензин) содержит углерод . При горении атомы углерода соединяются с атомами кислорода , содержащегося в воздухе, в результате чего образуются молекулы углекислого газа . Кинетическая энергия этих молекул оказывается большей, чем у исходных частиц. Увеличение кинетической энергии молекул в процессе горения называют выделением энергии. Энергия, выделяющаяся при полном сгорании топлива, и есть теплота сгорания этого топлива.
Теплота сгорания топлива зависит от вида топлива и его массы. Чем больше масса топлива, тем больше количество теплоты, выделяющейся при его полном сгорании.
удельной теплотой сгорания топлива.
Количество теплоты Q , выделяющееся при сгорании m кг топлива, определяют по формуле:
Чтобы найти количество теплоты, выделяющееся при полном сгорании топлива произвольной массы, нужно удельную теплоту сгорания этого топлива умножить на его массу.
