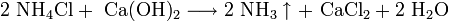1. Общая характеристика щелочных металлов
восстановительные
Некоторые свойства щелочных металлов
| Атомный
номер |
Название,
символ |
Металлический
радиус, нм |
Ионный
радиус, нм |
Потенциал
ионизации, эВ |
ЭО | p,
г/см³ |
t пл ,
°C |
t кип ,
°C |
|---|---|---|---|---|---|---|---|---|
| 3 | Литий Li | 0,152 | 0,078 | 5,32 | 0,98 | 0,53 | 181 | 1347 |
| 11 | Натрий Na | 0,190 | 0,098 | 5,14 | 0,93 | 0,97 | 98 | 883 |
| 19 | Калий K | 0,227 | 0,133 | 4,34 | 0,82 | 0,86 | 64 | 774 |
| 37 | Рубидий Rb | 0,248 | 0,149 | 4,18 | 0,82 | 1,53 | 39 | 688 |
| 55 | Цезий Cs | 0,265 | 0,165 | 3,89 | 0,79 | 1,87 | 28 | 678 |
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы. Многие минералы содержат в своём составе металлы главной подгруппы I группы. Например, ортоклаз , или полевой шпат , состоит из алюмюсиликата калия K2 [Al2 Si6 O16 ], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2 [Al2 Si6 O16 ]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl
- KCl, карналлит KCl
- MgCl2
- 6H2 O, полигалит K2 SO4
- MgSO4
- CaSO4
- 2H2 O.
2. Химические свойства щелочных металлов
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту (Li, Cs) их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой . Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
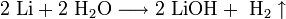
- При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом . Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
- Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
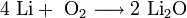
- При горении натрия в основном образуется пероксид Na2 O2 с небольшой примесью надпероксида NaO2 :
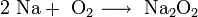
- В продуктах горения калия , рубидия и цезия содержатся в основном надпероксиды:
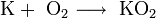
- Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:

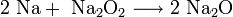
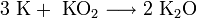
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О 2 2− и надпероксид-ион O2 − .
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3 . Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
| Формула
кислородного соединения |
Цвет |
|---|---|
| Li 2 O | Белый |
| Na 2 O | Белый |
| K 2 O | Желтоватый |
| Rb 2 O | Жёлтый |
| Cs 2 O | Оранжевый |
| Na 2 O2 | Светло-
жёлтый |
| KO 2 | Оранжевый |
| RbO 2 | Тёмно-
коричневый |
| CsO 2 | Жёлтый |
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
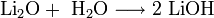
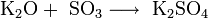
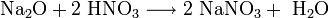
Пероксиды
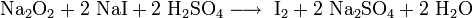
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
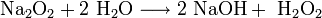
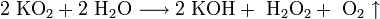
3. Взаимодействие с другими веществами . Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов , сульфидов , нитридов , фосфидов , карбидов и силицидов :
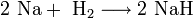
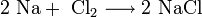
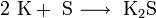
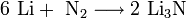
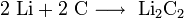
интерметаллиды
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах:
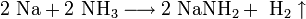
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:
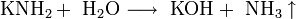
Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей):
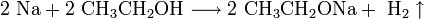
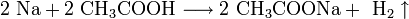
4. Качественное определение щелочных металлов . Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
Окраска пламени щелочными металлами
и их соединениями
| Щелочной металл | Цвет пламени |
|---|---|
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Бурокрасный |
| Cs | Фиолетово-красный |
3. Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов , чаще всего — хлоридов, образующих природные минералы:
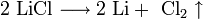
катод: Li + + e → Li
анод: 2Cl − — 2e → Cl2
2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
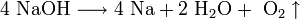
катод: Na + + e → Na
анод: 4OH − — 4e → 2H2 O + O2
3. Щелочной металл может быть восстановлен из соответствующего хлорида или бромида кальцием, магнием, кремнием и др. восстановителями при нагревании под вакуумом до 600-900 °C:
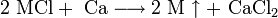
Чтобы реакция пошла в нужную сторону, образующийся свободный щелочной металл (M) должен удаляться путём отгонки. Аналогично возможно восстановление цирконием из хромата. Известен способ получения натрия восстановлением из карбоната углём при 1000 °C в присутствии известняка. ]
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
4. Соединения щелочных металлов
4.1. Гидроксиды
Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
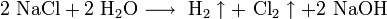
катод: 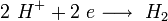
анод: 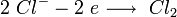
- Прежде щёлочь получали реакцией обмена:

Получаемая таким способом щёлочь была сильно загрязнена содой Na 2 CO3 .
Гидроксиды щелочных металлов — белые гигроскопичные вещества, водные растворы которых являются сильными основаниями. Они участвуют во всех реакциях, характерных для оснований — реагируют с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами:

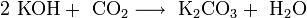
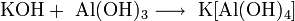
Гидроксиды щелочных металлов при нагревании возгоняются без разложения, за исключением гидроксида лития, который так же, как гидроксиды металлов главной подгруппы II группы, при прокаливании разлагается на оксид и воду:
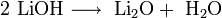
Гидроксид натрия используется для изготовления мыла, синтетических моющих средств, искусственного волокна, органических соединений, например фенола.
4.2. Карбонаты
сода Na 2 CO3
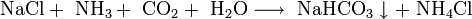
- Аммиак добавляют для нейтрализации кислотной среды, возникающей при пропускании углекислого газа в раствор, и получения гидрокарбонат-иона HCO 3 − , необходимого для осаждения гидрокарбоната натрия. После отделения питьевой соды раствор, содержащий хлорид аммония, нагревают с известью и выделяют аммиак, который возвращают в реакционную зону:
- Таким образом, при аммиачном способе получения соды единственным отходом является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
кальцинированная
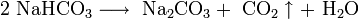
Основной потребитель соды — стекольная промышленность.
В отличие от малорастворимой кислой соли NaHCO 3 , гидрокарбонат калия KHCO3 хорошо растворим в воде, поэтому карбонат калия, или поташ , K2 CO3 получают действием углекислого газа на раствор гидроксида калия:
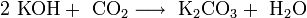
Поташ используют в производстве стекла и жидкого мыла.
Литий — единственный щелочной металл, для которого не получен гидрокарбонат. Причина этого явления в очень маленьком радиусе иона лития, который не позволяет ему удерживать довольно крупный ион HCO 3 − .
5. Фотографии
Литература
[Электронный ресурс]//URL: https://drprom.ru/referat/schelochnyie-metallyi/
- Ахметов Н. С. Общая и неорганическая химия. — М .: Высшая школа, 2001.
- Ерёмина Е. А., Рыжова О. Н. Глава 14. Щелочные металлы // Справочник школьника по химии. — М .: Экзамен, 2009. — С. 224-231. — 512 с. — 5000 экз . — ISBN 978-5-377-01472-0
- Кузьменко Н. Е. , Ерёмин В. В., Попков В. А. Начала химии. Современный курс для поступающих в вузы. — М .: Экзамен, 1997-2001.
- Лидин Р. А., Андреева Л. Л., Молочко В. А. Справочник по неорганической химии. — М .: Химия, 1987.
- Некрасов Б. В. Основы общей химии. — М .: Химия, 1974.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М .: МГУ, 1991, 1994.
- Турова Н. Я. Неорганическая химия в таблицах. Учебное пособие. — М .: Высший химический колледж РАН, 1997.
Примечания
Данный реферат составлен на основе .