МІНІСТЕРСТВО ОСВІТИ ТА НАУКИ УКРАЇНИ
НАЦІОНАЛЬНИЙ АВІАЦІЙНИЙ УНІВЕРСИТЕТ
АЕРОКОСМІЧНИЙ ІНСТИТУТ
КАФЕДРА ХІММОТОЛОГІЇ
ПОЯСНЮВАЛЬНА ЗАПИСКА
ТЕМА:
Фізико-хімічні властивості газу
ВИКОНАВ: студент МЕФ IV 401
Едель Аліна Вікторівна
Київ 2010
ЗМІСТ
Вступ
Фізико-хімічні властивості природних газів
Основні параметри газів
Термодинамічні властивості газів
Токсичні і теплові властивості газів
ІІІ. Висновки
ВСТУП
Даний реферат розкриває фізико-хімічні властивості газів, висвітлюючи, по-перше, основні параметри газів з наведенням розрахункових формул для їх знаходження, а саме: густину, питомий об’єм, масовий розхід, лінійну швидкість, масову швидкість, тиск, в’язкість, вологість, стисливість, а також критичні параметри; по-друге, такі термодинамічні властивості газів, як теплоємність системи, теплопровідність, теплота згорання, розглянуть процес дроселювання; по-третє, токсичні і теплотворні властивості природних газів. В роботі також наводяться графіки та номограми для визначення тих чи інших властивостей.
Метою даної роботи є детальний і різноплановий розгляд властивостей газу задля глибшого ознайомлення з основами дисципліни «Газ і паливно-мастильні матеріали» та розуміння природи багатьох явищ, з котрими стикаються експлуатаційники газотранспортної системи.
Завданням є вивчення фізичних параметрів газу, його термодинамічні й теплові властивості, зумовлені хімічним складом; вивчення токсичних властивостей та їхній можливий вплив на організм людини; отримання практичних знань та вмінь в знаходженні того чи іншого параметру газу, виходячи з розрахункових формул та довідкових матеріалів; закріпити та поглибити вивчений раніше матеріал.
ФІЗИКО-ХІМІЧНІ ВЛАСТИВОСТІ ГАЗІВ
1. Основні параметри газів
Природні гази поділяються на три групи: гази, які добуваються з чисто газових родовищ і складаються в основному з метану (82—98 %), гази, які одержують із газоконденсатних родовищ і є сумішшю газу та конденсату широкої фракції, що складається з бензину, лігроїну, їй росину, а іноді й солярового масла — цей газ також містить значну кількість метану (80—95 %); гази, які добуваються разом із нафтою з нафтових родовищ — це попутні гази, що складаються з суміші газу з газовим тином і пропан-бутанової фракції, містять тільки ЗОЛІ % метану.
Зріджений газ та його використання
... й використання таких газів. Тема роботи актуальна нині, оскільки скраплені гази затребувані у багатьох областях медицини, науку й техніки. 1. Природа явища і їхні властивості скраплених газів Безперервні ... до того, що у ній втрачається частина тиску газу та газ виходить із перегородки за більш низькому тиску. Газ розширюється чидросселируется.Дросселем називається будь-яке пристрій, що представляє ...
До основних параметрів газу відносяться:
Густина газу (кг/м 3 ) — маса одиниці об’єму, що дорівнює відношенню молекулярної маси Мг газу до об’єму моля:
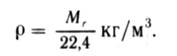
Сума молекулярних мас атомів, що складають молекулу, називається молекулярною масою речовини.
Якщо відомий мольний, тобто об’ємний склад суміші газу у відсотках, то середня молекулярна маса його ![]() визначається по формулі:
визначається по формулі:
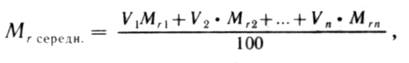
V 1 , V2 , … Vn — мольні (об’ємні) концентрації компонентів, %;
M r1 , Mr2 , … Mrn — молекулярні маси компонентів. Якщо відомий масовий склад суміші у відсотках, то його середня молекулярна маса визначається:
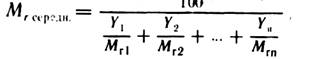
де![]() — масові концентрації, %.
— масові концентрації, %.
Якщо молекулярний склад виражений у частках одиниці, то відповідно середня молекулярна маса:
![]()
де ![]() — молекулярний склад у частках одиниць,
— молекулярний склад у частках одиниць,
![]() — маси компонентів. У розрахунках використовують відносну густину природного газу по повітрю. Густина повітря при нормальних умовах дорівнює 1,293 кг/м3 .
— маси компонентів. У розрахунках використовують відносну густину природного газу по повітрю. Густина повітря при нормальних умовах дорівнює 1,293 кг/м3 .
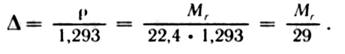
Оскільки густина залежить від тиску (Р), температури (Т) і стисливості (Z) газу, то перерахунок густини (ρ г ) на інший тиск (Рг) проводиться по формулі:
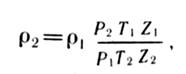
де![]() — відповідають умовам для ρ1 .
— відповідають умовам для ρ1 .
![]() — параметри, при яких необхідно ви зачити ρ2 .
— параметри, при яких необхідно ви зачити ρ2 .
Питомий об’єм газу— об’єм одиниці маси газу:
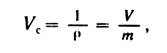
Де V — об’єм газу, м 3 ;
- m — маса газу, кг;
Vc — питомий об’єм середовища, м 3 /кг.
Число Воббе – характеристика якості газу, що визначає взаємозаміну різних газів (одна із експлуатаційних характеристик).
Як фізична величина визначає відношення вищої теплоти згорання палива до квадрату з його відносної густини:
W = ![]()
Тиск – дорівнює відношенню нормальної складової сили (N) до площі (S) на яку діє сила:
![]()
де Р вар — різниця між барометричним тиском і абсолютним
![]()
при рівномірному розподілі сил:
![]()
Абсолютний тиск газів (Р) — це тиск газів на стінки трубопроводів і посудин.
Надмірний тиск газів (Р надм .) — різниця між абсолютним тиском газу і барометричним (Рбар .)
![]()
У гідравлічних розрахунках газопроводів використовують абсолютний тиск.
В’язкість газу — це властивість газу чинити опір при русі, яка виникає в результаті сил тертя між шарами газу, що рухається. Коефіцієнт, який враховує цю властивість реальних газів, називається коефіцієнтом динамічної (абсолютної) в’язкості (Па
- с) і визначається по формулі:
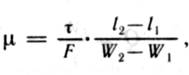
де ![]() — тангенціальна сила внутрішнього тертя,
— тангенціальна сила внутрішнього тертя,
![]() — відстань між нескінченно тонкими шарами середовища, які рухаються з швидкістю W2 -W1 .
— відстань між нескінченно тонкими шарами середовища, які рухаються з швидкістю W2 -W1 .
Залежність динамічної в’язкості газів від температури виражається формулою Сатерланда:
| |
де μ – динамічна в’язкість газу при заданій температурі
μ0 – в’язкість газу при 273 °К;
- С – температура газу °К;
У гідравлічних розрахунках використовують поняття кінематичної в’язкості (м/с), яка визначається співвідношенням:
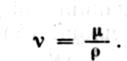
Кінематична в’язкість залежно від температури і тиску виражається формулою:
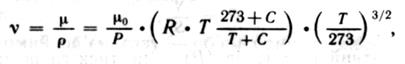
де ν – кінематична в’язкість, м 2 /с;
μ – динамічна в’язкість, Па
- с;
ρ – густина, кг/м 3 ;
R – газова стала, Дж/кмоль
- К.
Із підвищенням температури газу в’язкість збільшується.
При наявності в природному газі сірководню (Н 2 5), вуглекислого газу (С02 ) і азоту (N2 ) в’язкість його трохи збільшується.
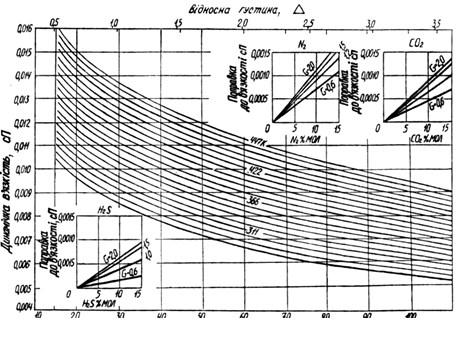
Рис.1.01 Залежність в’язкості газів від молекулярної маси при атмосферному тискові
Залежність в’язкості газів від молекулярної маси при атмосферному тискові показано на графіку (рис. 1.01).
Вологість — природний газ у пластових умовах, насичений парами води, які при русі газу конденсуються, збираються в низьких місцях газопроводів, порушуючи технологічний режим транспортування газу. Сполучення води з кислими газами сприяє інтенсивній корозії обладнання. Крім того, при певних тисках у присутності вологи в газі утворюються — кристалогідрати, які закупорюють прохідний переріз газопроводу й арматури, що може призвести до аварійної ситуації.
Наявність вологи в газі характеризується абсолютною і відносною вологістю. Абсолютна вологість (U) характеризує вміст водяних парів в одиниці об’єму газу в г/м 3 або кг/1000 м3 .
Відносна вологість (Uо) —відношення абсолютної вологості при даних тиску і температурі до його вологоємності, тобто до кількості вологи в одиниці об’єму газу, що міститься при умовах насичення. Відносна вологість вимірюється в частках одиниці або відсотках. Відносна вологість газу, насиченого парами води, дорівнює 100 %.
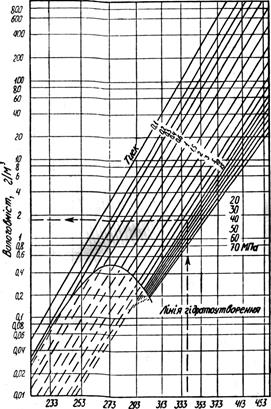
Вологовміст природних газів залежить від тиску, температури, складу газу й води, характеристики середовища контакту і визначається по номограмі (рис. 1.02).
Температура, °к
Рис. 1.02. Номограма для визначення вологовмісту природного газу
Температура, при якій газ повністю насичений водяними парами, називається точкою роси даного газу.
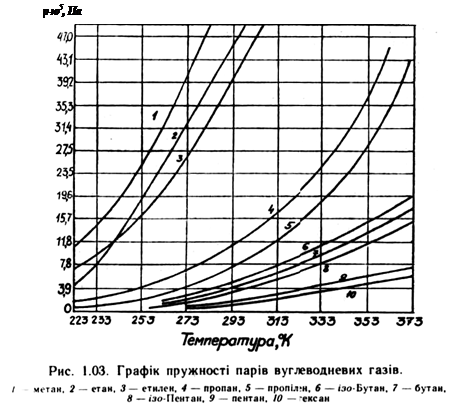
Тиск насичених парів вуглеводнів є функцією темпера тури. При підвищенні температури рідини тиск збільшується за рахунок переходу частини рідини в пароподібний стан. При рівновазі парової і рідкої фаз парціальний тиск компонента в паровій фазі (над рідиною) і в рідкій фаз (в рідині) буде однаковим.
Тиск, при якому рідина при даній температурі знаходиться в стані рівноваги зі своїми парами, називається пружністю насичених парів рідини. Залежність пружності парів вуглеводневих газів показана на рисунку 1.03
 |
Стисливість газу характеризує відхилення властивостей реальних газів від законів ідеального газу. Об’єм реальних газів змінюється не пропорційно його тиску й температурі і при однакових умовах стискується більше або менше, ніж ідеальний газ на величину Z— коефіцієнт стисливості, який визначають експериментально або по номограмі залежно від приведених температури й тиску газу.
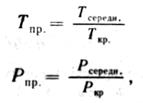
де![]() —середні температура й тиск газу;
—середні температура й тиск газу;
![]() — середньокритичні температура й тиск газу
— середньокритичні температура й тиск газу
відповідно в °К, МПа.
Критичною температурою називають таку температуру, вище якої при будь-якому тиску не можна сконденсувати пару (перевести в рідкий стан).
Критичним тиском називають такий тиск, вище якого не можна випарити рідину при будь-якому підвищенні температури.
2. ТЕРМОДИНАМІЧНІ ВЛАСТИВОСТІ ГАЗІВ
Теплоємність системи, Дж/°К,— це відношення кількості теплоти Q, поглинутої газом у певному термодинамічному процесі, до приросту температури ΔТ:
![]()
Відношення теплоємності (С) однорідного тіла до його маси (m) називається питомою масовою теплоємністю (Дж/кг·Кº), тобто:
![]()
Теплоємність реальних газів залежить від складу газу, температури й тиску.
Теплопровідність визначається кількістю теплоти (Q), що проходить крізь стінку площею (F), товщиною (δ) за проміжок часу (τ) при різниці температур по обидві сторони стінки (T 1 — Т2 ) :
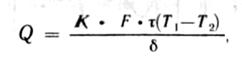
де К — коефіцієнт теплопровідності у Вт/м*°К.
Із підвищенням тиску теплопровідність газів зростає (рис. 1.04).
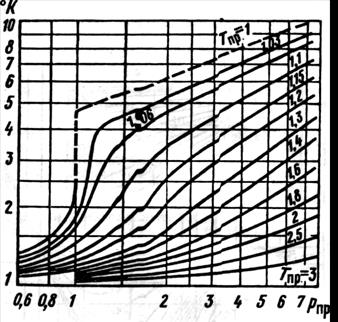
Рис. 1.04 Залежність теплопровідності від приведених температури Т пр . і тиску Рпр
Теплота згоряння (теплотворна здатність) — це тепло, що виділяється при згорянні одиниці об’єму (або маси) газу за певних умов. Теплота згоряння визначається кількістю тепла, яке виділяється при охолодженні продуктів згоряння до 273 °К і при конденсації утвореної вологи. Теплоту згоряння природного газу можна підрахувати по теплоті згоряння.
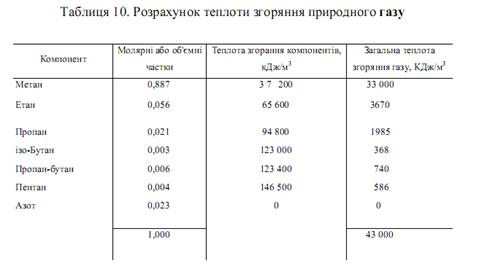
Наявність компонентів, які входятьу його склад, припускаючи, що природний газ підлягає законам ідеального газу (табл. 1.01).
інертних газів у газовій суміші зменшує її теплоту згоряння (рис. 1.06).
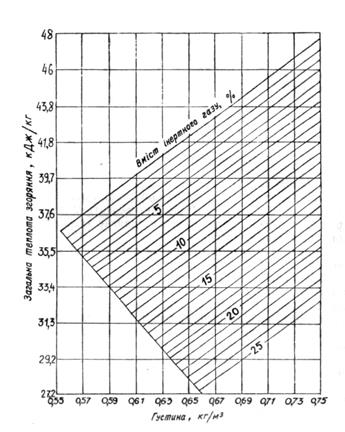
Рис. 1.05 Залежність теплотворної здатності природного газу від його густини і вмісту інертних газів
Дроселювання газу — це технологічний процес при добуванні і транспортуванні газу, приякому відбувається різке зниження тиску і розширення газового потоку. При [у залежно від перепаду тисків знижується температура газу. Зміна температури газу при _дроселюванні отримала назву ефекту Джоуля-Томсона. Зміну температури газу при йогодроселюванні можна визначити по номограмі (рис.1.06).
Для визначення температури газу після дроселювання знаходять точку з координатами, що відповідає початковим тиску й температурі (до штуцера), а потім цю точку переміщують паралельно найближчійгазоентальпії кінцевого тиску (після штуцера).
Ордината цієї точки в новому положенні визначить кінцевутемпературу (після штуцера).
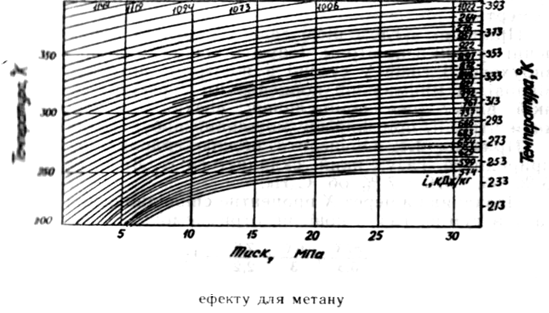 |
Рис. 1.06 номограма для визначення інтегрального дросельного ефекту для метану
3.ТОКСИЧНІ І ТЕПЛОВІ ВЛАСТИВОСТІ ГАЗІВ
Небезпечними властивостями вуглеводневих газів е їх токсичність, пожежонебезпечність і здатність до утворення вибухонебезпечних сумішей із повітрям.
В атмосферному повітрі населених пунктів, у повітрі робочої зони і у воді водоймищ санітарно-побутового водокористування встановлюються гранично допустимі концентрації шкідливих речовин, які затверджуються Міністерством охорони здоров’я України.
Із газових компонентів природних і попутних газів особливо токсичний сірководень, його запах відчувається при вмісті в повітрі 0,0014—0,0023 мг/л.
Сірководень є отрутою, що викликає параліч органів дихання й серця. Концентрація сірководню 0,06 мг/л викликає головний біль. При концентраціях 1 мг/л і вище настають гостре отруєння і смерть. Гранично допустима концентрація сірководню в робочій зоні виробничих приміщень — 0,01 мг/л, а в присутності вуглеводнів С 1 — С5 — 0,003 мг/л.
Характер дії на організм людини вуглекислого газу — наркотичний, при високих концентраціях викликає швидку задуху через нестачу кисню. Вміст 4—5 % вуглекислого газу в повітрі призводить до запаморочення голови, підвищує кров’яний тиск. Вдихання високих концентрацій вуглекислого газу (20 %) спричиняє зупинку дихання і смерть.
Природні вуглеводневі гази утворюють вибухонебезпечні суміші з повітрям. Існують концентраційні границі вибуховості газів у суміші з повітрям: нижня границя відповідає мінімальній концентрації горючого газу, при якій вибух уже неможливий; верхня — максимальній концентрації, при якій ще можливий вибух.
При вибуху швидкість поширення детонаційної хвилі горіння (900— 3000 м/с) перевищує швидкість звуку в повітрі.
При концентрації газу в повітрі в межах запалювання при наявності джерела запалювання виникне вибух. Якщо вміст газу в повітрі менше нижньої і більше верхньої границі вибуховості, то суміш не здатна вибухати. При цьому вона згоряє спокійним полум’ям. Швидкість поширення фронту хвилі горіння при атмосферному тиску становить близько 0,3—2,4 м/с.
Тиск, що виникає при вибуху газоповітряної суміші, визначається по формулі:
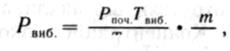
де Р поч — початковий тиск газоповітряної суміші до вибуху в Па;
Т виб — температура газів, які утворюються при вибуху (1900—2000 °С), °К;
Т поч — температура газоповітряної суміші до вибуху, °К;
- m — об’єм продуктів горіння газу з урахуванням азот) повітря;
- п — об’єм суміші газу в повітрі до вибуху.
Величини т і п визначаються рівняннями реакцій горіння складових частин газу з урахуванням балансу газу й азоту в повітрі, які беруть участь у реакції.
ВИСНОВКИ
Таким чином, ми розглянули фізико-хімічні властивості газів з трьох аспектів: з боку визначення основних параметрів, термодинамічних властивостей, а також токсичних і теплових властивостей. Такий підхід дав нам змогу побачити зв’язок між хімічною структурою, фізичними параметрами газу та навколишнього середовища та його поведінкою у тих чи інших процесах. Саме такий аналіз дозволяє нам, майбутнім експлуатаційникам газотранспортної системи, у подальшому вирішувати широке коло проблем, пов’язаних із професійною діяльність, проводити спеціальні розрахунки щодо характеристик газу, розуміти природу явищ, пов’язаних зі зберіганням, транспортуванням і використанням природного газу.
Отже, наразі ця інформація є завжди актуальною та необхідною, а особливо – у контексті майбутньої модернізації газотранспортної системи України, що є однією з найпотужніших у Європі.
ЛІТЕРАТУРА
1. Громов А.В., Гузанов Н.Е., Хачикян Л.А. Эксплуатационнику магистральных газопроводов.— М.: Недра, 1987. – 548с.
2. Розгонюк В.В., Удолов О.С., Нікішин В.П. Експлуотаційникові газонафтового комплексу: довідник. – К.: Росток, 1998. – 431 с.
3. Бойченко С.В., Моца В.Г., Тітова О.С. Газ і паливно-мастильні матеріали: Навчальний посібник. – К.:НАУ, 2002, — 188 с.
