— процесс парообразования в жидкости (переход вещества из жидкого в газообразное состояние), с возникновением границ разделения фаз. Температура кипения при атмосферном давлении приводится обычно как одна из основных физико-химических характеристик химически чистого вещества.
Кипение является фазовым переходом первого рода. Кипение происходит гораздо более интенсивно, чем испарение с поверхности, из-за образования очагов парообразования, обусловленных как достигнутой температурой кипения, так и наличием примесей [1] .
На процесс образования пузырьков можно влиять с помощью давления, звуковых волн, ионизации. В частности, именно на принципе вскипания микрообъёмов жидкости от ионизации при прохождении заряженных частиц работает пузырьковая камера.
Кипячение — нагревание жидкости (обычно воды) до температуры кипения. Физический способ дезинфекции.
1. Термодинамические особенности
По мере нагрева жидкости, на греющей поверхности образуются пузырьки пара внутрь которых испаряется жидкость. При определенной температуре, давление насыщенного пара внутри пузырька становится равным наружному давлению. В этот момент пузырек отрывается от стенки и жидкость начинает кипеть. Таким образом, если испарение происходит при любой температуре, то кипение — при одной, определенной для текущего давления. Когда процесс кипения начался, то несмотря на продолжающийся подвод тепла температура жидкости не изменяется, пока вся жидкость не превратится в пар. Температура, при которой происходит кипение жидкости, находящейся под постоянным давлением, называется температурой кипения или температурой насыщения 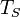 . С увеличением давления, cогласно уравнению Клапейрона — Клаузиуса, температура насыщения возрастает:
. С увеличением давления, cогласно уравнению Клапейрона — Клаузиуса, температура насыщения возрастает:
-
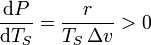 .
. - где — удельная теплота парообразования;
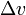 — изменение удельного объёма тела при фазовом переходе.
— изменение удельного объёма тела при фазовом переходе.
1.1. Линия насыщения
На фазовой диаграмме воды, кривая, характеризующая фазовой переход из жидкого состояния в газообразное называется «линией насыщения». Она ограничена двумя предельными точками: тройной точкой, в которой сходятся линии плавления, кипения и сублимации и критической точкой, в которой исчезает граница раздела между жидкой и газообразной фазами.
Кипение жидкостей, пересыщенный пар, перегретая жидкость
... - скороварках пищу варят под давлением около 200 кПа. Температура кипения воды при этом достигает 120 °С. В воде такой температуры процесс «варения» происходит значительно быстрее, чем в обычном ... находятся пары какой-нибудь жидкости, например воды, то в обычных условиях понижение температуры приведёт к тому, что пары приблизятся к состоянию насыщения, а затем начнут конденсироваться, ...
1.2. Особености кипения
В кипящей жидкости устанавливается определённое распределение температуры: у поверхностей нагрева (стенок сосуда, труб и т. п.) жидкость заметно перегрета  . Величина перегрева зависит от ряда физико-химических свойств как самой жидкости, так и граничных твёрдых поверхностей. Тщательно очищенные жидкости, лишённые растворённых газов (воздуха), можно при соблюдении особых мер предосторожности перегреть на десятки градусов без закипания. Когда такая перегретая жидкость в конце концов вскипает, то процесс кипения протекает весьма бурно, напоминая взрыв. Вскипание сопровождается расплескиванием жидкости, гидравлическими ударами, иногда даже разрушением сосудов. Теплота перегрева расходуется на парообразование, поэтому жидкость быстро охлаждается до температуры насыщенного пара, с которым она находится в равновесии. Возможность значительного перегрева чистой жидкости без кипения объясняется затрудненностью возникновения начальных маленьких пузырьков (зародышей), их образованию мешает значительное взаимное притяжение молекул жидкости. Иначе обстоит дело, когда жидкость содержит растворенные газы и различные мельчайшие взвешенные частицы. В этом случае уже незначительный перегрев (на десятые доли градуса) вызывает устойчивое и спокойное кипение, так как начальными зародышами паровой фазы служат газовые пузырьки и твердые частицы. Основные центры парообразования находятся в точках нагреваемой поверхности, где имеются мельчайшие поры с адсорбированным газом, а также различные неоднородности, включения и налеты, снижающие молекулярное сцепление жидкости с поверхностью.
. Величина перегрева зависит от ряда физико-химических свойств как самой жидкости, так и граничных твёрдых поверхностей. Тщательно очищенные жидкости, лишённые растворённых газов (воздуха), можно при соблюдении особых мер предосторожности перегреть на десятки градусов без закипания. Когда такая перегретая жидкость в конце концов вскипает, то процесс кипения протекает весьма бурно, напоминая взрыв. Вскипание сопровождается расплескиванием жидкости, гидравлическими ударами, иногда даже разрушением сосудов. Теплота перегрева расходуется на парообразование, поэтому жидкость быстро охлаждается до температуры насыщенного пара, с которым она находится в равновесии. Возможность значительного перегрева чистой жидкости без кипения объясняется затрудненностью возникновения начальных маленьких пузырьков (зародышей), их образованию мешает значительное взаимное притяжение молекул жидкости. Иначе обстоит дело, когда жидкость содержит растворенные газы и различные мельчайшие взвешенные частицы. В этом случае уже незначительный перегрев (на десятые доли градуса) вызывает устойчивое и спокойное кипение, так как начальными зародышами паровой фазы служат газовые пузырьки и твердые частицы. Основные центры парообразования находятся в точках нагреваемой поверхности, где имеются мельчайшие поры с адсорбированным газом, а также различные неоднородности, включения и налеты, снижающие молекулярное сцепление жидкости с поверхностью.
Образовавшийся пузырёк растет только в том случае, если давление пара в нём несколько превышает сумму внешнего давления, давления вышележащего слоя жидкости и капиллярного давления, обусловленного кривизной поверхности пузырька. Для создания в пузырьке необходимого давления пар и окружающая его жидкость, находящаяся с паром в тепловом равновесии, должны иметь температуру, превышающую температуру насыщения 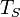 .
.
Кипение возможно не только при нагревании жидкости в условиях постоянного давления. Снижением внешнего давления при постоянной температуре можно также вызвать перегрев жидкости и её вскипание (за счёт уменьшения температуры насыщения).
Этим объясняется, в частности, явление кавитации — образование паровых полостей в местах пониженного давления жидкости (например, в вихревой зоне за гребным винтом теплохода).
1.3. Теплота парообразования
На P-V диаграмме для выбранной температуры жидкости (например Т1) точка состояния начала кипения характеризуется парой термодинамических переменных, то есть определенным термодинамическим состоянием. При кипении температура и давление остаются постоянными, при этом по мере увеличения паросодержания средняя плотность среды падает, а удельный объём, соответственно, увеличивается. После испарения всей жидкости достигается новое термодинамическое состояние . Если рассмотреть более высокое значение температуры, то начало кипения будет характеризоваться термодинамическим состоянием с большим удельным объемом, а состояние полного превращения жидкости в пар — меньшим удельным объемом. По мере увеличения температуры разница между величинами удельных объемов жидкости и пара на линии насыщения уменьшается, а при достижении температуры критической точки — исчезает. Изменение термодинамического состояния среды в процессе кипения характеризуется удельной теплотой парообразования , которая равна количеству теплоты, необходимому для полного испарения единицы массы жидкости (Во многих источниках r ошибочно именуют скрытой теплотой парообразования, на самом же деле скрытая теплота парообразования представляет собой лишь часть удельной теплоты парообразования, которая характеризует изменение внутренней энергии жидкости и направлена на увеличение расстояния между микрочастицами жидкости. При этом температура жидкости растет, но видимых изменений не происходит. Определить скрытую теплоту парообразования можно путем вычитания площадей под процессом кипения в TS и PV диаграммах)
Пластовая температура и давление
... - 1. Измерение пластовых давлений манометром по стволу скважины дает возможность определить истинную плотность жидкости и газа при данных давлении и температуре с учетом наличия ... затруднений, связанных с аномально высоким пластовым давлением, следует изучать причины, вызывающие повышенное давление. Понятие о пластовом давлении. Пластовое давление определяет состояние жидкости, а также тот запас ...
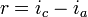 или
или 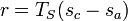 ,
,
где — энтальпия, — энтропия, индекс — относится к состоянию начала кипения, а — к состянию насыщенного пара.
2. Режимы кипения
Начало кипения жидкости связано с прогревом пристенных слоев жидкости до температуры, превышающей температуру насыщения на определенную величину dT . Величина перегрева dT зависит от многих факторов (давления, скорости течения жидкости, краевого угла смачивания, концентрации растворенных в жидкости веществ и.т.д.) и в общем виде не определяется. В зависимости от плотности теплового потока, а так же других факторов, на поверхности обогрева образуются или отдельные паровые пузыри, или сплошная пленка пара, и кипение называется либо пузырьковым либо пленочным. Кроме того, кипение различают по типу:
- кипение при свободной конвекции в большом объеме;
- кипение при вынужденной конвекции;
а так же по отношению средней температуры жидкости к температуре насыщения:
- кипение жидкости, недогретой до температуры насыщения (поверхностное кипение);
- кипение жидкости, догретой до температуры насыщения
2.1. Пузырьковый
Кипение, при котором пар образуется в виде периодически зарождающихся и растущих пузырей, называется пузырьковым кипением. При медленном пузырьковом кипении в жидкости (а точнее, как правило на стенках или на дне сосуда) появляются пузырьки, наполненные паром. За счёт интенсивного испарения жидкости внутрь пузырьков, они растут, всплывают, и пар высвобождается в паровую фазу над жидкостью. При этом в пристеночном слое жидкость находится в слегка перегретом состоянии, т. е. её температура превышает номинальную температуру кипения. В обычных условиях эта разница невелика (порядка одного градуса).
Перемешивание жидкостей
... подхода для изучения различных аспектов этого процесса, особенно перемешивания в медленных потоках и вязких, маслоподобных жидкостях. Хорошим примером служит смешивание двух масляных красок. Буквально ... НЕХАОТИЧЕСКИЙ потоки. Снимки получены К. Ленгом и автором статьи в Массачусетсом университете в Амхерсте. Полость прямоугольной формы заполнена глицерином, непосредственно под поверхность которого ...
Возможность перегрева жидкости объясняется тем, что для создания первичного пузырька минимального размера, который уже дальше может расти сам по себе, требуется затратить некоторую энергию (определяемую поверхностным натяжением жидкости).
Пока это не достигнуто, мельчайшие пузырьки будут возникать и снова схлопываться под действием сил поверхностного натяжения, и кипения не будет.
Пузырьковое кипение может быть развитым (при большом количестве центров парообразования) и неразвитым (при малом количестве центров парообразования)
При пузырьковом кипении существенную роль играет массоперенос пузырьков пара из пристенного слоя в ядро потока. Благодаря этому возрастает эффективность теплоотдачи к кипящей жидкости — характерные для этого режима коэффициенты теплоотдачи высоки.
2.2. Плёночный
При увеличении теплового потока до некоторой критической величины отдельные пузырьки сливаются, образуя у стенки сосуда сплошной паровой слой, периодически прорывающийся в объём жидкости. Такой режим называется плёночным.
В этом режиме теплопередача от обогревающей поверхности к жидкости резко падает (паровая плёнка проводит тепло хуже, чем конвекция в жидкости), и в результате температура греющей поверхности может существенно возрасти (линия С-Е на кривой кипения).
В то же время, при постоянной температуре обогревающей поверхности в режиме пленочного кипения, из-за ухудшенной теплопередачи имеет место низкое значение теплового потока от стенки к жидкости. Режим плёночного кипения можно наблюдать на примере капли воды на раскалённой плите.
При пленочном кипении, из-за существенного термического сопротивления паровой пленки, теплоотдача от греющей поверхности к кипящей воде мала, и характеризуется малыми значениями коэффициента теплоотдачи.
2.3. Кипение в большом объеме
Тепловой поток, передаваемый от поверхности к кипящей воде можно однозначно связать с перепадом температур между стенкой и жидкостью:
-
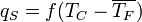 , где — тепловой поток,
, где — тепловой поток, 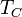 — температура стенки,
— температура стенки, 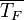 средняя температура жидкости.
средняя температура жидкости.
Эта зависимость характеризует теплоотдачу от обогревающей поверхности к жидкости и называется кривой кипения.
Можно выделить пять характерных областей:
- До точки A . Область конвекции;
- Между точками A и B . Область неразвитого пузырькового кипения. Характеризуется повышением интенсивности теплообмена за счет переноса образующихся пузырьков в ядро потока;
- Между точками B и C . Область развитого пузырькового кипения. Характеризуется высокой интенсивностью теплообмена за счет переноса образующихся пузырьков в ядро потока. Интенсивность нарастает по мере увеличения плотности пузырьков;
- Между точками C и D . Область неустойчивого пленочного кипения. Характеризуется «сливанием» отдельных пузырьков в пристенной области. Из-за уменьшения центров парообразования, а так же нарастания паровой пленки у обогревающей поверхности, теплоотдача падает;
- От точки D . Область устойчивого пленочного кипения. Характеризуется покрытием обогревающей поверхности сплошной пленкой пара и, как следствие, низкой теплоотдачей.
Данную кривую можно получить, увеличивая и поддерживая температуру греющей стенки 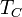 . В этом случае, по мере увеличения
. В этом случае, по мере увеличения 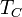 последовательно сменяются пять областей кипения.
последовательно сменяются пять областей кипения.
В случае увеличения и поддержания теплового потока, порядок смены режимов кипения будет иным. Сначала последовательно сменят друг друга режимы конвекции не кипящей жидкости (до т. A ), поверхностного кипения (между точками A и B ) и развитого пузырькового кипения (между точками B и C ).
При дальнейшем увеличении теплового потока обогревающая поверхность быстро покрывается паровой пленкой (от точки C до точки E ), что сопровождается увеличением температур и через короткое время, после достижения стационарного состояния, кипение характеризуется высокой температурой стенки (от точки H ).
Данное явление называется кризисом теплоотдачи, а тепловой поток , при котором начинается резкий рост температур (C —E ) — первым критическим тепловым потоком, или, чаще, просто — критическим тепловым потоком.
Если после достижения точки H тепловой поток начинает уменьшатся, то пленочный режим кипения сохраняется до достижения точки D . В случае дальнейшего уменьшения теплового потока пленочный режим кипения сменяется на пузырьковый (от точки D до точки F ), и температура греющей поверхности быстро снижается. Тепловой поток , при котором пленочный режим кипения сменяется на пузырьковый (D —F ), называется вторым критическим тепловым потоком.
Во многих теплообмеиных устройствах современной энергетики и ракетной техники тепловой поток, который должен отводиться от поверхности нагрева, является фиксированным и часто практически не зависит от температурного режима теплоотдающей поверхности. Так, теплоподвод к внешней поверхности экранных труб, расположенных в топке котельного агрегата, определяется в основном за счет излучения из топочного пространства. Падающий лучистый поток практически не зависит от температуры поверхности труб, пока она существенно ниже температуры раскаленных продуктов сгорания в топке. Аналогичное положение имеет место в каналах ракетных двигателей, внутри тепловыделяющих элементов (твэлов) активной зоны атомного реактора, где происходит непрерывное выделение тепла вследствие ядерной реакции. Поэтому тепловой поток на поверхности твэлов также является заданным. Он является заданным и в случае выделения теплоты при протекании через тело электрического тока.
Если по каким-либо причинам тепловой поток превысили критическое значение , пузырьковый режим кипения быстро сменяется на пленочный, а температура обогревающей поверхности возрастает до существенно высоких значений, что может привести к пережогу обогревающей поверхности. При этом, для восстановления пузырькового режима кипения и исходных значений температур, необходимо снижение теплого потока до значения .
2.4. Кипение при вынужденой конвекции
При вынужденной конвекции кипение имеет ряд особенностей, наиболее существенные из них — влияние характеристик потока на зависимость 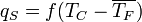 . Наиболее сильное влияние оказывают такие характеристики, как массовая скорость потока жидкости
. Наиболее сильное влияние оказывают такие характеристики, как массовая скорость потока жидкости 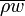 и паросодержание . При установившемся кипении движущейся в трубе жидкости, параметры среды (в первую очередь — паросодержание) изменяются вдоль потока, а в месте с ним сменяются режимы течения и теплоотдача.
и паросодержание . При установившемся кипении движущейся в трубе жидкости, параметры среды (в первую очередь — паросодержание) изменяются вдоль потока, а в месте с ним сменяются режимы течения и теплоотдача.
В большинстве случае кипение в трубе можно упрощенно представить в виде трех зон (на примере кипения в длиной трубе при малых 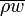 и ):
и ):
- экономайзерный участок, в котором жидкость нагревается без кипения (A − B )
- область кипения (испарительный участок), в которой происходит пузырьковое кипение (B − C − D − E )
- область подсыхания влажного пара, в котором формируется дисперсионный режим течения и происходит осушение остающейся влаги в ядре потока (E − F − G )
На данном примере можно более подробно рассмотреть изменение характера кипения и связанные с этим температуры обогревающей стенки трубы и средней температуры жидкости. На вход в парогенерирующую трубу подается недогретая до кипения жидкость (точка A ).
В случае постоянной величины теплового потока от стенки , средняя температура жидкости 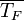 и температура стенки
и температура стенки 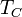 , растут линейно. В момент, когда температура стенки начинает превышать температуру насыщения
, растут линейно. В момент, когда температура стенки начинает превышать температуру насыщения 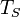 , на обогревающей поверхности может начаться формирование пузырьков. Таким образом, начинается кипение в пристеной области, несмотря на то, что средняя температура жидкости остается меньше температуры насыщения (B − C ).
, на обогревающей поверхности может начаться формирование пузырьков. Таким образом, начинается кипение в пристеной области, несмотря на то, что средняя температура жидкости остается меньше температуры насыщения (B − C ).
Это явление носит название кипения недогретой жидкости . Значение энтальпийного паросодержания, при котором начинается кипение недогретой жидкости имеет отрицательное значение . После достижения жидкостью температуры насыщения начинается пузырьковое кипение по всему объему жидкости. Эта область характеризуется интенсивным перемешиванием жидкости и, как следствие, высокими коэффициентами теплоотдачи и низкими перепадами температур.
По мере продвижения двухфазной смеси в область высоких паросодержаний сменяются режимы течения двухфазного потока, и при некотором паросодержании наступает кризис теплоотдачи: контакт жидкости с поверхностью прекращается и температура стенки возрастает (E ).
Часто кризис теплоотдачи при кипении представляет переход от дисперсно-кольцевого режима кипения (D − E ) к дисперсному (E − F − G ).
Количество влаги в каплях с ростом паросодержания уменьшается, что приводит к возрастанию скорости и небольшому увеличению теплоотдачи (температура поверхности стенки при этом немного снижается, (F − G )).
При иной массовой скорости жидкости 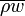 или величине теплового потока , характер кипения в трубе может измениться. Так, в случае больших
или величине теплового потока , характер кипения в трубе может измениться. Так, в случае больших 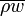 и , режим кризиса теплообмена может сформироваться еще на этапе кипения недогретой жидкости. В этом случае формируется пленочный режим кипения, а ядро потока представляет собой стержень недогретой до температуры насыщения жидкости, отделенной от стенки трубы пленкой пара.
и , режим кризиса теплообмена может сформироваться еще на этапе кипения недогретой жидкости. В этом случае формируется пленочный режим кипения, а ядро потока представляет собой стержень недогретой до температуры насыщения жидкости, отделенной от стенки трубы пленкой пара.
3. Температуры кипения для простых элементов
В приведенной таблице элементов Д. И. Менделеева для каждого элемента указаны:
- атомный номер элемента;
- обозначение элемента;
- температура насыщение при нормальных условиях O C ;
- молярная скрытая теплота парообразования (кДж/моль);
- молярная масса.
| Группа → |
I A |
II A |
III B |
IV B |
V B |
VI B |
VII B |
VIII B |
VIII B |
VIII B |
I B |
II B |
III A |
IV A |
V A |
VI A |
VII A |
VIII A |
||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Период | ||||||||||||||||||||
| 1 | 1
H -253 0,449 1,008 |
2
He -268 0,0845 4,003 |
||||||||||||||||||
| 2 | 3
Li 181 145,9 6,941 |
4
Be 2477 292,4 9,012 |
5
B 3927 489,7 10,81 |
6
C ~4850 355,8 12,01 |
7
N -196 2,793 14,01 |
8
O -183 3,410 16,00 |
9
F -188 3,270 19,00 |
10
Ne -246 1,733 20,18 |
||||||||||||
| 3 | 11
Na 883 96,96 22,99 |
12
Mg 1090 127,4 24,33 |
13
Al 2467 293,4 26,98 |
14
Si 2355 384,2 28,09 |
15
P 277 12,13 30,97 |
16
S 445 9,6 32,07 |
17
Cl -34 10,2 35,45 |
18
Ar -186 6,447 39,95 |
||||||||||||
| 4 | 19
K 759 79,87 39,10 |
20
Ca 1484 153,6 40,08 |
21
Sc 2830 314,2 44,96 |
22
Ti 3287 421 47,87 |
23
V 3409 452 50,94 |
24
Cr 2672 344,3 52,00 |
25
Mn 1962 226 54,94 |
26
Fe 2750 349,6 55,85 |
27
Co 2927 376,5 58,93 |
28
Ni 2913 370,4 58,69 |
29
Cu 2567 300,3 63,55 |
30
Zn 907 115,3 65,41 |
31
Ga 2204 258,7 69,71 |
32
Ge 2820 330,9 72,64 |
33
As 616 34,76 74,92 |
34
Se 221 26,3 78,96 |
35
Br 59 15,44 79,9 |
36
Kr -153 9,029 83,80 |
||
| 5 | 37
Rb 688 72,22 85,47 |
38
Sr 1382 144 87,62 |
39
Y 2226 363 88,91 |
40
Zr 4409 591,6 91,22 |
41
Nb 4744 696,6 92,91 |
42
Mo 4639 598 95,94 |
43
Tc 4877 660 98,91 |
44
Ru 4150 595 101,1 |
45
Rh 3695 493 102,9 |
46
Pd 2963 357 106,4 |
47
Ag 2162 250,6 107,9 |
48
Cd 767 100 112,4 |
49
In 2072 231,5 114,8 |
50
Sn 2602 295,8 118,7 |
51
Sb 1587 77,14 121,8 |
52
Te 450 52,55 127,6 |
53
I 184 20,75 126,9 |
54
Xe -108 12,64 131,3 |
||
| 6 | 55
Cs 705 67,74 132,9 |
56
Ba 1640 142 137,3 |
* | 72
Hf 4603 575 178,5 |
73
Ta 5458 743 180,9 |
74
W 5555 824 183,8 |
75
Re 5596 715 186,2 |
76
Os 5012 627,6 190,2 |
77
Ir 4428 604 192,2 |
78
Pt 3827 510 195,1 |
79
Au 2856 334,4 197,0 |
80
Hg 357 59,23 200,6 |
81
Tl 1473 164,1 204,4 |
82
Pb 1749 177,7 207,2 |
83
Bi 1564 104,8 209,0 |
84
Po 962 120 209,0 |
85
At 337 30 210,0 |
86
Rn -62 16,4 222,0 |
||
| 7 | 87
Fr 667 64 223 |
88
Ra 1737 137 226,0 |
** | 104
Rf n/a n/a 261 |
105
Db n/a n/a 262 |
106
Sg n/a n/a 263 |
107
Bh n/a n/a 262 |
108
Hs n/a n/a 265 |
109
Mt n/a n/a 268 |
110
Ds n/a n/a 281 |
111
Rg n/a n/a 280 |
112
Cn n/a n/a n/a |
113
Uut n/a n/a n/a |
114
Uuq n/a n/a n/a |
115
Uup n/a n/a n/a |
116
Uuh n/a n/a n/a |
117
Uus n/a n/a n/a |
118
Uuo n/a n/a n/a |
||
| * Лантаноиды | 57
La 3457 414 138,9 |
58
Ce 3426 414 140,1 |
59
Pr 3520 297 140,9′ |
60
Nd 3100 273 144,2 |
61
Pm ~3500 n/a 146,9 |
62
Sm 1803 166 150,4 |
63
Eu 1527 144 152,0 |
64
Gd 3250 359 157,3 |
65
Tb 3230 331 158,9 |
66
Dy 2567 230 162,5 |
67
Ho 2695 241 164,9 |
68
Er 2510 193 167,3 |
69
Tm 1947 191 168,9 |
70
Yb 1194 127 173,0 |
71
Lu 3395 356 175,0 |
|||||
| ** Актиноиды | 89
Ac 3200 293 227,0 |
90
Th 4788 514,4 232,0 |
91
Pa 4027 470 231,0 |
92
U 4134 423 238,0 |
93
Np 3902 n/a 237,0 |
94
Pu 3327 325 244,1 |
95
Am 2607 239 243,1 |
96
Cm 3110 n/a 247,1 |
97
Bk n/a n/a 247 |
98
Cf n/a n/a 251 |
99
Es n/a n/a 253 |
100
Fm n/a n/a 255 |
101
Md n/a n/a 256 |
102
No n/a n/a 255 |
103
Lr n/a n/a 260 |
|||||
| 0—10 кДж/моль | 10—100 кДж/моль | 100—300 кДж/моль | >300 кДж/моль |
Примечания , Литература
[Электронный ресурс]//URL: https://drprom.ru/referat/kipenie-klass/
- Исаченко В. П., Осипова В. А., Сукомел А. С. Теплопередача. — М .: Энергия, 1969.
- Кикоин И. К., Кикоин А. К. Молекулярная физика. — М ., 1963.
- Радченко И. В. Молекулярная физика. — М ., 1965.
- Михеев М. А. Глава 5 // Основы теплопередачи. — 3-е изд. — М .—Л. , 1956.
- Петухов Б. С., Генин Л. Г., Ковалев С. А. Теплообмен в ядерных энергетических реакторах. — М .: Энергоатомиздат, 1986.
- Кириллов П. Л., Юрьев Ю. С., Бобков В. П. Справочник по теплогидравлическим расчетам. — М .: Энергоатомиздат, 1990.
- Кипение — slovari.yandex.ru/кипение/БСЭ/Кипение/ . Большая советская энциклопедия . slovari.yandex.ru.
Данный реферат составлен на основе .
